Водородные связи в структурах белка, расшифрованных с помощью ЯМР и РСА
Для работы был выбран основной белок связывающий жирные кислоты из печени курицы.
Идентификатор структуры, полученной с помощью РСА 1TVQ. Эта модель имеет разрешение 2 ангстрема. Идентификатор струтуры, решенной посредством ЯМР 1MVG. Она содержит в себе 10 моделей.
Рассматриваемые структуры имеют одинаковые укладки. В этом можно убедиться с помощью рисунков, представленных ниже.

Рис.1. Совмещение всех 10 моделей структуры 1MVG(ЯМР). Раскраска по элементам вторичной структуры.
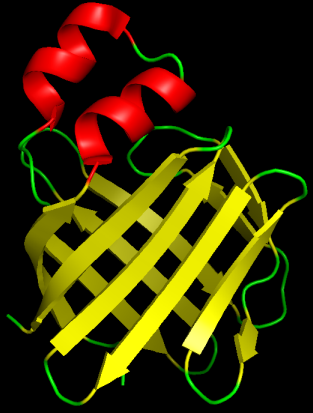
Рис.2. Структура 1TVQ (РСА). Раскраска по элементам вторичной структуры.

Рис.3. Совмещение структуры 1TVQ (РСА) и усредненной 1MVG (ЯМР).
Для анализа были выбраны три водородных связи в различных положениях. Здесь будем считать, что между днором и акцептором есть водородная связь, если расстояние между ними меньше 3,5 ангстрем и воображаемый водород отклоняется от прямой донор-акцептор менее, чем на 70 градусов.
Для этих трех связей были измерены расстояния между донором и акцептором в структуре 1TVQ и в каждой из 10 моделей 1MVG. Информация о рассмотренных связях занесена в таблицу. Сессия PyMol сохранена в файл.
| № пары | Акцептор | Донор | Расположение связи | Расстояние в РСА, Å | Число моделей ЯМР | % моделей ЯМР | Min расстояние в ЯМР, Å | Max расстояние в ЯМР, Å | Медиана расстояния в ЯМР, Å |
| 1 | GLU'109/N | ARG'120/O | остов, ядро, бета-лист | 2,9 | 10 | 100 | 1,9 | 2 | 2 |
| 2 | ARG'121/NH2 | GLU'12/OE2 | боковые цепи, поверхность, бета-лист | 2,8 | 0 | 0 | 5,5 | 10,7 | 8,3 |
| 3 | GLN'56/N | THR'53/O | остов,поверхность, петля | 3,3 | 5 | 50 | 3 | 3,8 | 3,5 |
Первая связь одинаково неподвижна как в кристалле, так и в растворе. Это остовная связь в самой середине бета-листа. Она поддерживает прочную вторичную структуру и поэтому не лабильна. Небольшая длина связи свидетельствет о её силе. В случае ЯМР её длина оказалась даже короче чем в РСА.
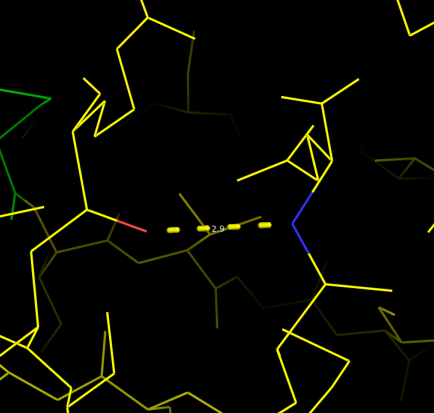
Рис.4. Водородная связь №1 в структуре 1TVQ(РСА).
Вторая связь совсем присутствует только в структуре, решенной с помощью РСА. Это связь между длинными боковыми цепями в середине бета-листа(рядом сосвязью №1). Расстояние между атомами в ЯМР структуре не позволяет назвать её связью. Вероятно, эта связь неподвижна только в кристалле и исключительно подвижна в расстворе. По всей видимости, именно сильные колебания не позволили наблюдать её в ЯМР эксперименте. Такой эффект может быть вызван поверхностным её расположением, отсутствием какой-либо стабилизации и небольшой функциональной важностью.

Рис.5. Водородная связь №2 на совмещении структур 1TVQ и 1MVG. Голубым обозначена 1TVQ(РСА), а 1MVG-желтым.
Последняя водородная связь имеется ровно у половины ЯМР-моделей. Она расположена в петле близко к поверхности белка. Стоит отметить что у второй половины ЯМР-моделей расстояние между донором и акцептором едва выше 3.5 ангстрем. Кроме того, медиана составляет 3.5 ангстрема. Эта связь фиксирует петлю и достаточно жестка. Тем не менее расположение у поверхности, вероятно приводит к увеличению подвижности в растворе. Это согласуется с наблюдениями, описанными выше.
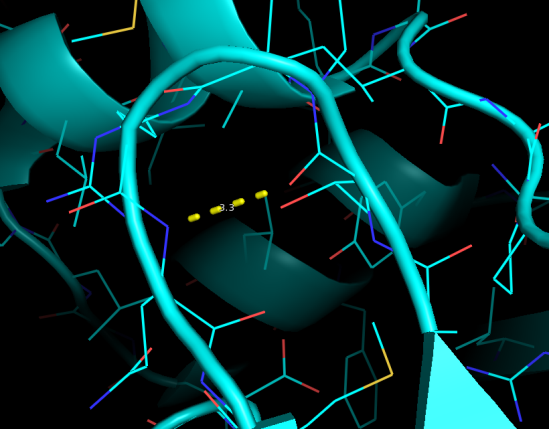
Рис.6. Водородная связь №3 в 1TVQ(РСА).