.jpg)
.jpg)
PDB ID 1BKG соответствует белку-ферменту аспартатаминотрасферазе
(альтернативные названия: АСТ, АсАт, глутамат оксалоацетат трансаминаза)
из грамотрицательной бактерии Thermus thermophilus HB8. Судя по представленным
данным, белок был наработан с помощью экспрессионной системы в
Escherichia coli
(E. Coli).
АсАт катализирует превращение оксалоацетата в аспартат, перенося NH3 на первую молекулу.
Реакция приведена ниже:
.jpg)
Ассиметрическое звено состоит из двух "слипшихся" между собой димеров. В структуре (ассиметрической единнице) присутствует 4 идентичные полимерные цепи (субъединицы), то есть белок – гомотетрамер.
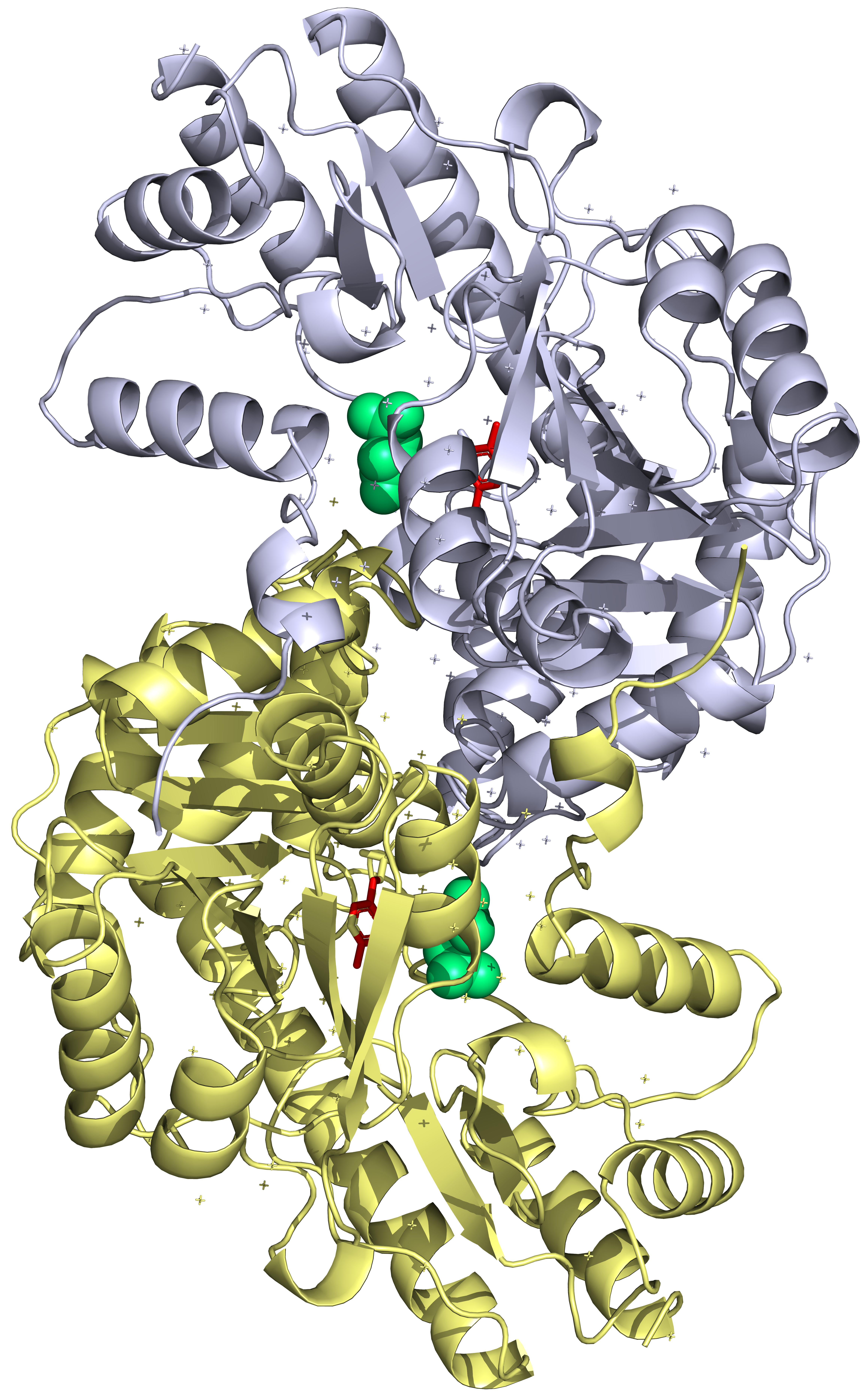
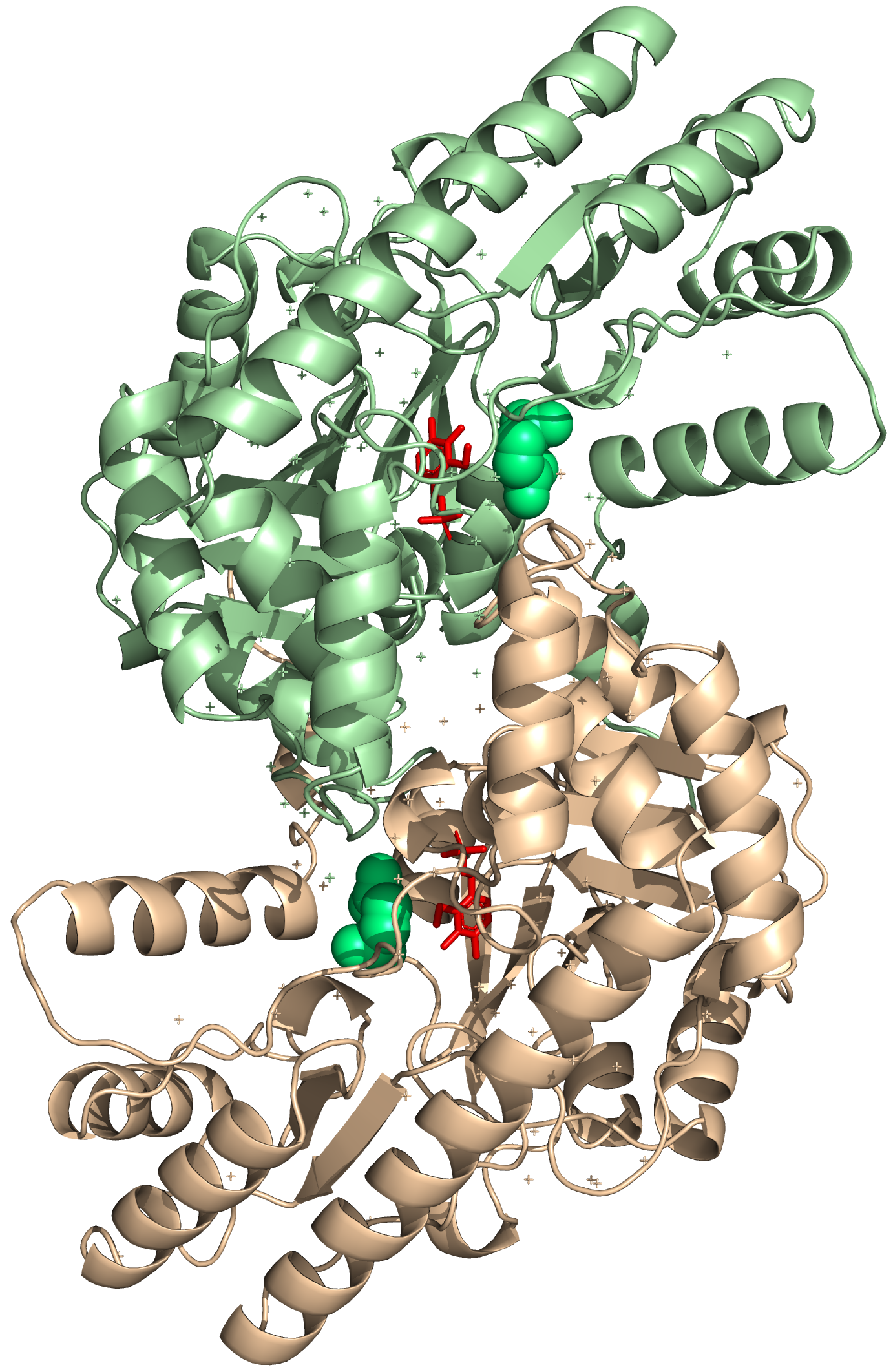
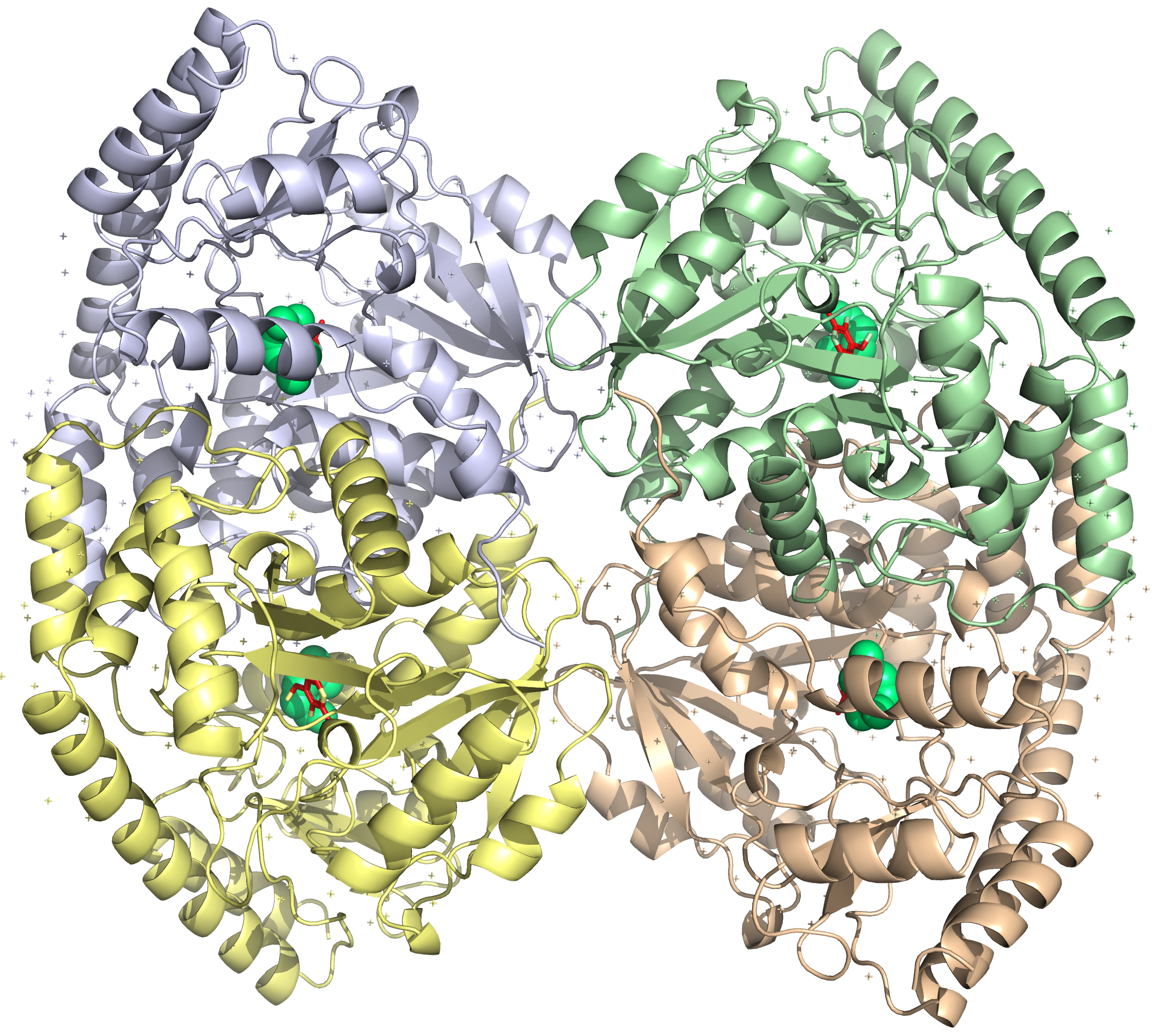
По данным UniProt:
UniProt_ID: Q56232
Белок: Aspartate/prephenate aminotransferase
Ген: aspC
Белок катализирует обратимое превращение аспартата и 2-оксоглутарата в глутамат и оксалоацетат.
Мутации в последовательности относительно референса из Uniprot отсутствуют (SEQADV).
Модифицированные аминокислотные остатки (MODRES) отсутствуют.
На приведенной ниже картинке изображен белок, покрашенный по типу вторичной структуры. Как можно заметить, он представлен преимущественно спиралями (72). Бета-листов, в свою очередь, 36.
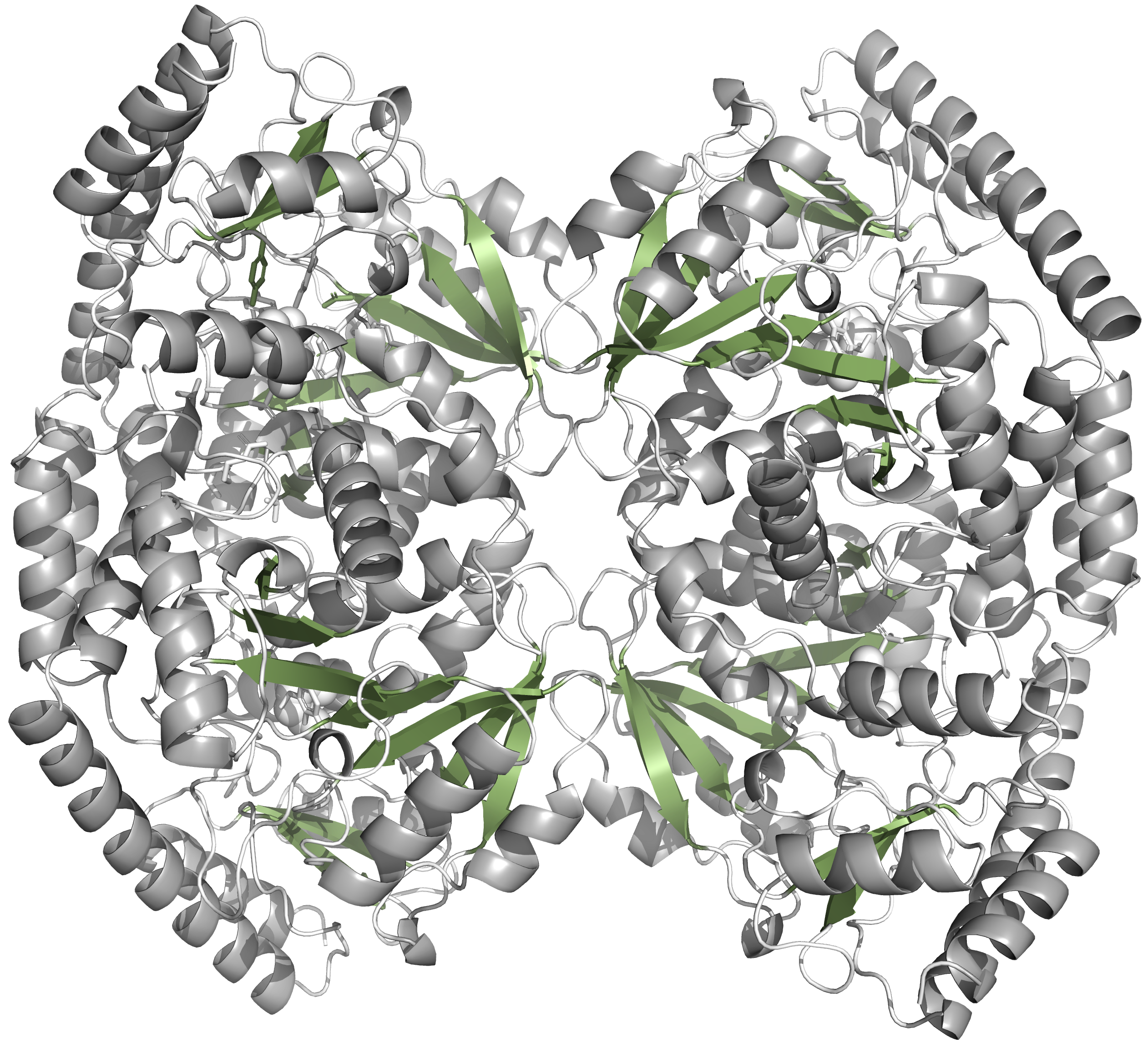
В записи присутствуют 2 (3, если учесть воду) вида малых молекул:
[1] 4’-DEOXY-4’-AMINOPYRIDOXAL-5’-PHOSHPHATE (PMP).
[2] MALEIC ACID (MAE) – малеиновая кислота.
[3*] Water (H2O)
Информацию из PDB по малым молекулам можно найти здесь.
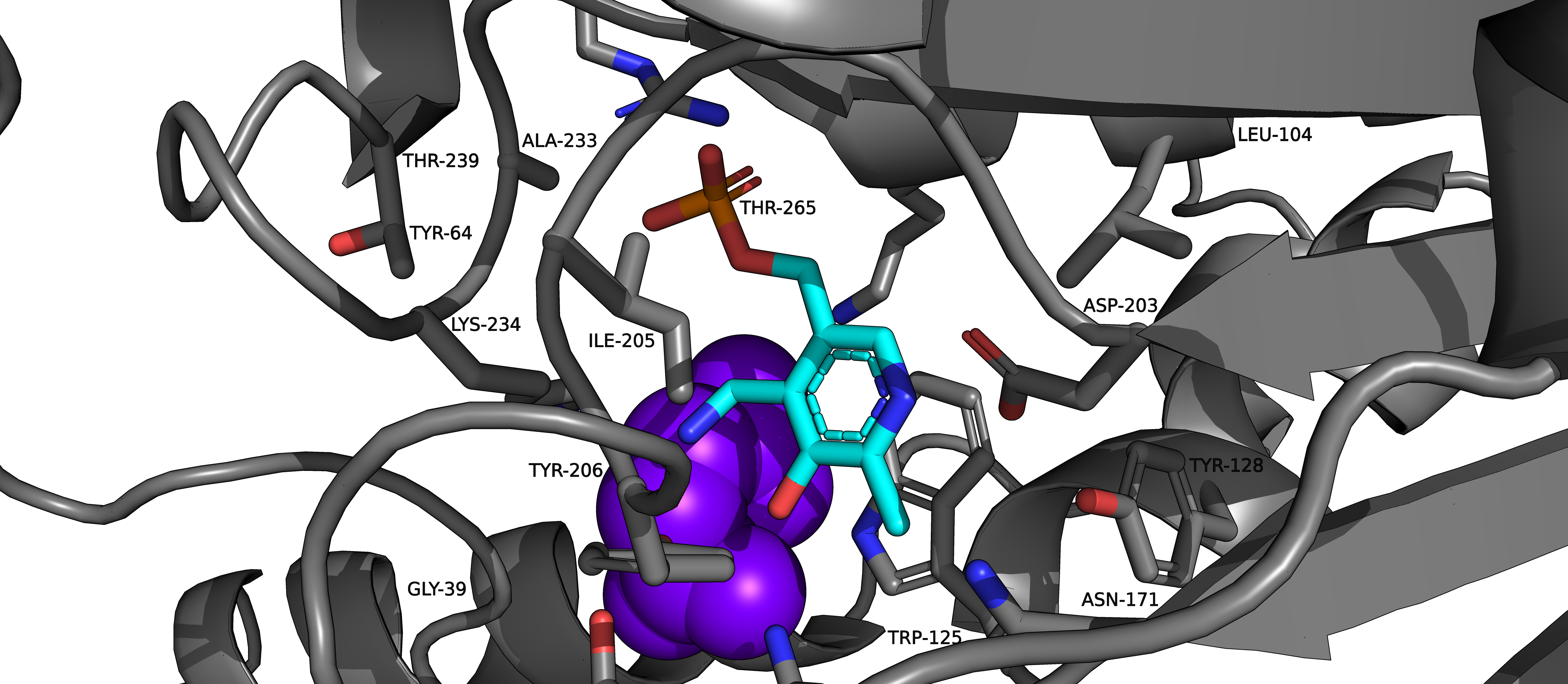
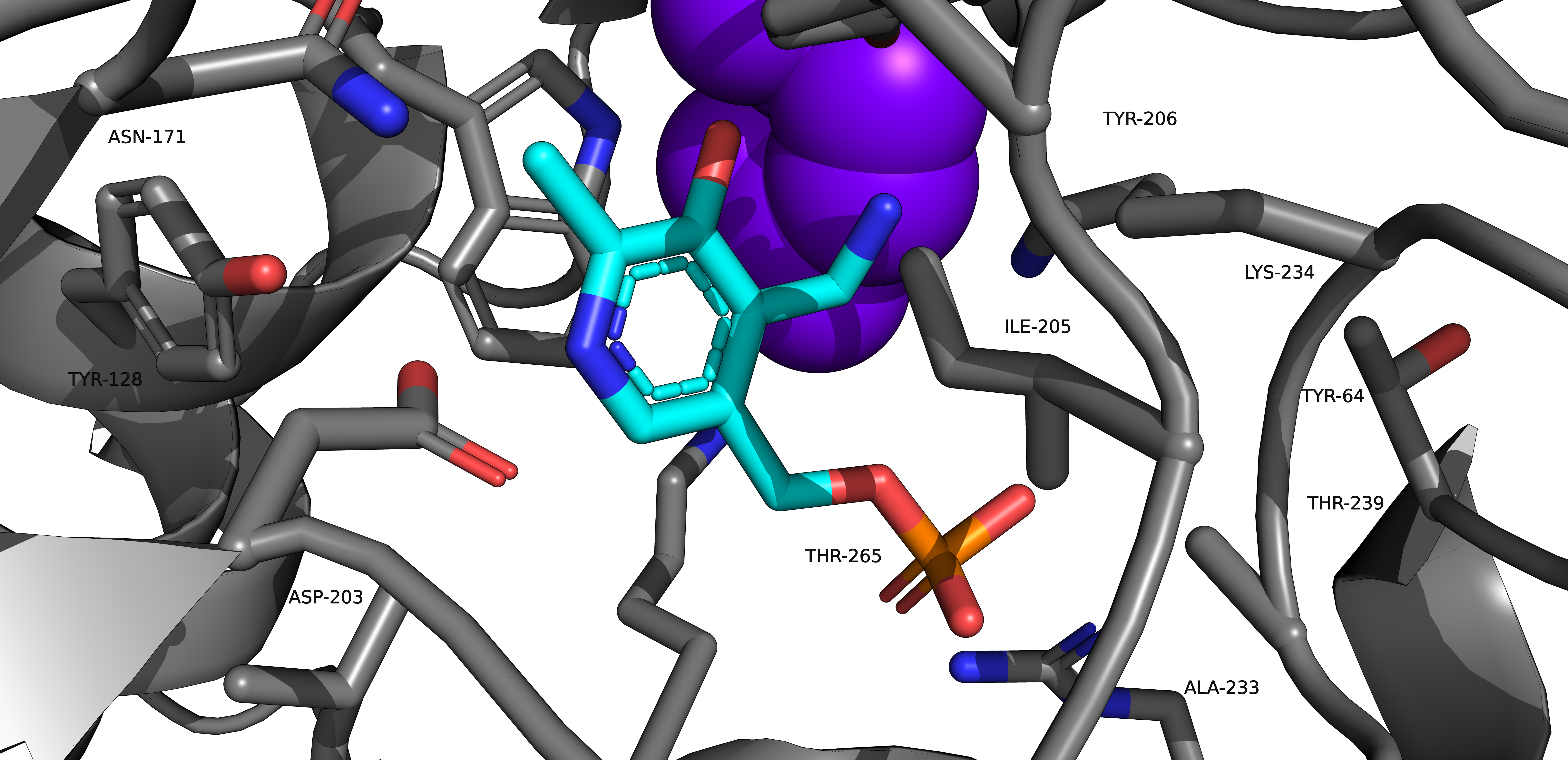
Присутствие в пробе PMP и MAE обусловлено способом получения рассматриваемого белка (ACT). Фермент PLP-типа превращали в PMP-тип путем добавления цистеинсульфината. Далее раствор выдерживали 30 мин при комнатной температуре, избыток цистеинсульфината удаляли с помощью сефадекса. Каплю белкового раствора смешивали с равным объемом резервуарного раствора и уравновешивали определенным количеством резервуарного раствора при 20 °C с получением кристаллов tAspAT типа PMP в комплексе с малеатом [1]. Таким образом, присутствие этих малых молекул - изжержки метода получения белка.
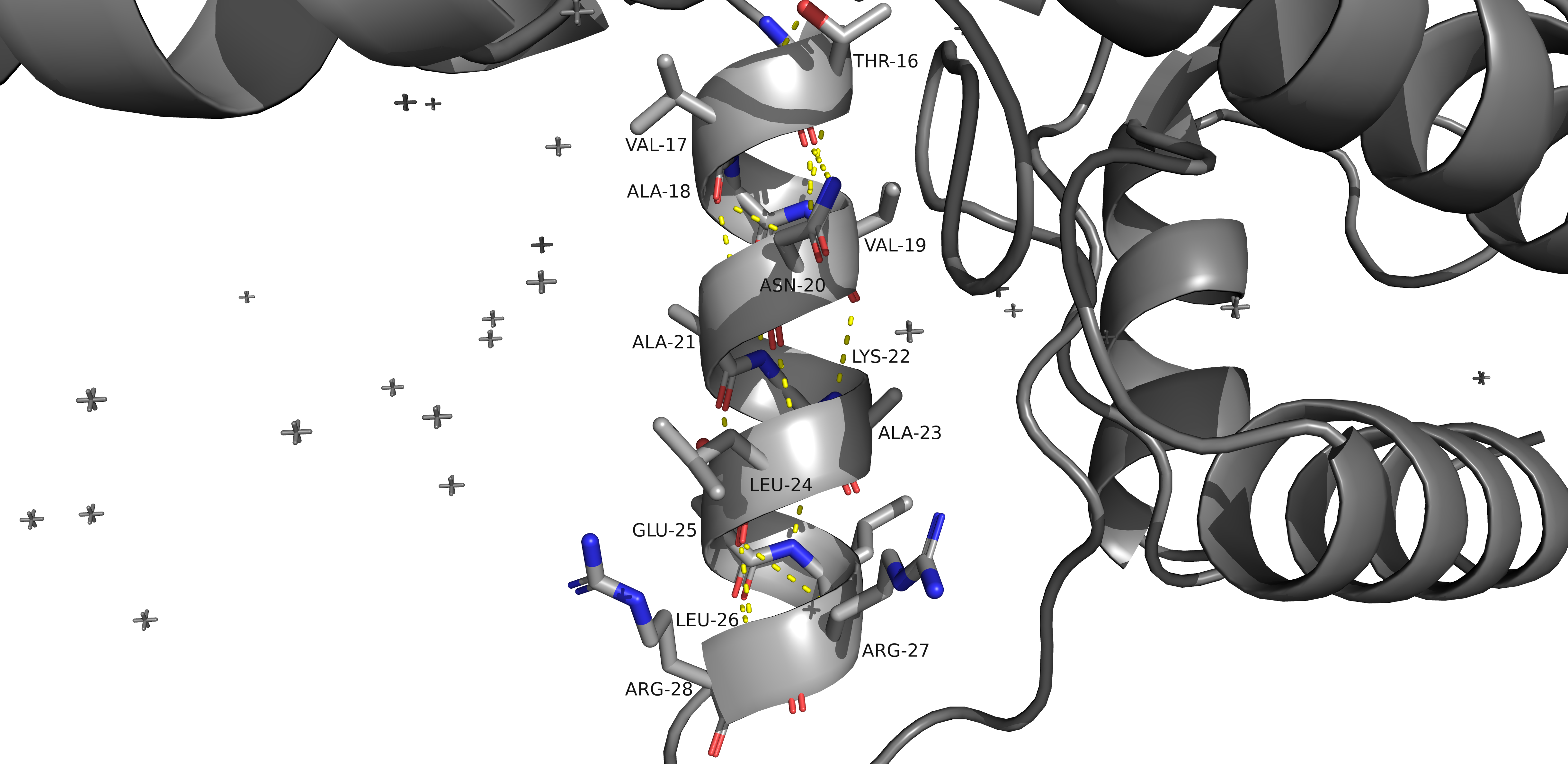
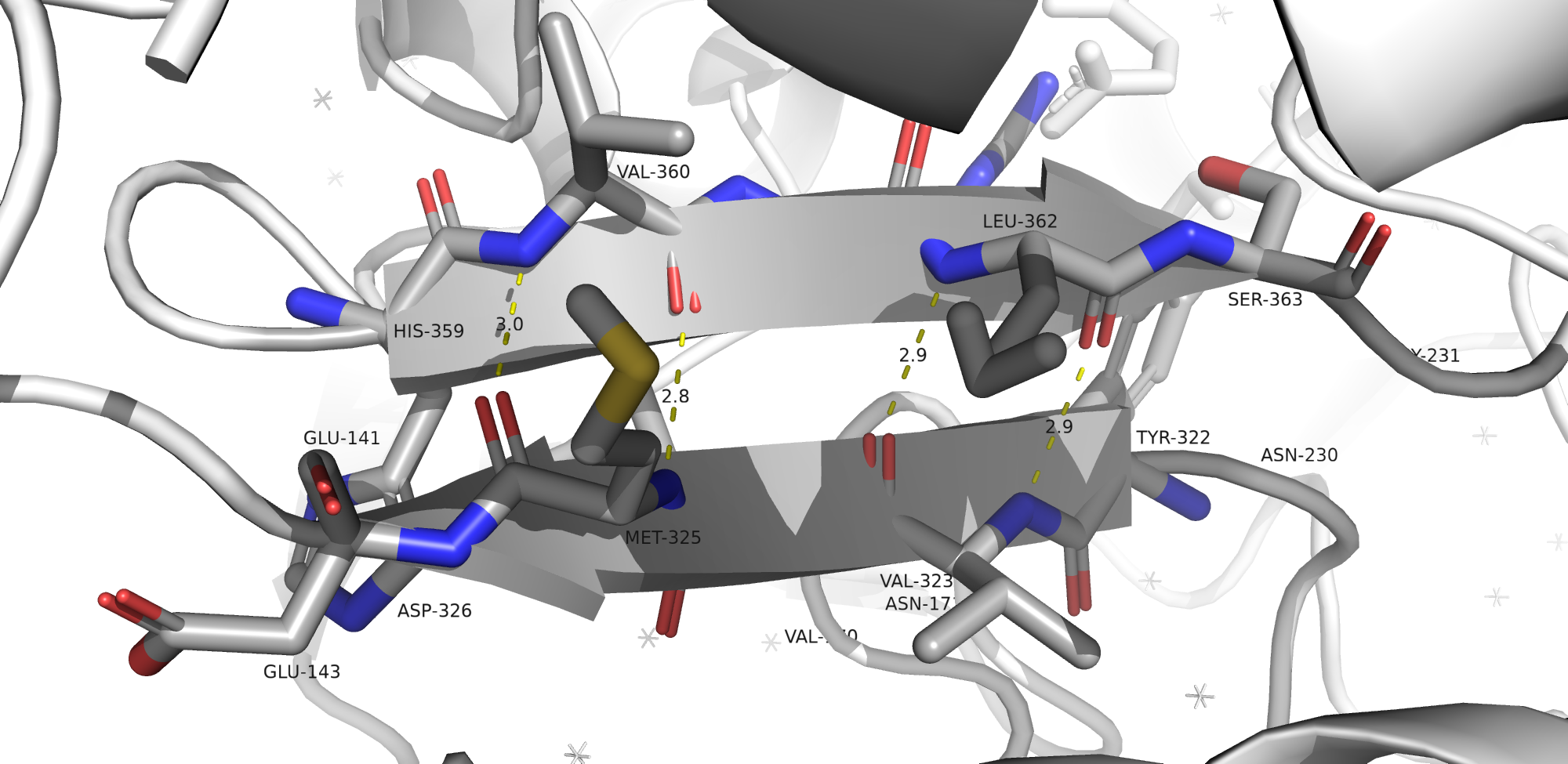
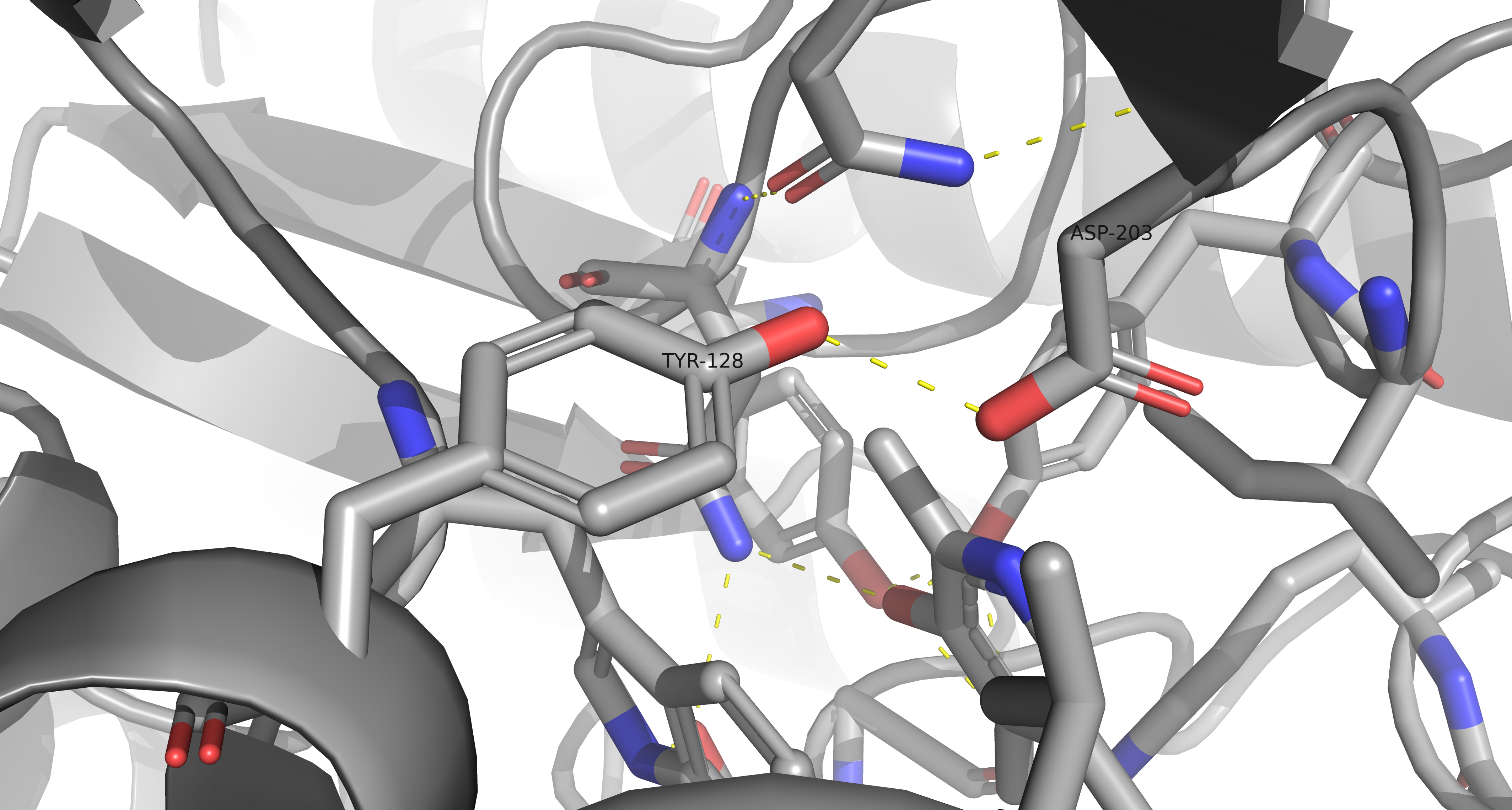
На приведенных ниже рисунках можно увидеть водородные связи, затрагивающие атомы остова белка (рис. 8-10) и атомы боковых радикалов (рис. 11). На картинках отмечены аминокислоты, участвующие в формировании связей, а также длины водородных связей (в ангстремах).
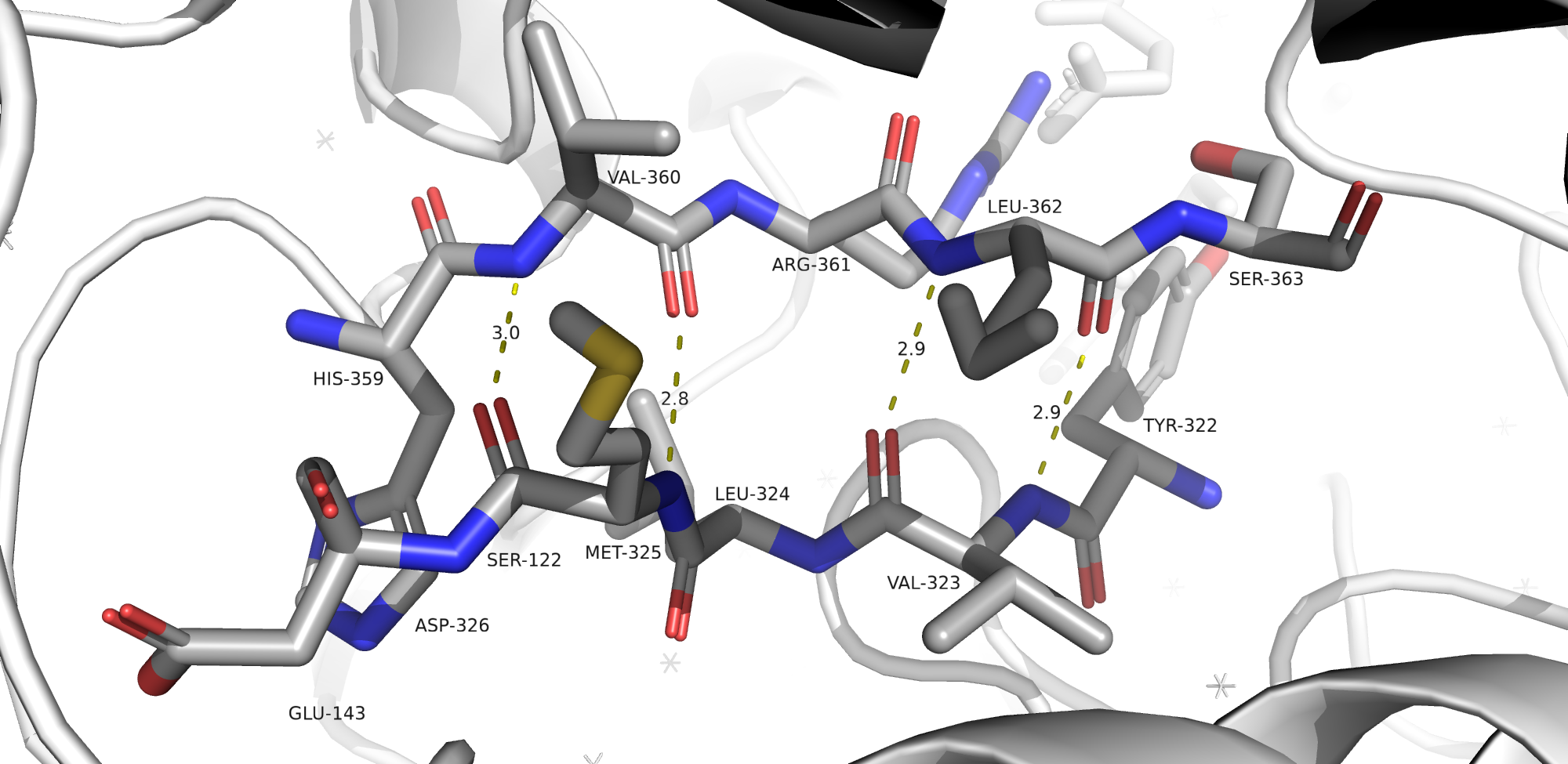
Водородная связь, затрагивающая атомы боковых радикалов аминоксилот (в моем случае - Tyr и Asp) отражена на рисунке 11.
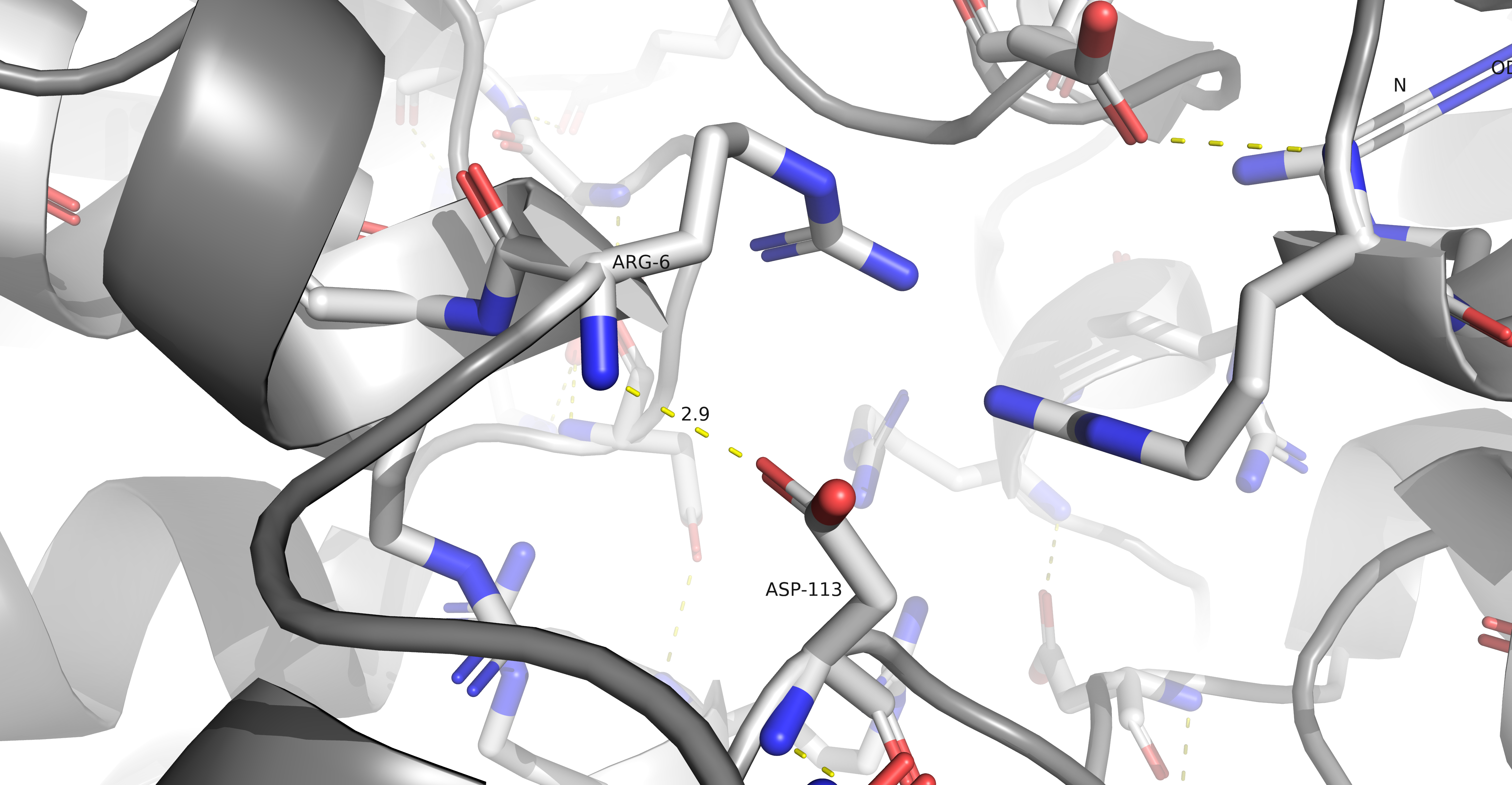
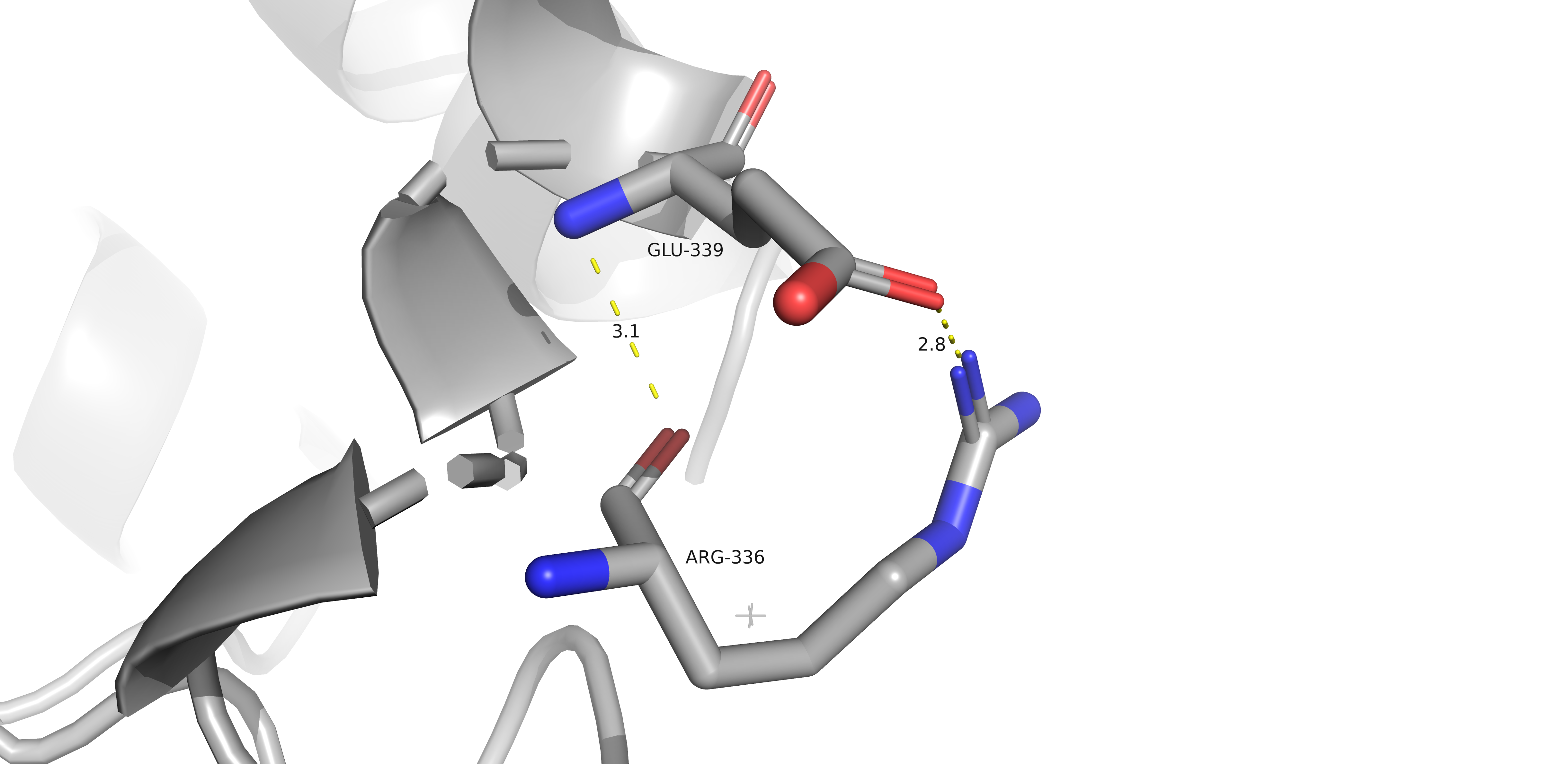
Ниже можно найти солевые мостики:
Дисульфидные связи отсутствуют, так как молекулы цистеина (Cys) расположены далеко друг от друга.
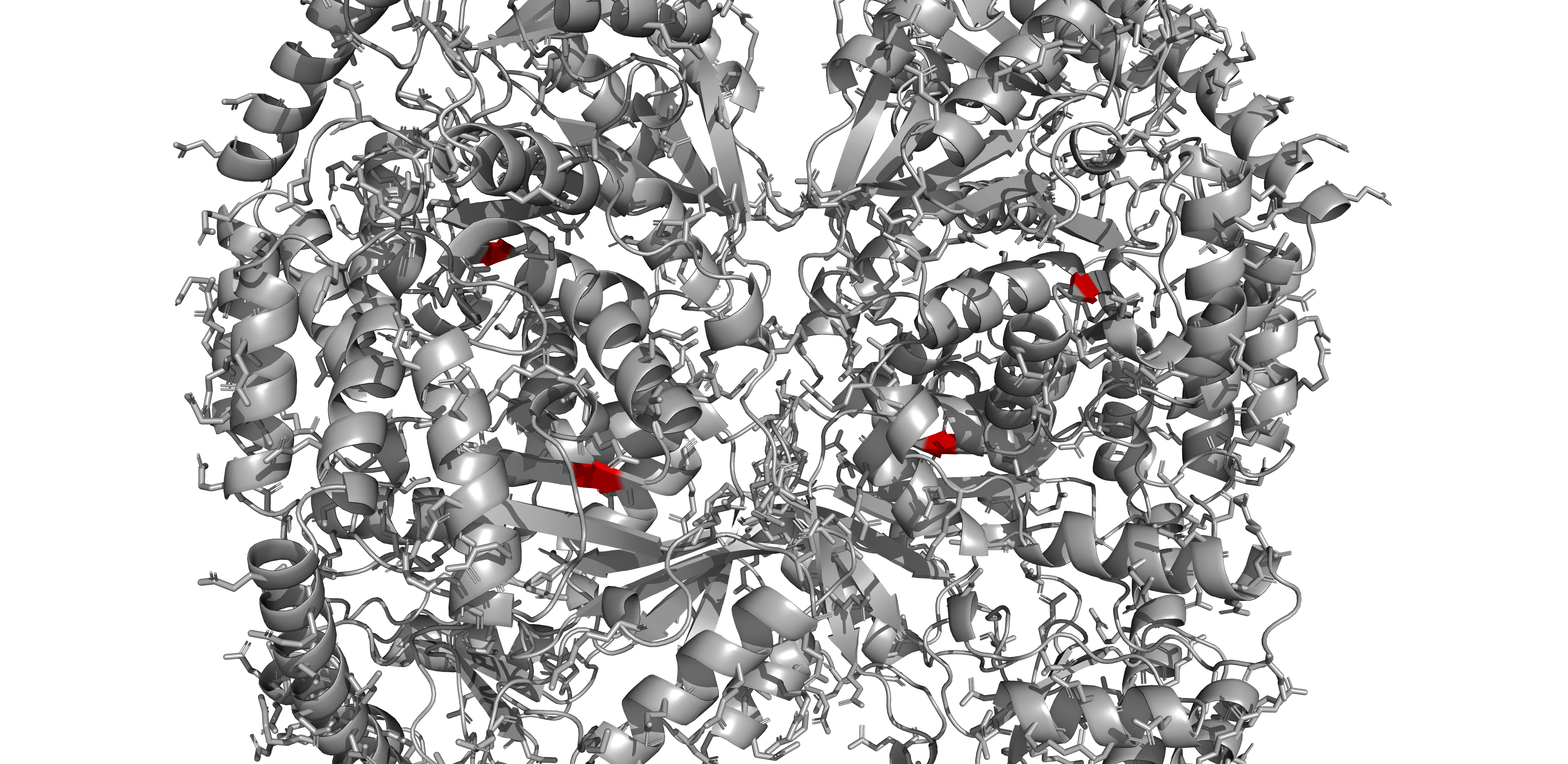
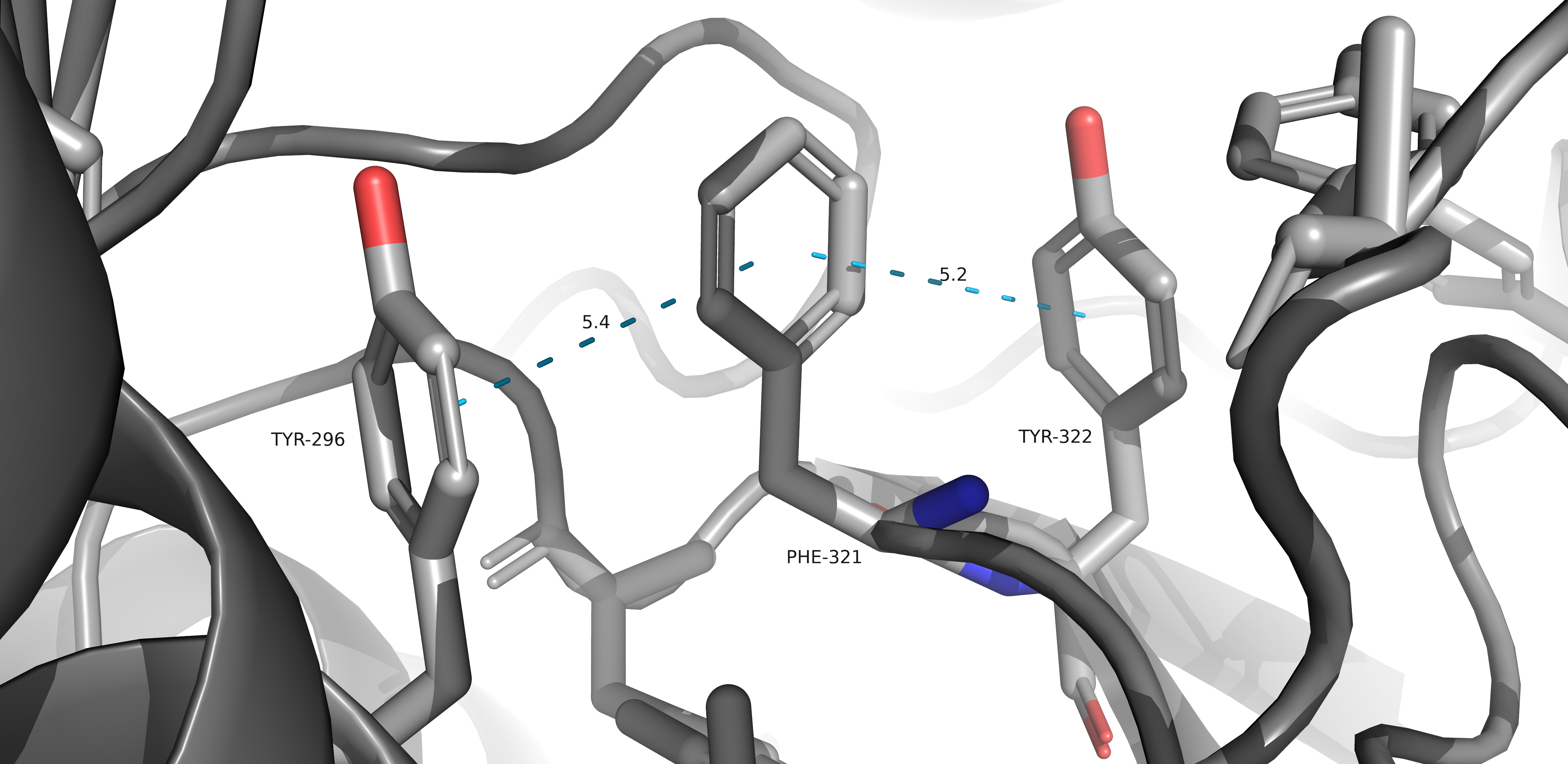
Т-стэкинг можно обнаружить в данном белке.
[1] Nakai T, Okada K, Akutsu S, Miyahara I, Kawaguchi S, Kato R, Kuramitsu S, Hirotsu K. Structure of Thermus thermophilus HB8 aspartate aminotransferase and its complex with maleate. Biochemistry. 1999 Feb 23;38(8):2413-24. doi: 10.1021/bi9819881. PMID: 10029535.