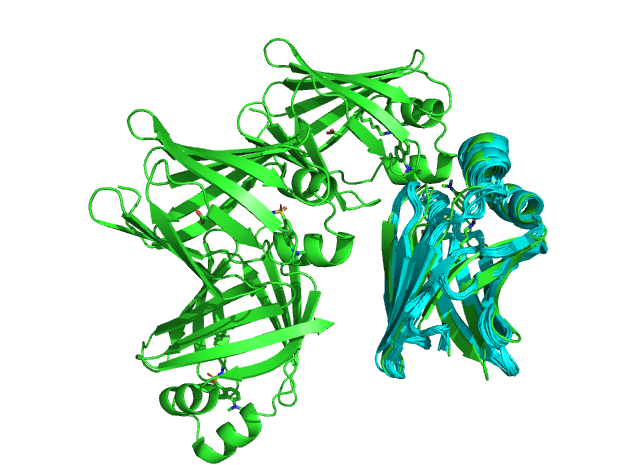
Были рассмотрены 2 структуры, соответствующие белку, связывающему жирные кислоты - FABP. На рисунках 1 и 2 представлены визуализации 20 конформеров ЯМР-структуры 3AKM (голубые) и одной из цепей РСА-структуры 6L7K (зеленая). Видно, что элементы вторичной структуры на рисунках практически полностью соответствуют друг другу, за исключением фрагментов бета-листов, отмеченных черным кругом на рисунке 2 и не отображённых в ЯМР-структуре, так как у ЯМР есть ограничения на определённые расстояния, в том числе это сказывается и на водородных связях, определяющих вторичную структуру. В конформерах ЯМР N-концы расходятся, и ни один из них не накладывается на N-конец РСА Это говорит о природной подвижности N-конца, а также может быть связано с тем, что в статье 1 из возможных механизмов захода лиганда в активный центр белка связан с областью N-конца (отрывок из статьи на RSCB PDB: «Previous molecular dynamics (MD) studies suggested three possible ligand entry sites for ligand and water to enter into or exit from the protein cavity: EI, located in the cap region involving the second α-helix (α2) and βC–βD and βE−βF turns; EII, the gap between βD and βE; and EIII, in the area around the N-terminus.») Остатки в одной из петель (на рисунке 3) находятся в перпендикулярных относительно друг друга плоскостях, что связано с неструктурированностью петель.

Рис. 1. Общий вид структур ЯМР(6L7K) и РСА(3AKM) белка FABP
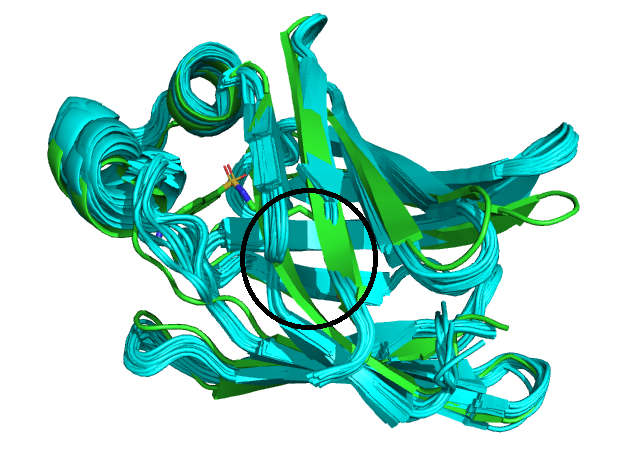
Рис. 2. Структура ЯМР(6L7K),голубая, и А-цепь структуры РСА(3AKM),зеленая, наложенные командой super. Черным кругом показано место несовпадения вторичных структур.
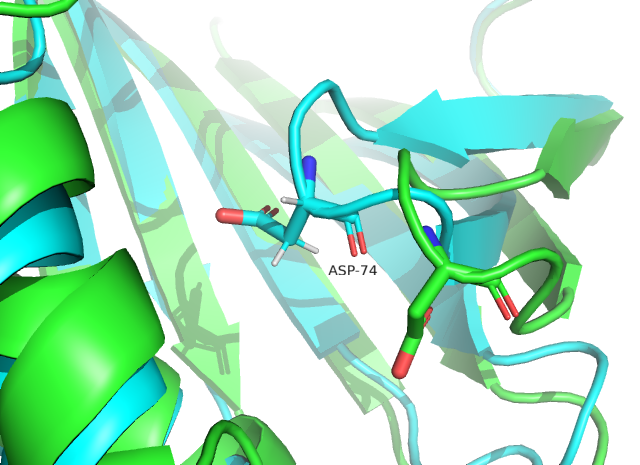
Рис. 3. ASP 74 в структурах
Нужно посмотреть на связь между RMSF (среднеквадратичной флуктуацией) остатков ЯМР-структуры и B-фактором остатков РСА-структуры, которая характеризует, насколько по-разному размещается один атом в разных структурах (конформерах). B-фактор, характеризуя неопределённость положения координат атома, может служить некой оценкой подвижности. Если зависимость между этими параметрами окажется положительной, то ансамбль моделей, полученных методом ЯМР, действительно можно будет принять за отражение подвижности белка. Для проверки этого были взяты остатки данных структур, построен график, отражающий зависимость RMSF от B-фактора остатков (средние величины), а также посчитана корреляция Спирмана.
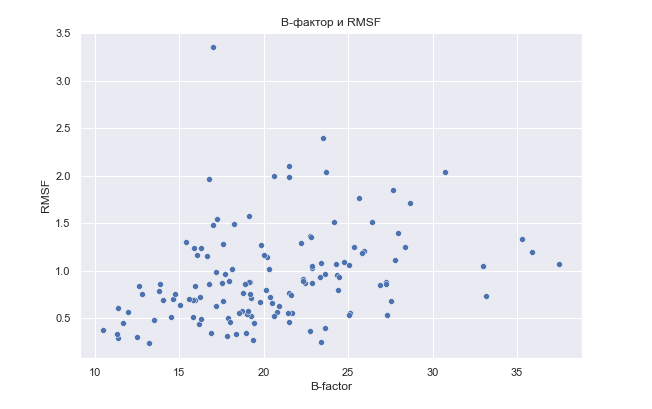
График зависимости средней RMSF от среднего B-фактора остатков
Коэффициент корреляции Спирмана (0.395) при p-value (2.93*10^(-6)) может говорить о положительной монотонной зависимости. То есть, данный ансамбль ЯМР-моделей можно принимать за отражение подвижности белка.
На рисунках 4 и 5 водородные связи расположены внутри глобулы. Судя по ним уже можно сделать вывод о том, что водородные связи внутри глобулы достаточно стабильны, так как гидрофобное окружение внутри глобулы увеличивает силу полярных взаимодействий. А на поверхности (рисунок 6) водородные связи очень нестабильны, так как остатки находятся в растворе и могут им сольватироваться (что видно на рисунке 6 по количеству различных конформеров остатков, участвующих в образовании связи). Полученные значения в таблице 1 подтверждают высказанные суждения.
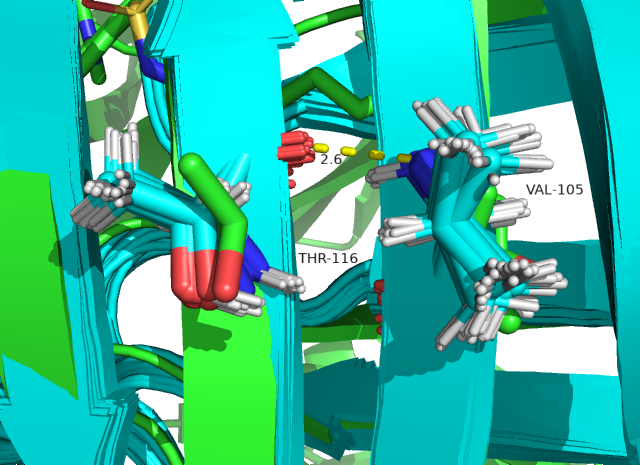
Рис. 4. Остовный кислород THR 116, остовный азот VAL 105 в бета-листе внутри глобулы
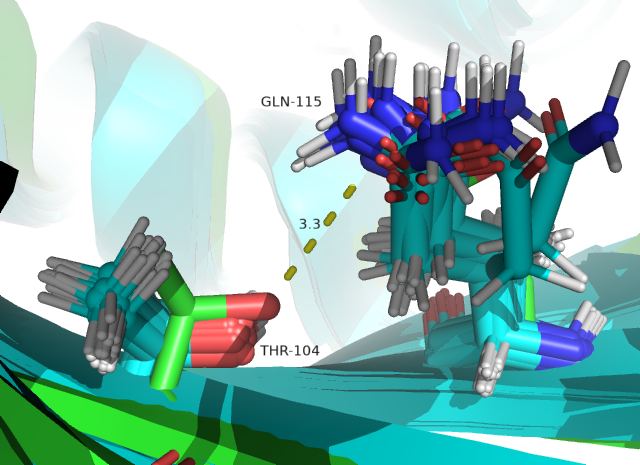
Рис. 5. ОН THR 104 – NE2 GLN 115 в бета-листе внутри глобулы
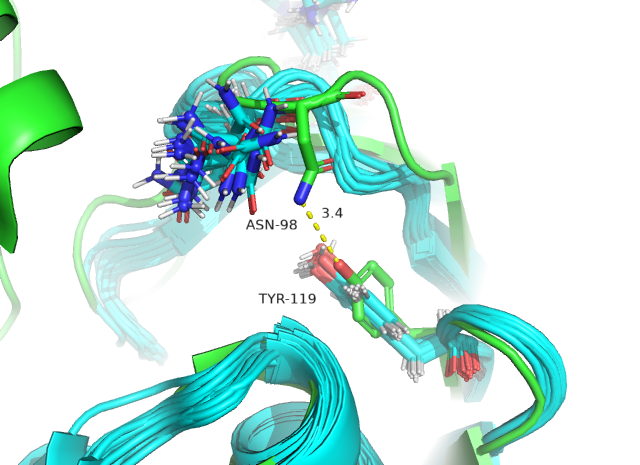
Рис. 6. ОН TYR 119 – ND2 ASN 98, выходящие на поверхность глобулы
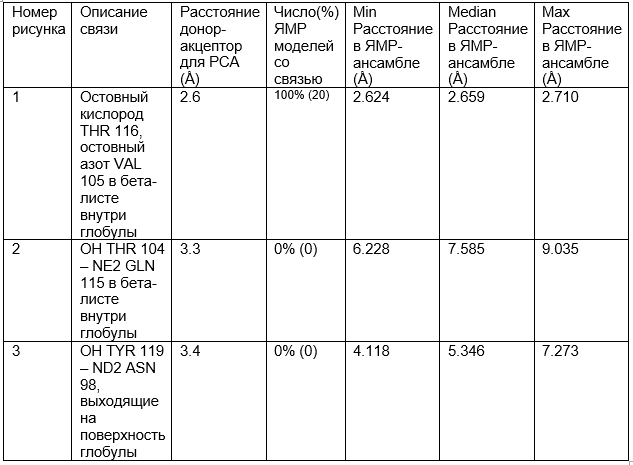
Таблица 1. Характеристика водородных связей