Описание TAT-сигнала
В данном практикуме исследовался сигнал TAT. Этот сигнал характерен для белков, которые должны транспортироваться через мембрану бактериальной клетки (или клетки археи). Так же присутствует в белках, синтезируемых в эукариотических органеллах. Данный сигнал состоит из консенсусной последовательности 15-30 аминокислот. Структура домена содержит 3 ключевые области:
N-домен - заряженная часть, часто содержит положительно заряженные аминокислоты, вроде лизина или аргинина.
H-домен - гидрофобный, богат гидрофобными аминокислотами, помогает взаимодействовать с мембраной.
C-домен содержит сайт расщепления, где сигнал отрезается после транспортировки
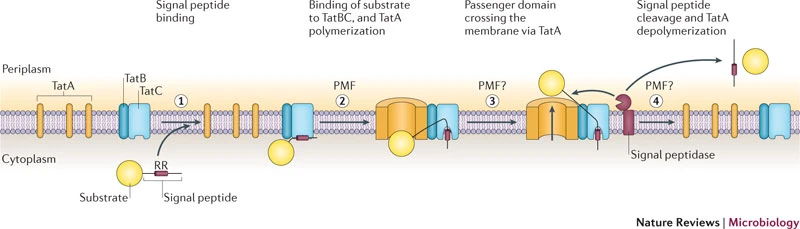
Отличительная особенность этого сигнала в том, что белок транспортируется через мембрану уже в свернутом или почти свернутом виде при помощи системы Twin-Arginine Translocation (рис 1). Распознавание сигнала происходит при помощи белков TatC или TatB. Комплекс собирается после присоединения TatA к TatBC, формируется временный канал. Белок протаскивается через мембрану за энергии из протонного градиента. После транспортировки сигнал отрезается пептидазой, белок попал в нужное место и готов к работе.
Описание программы для поиска сигнала SignalP-5.0
Для поиска сигнала использовалась программа SignalP-5.0 [2]. В качестве входных данных требуются последовательности белков организма в fasta формате. При тестировании программы использовался весь протеом (2421 белок) археи Halobacterium salinarum. Данные подаются либо в окно ввода последовательностей, либо в виде файла. Программа может выполнять поиск сигнала как в прокариотах, так и в эукаритоах. При запуске необходимо указать принадлежность исследуемого организма. Максимальное количество последовательнстей - 5000, максимальная длина последовательности - 10000 аа. Используемая версия программы выполняет поиск 3х вариантов сигналов: Sec/SPI, Sec/SPII,Tat/SPI. Результат предсказания визуализируется (рис 2), вычисляются вероятности данного мотива. Результаты работы можно сохранить в формате tsv (файл содержит id последовательности и вероятности наличия в последовательности искомых сайтов).
Предсказание для археи
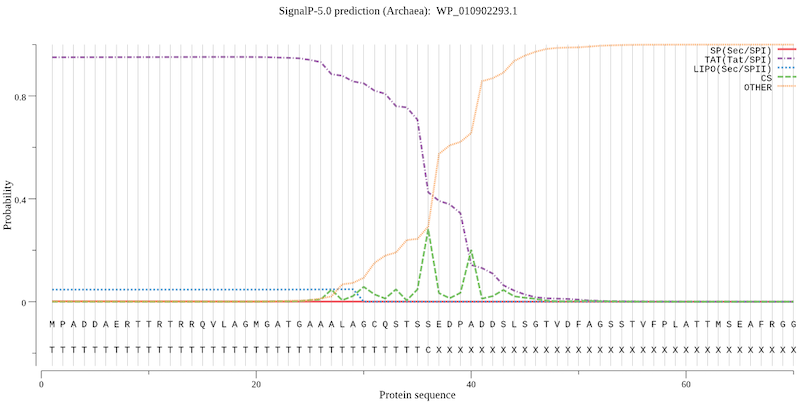
Из 2421 белка в 70 был найден искомый сигнал. На рис 2 показан резульат предсказания. Рассмастривались первые 60 аминокислот в последовательнсти. Найденный участок сигнала имеет длину около 30 аминокислот. Начала сигнала - заряженные аргинины, затем идут гидрофобные аминокислоты для взаимодействовия с мембраной. Найденный сигнал согласуется с его теоретическим описанием. Найденная программа способна довольно точно предсказывать некоторые из возможных белковых сигналов.
На рисунке 2 представлено предсказание сигнала для белка WP_010902293.1. Из геномной аннотации известно, что описание данного белка "PstS family phosphate ABC transporter substrat". По описанию данного семейства известно, что у грамм-отрицательных бактерий данный белок находится в периплазме (значит транспортируется через мембрану). Для архей этот белок существует в форме липопротеина со стороны периплазмы, что тоже говорит о необходимости его транспорта через мембрану. Эта информация отлично согласуется с тем, что в данном белке был найден TAT сигнал.
Список литературы
[1] Palmer, T., & Berks, B. C. (2012). The twin-arginine translocation (Tat) protein export pathway. Nature Reviews Microbiology, 10(7), 483–496, DOI: 10.1038/nrmicro2814
[2] Almagro Armenteros, J.J., Tsirigos, K.D., Sønderby, C.K. et al. SignalP 5.0 improves signal peptide predictions using deep neural networks. Nat Biotechnol 37, 420–423 (2019), DOI: 10.1038/s41587-019-0036-z
[3] Berks, B. C. (2015). The twin-arginine protein translocation pathway. Annual Review of Biochemistry, 84, 843–864, DOI: 10.1146/annurev-biochem-060614-034211