Введение
Лектины – белки, не обладающие ферментативной активностью, которые
высокоспецифично связывают углеводы, растворенные или в составе гликопротеинов или гликолипидов [1].
Лектины встречаются повсеместно в живом мире, и многообразие их функций чрезвычайно велико. Так, например, у животных
они участвуют в регуляции клеточной адгезии, синтеза гликопротеинов и уровня белков крови [2]. Кроме того, лектины
играют важную роль во врожденном иммунитете и, вероятно, в механизмах проникновения вирусов в клетки хозяина [3].
Первоначально лектины были открыты у растений. Функции их в растительном организме не до конца ясны. Высокое содержание
лектинов в семенах говорит об их вероятном участии в механизмах прорастания. Кроме того, некоторые растительные лектины
связывают фитогормоны, такие как ауксины и цитокинины [4]. Многие растительные лектины, например, рицин, являются токсинами.
Благодаря своей высокой селективности, лектины получили широкое использование в анализе крови, в частности, в установлении
типа крови по системе AB0 [5].
Выбранный нами лектин был выделен из семян Vatairea macrocarpa – растения из семейства Бобовые. Лектины бобовых – одно из
наиболее крупных и изученных семейств лектинов. Некоторые из них связывают N-ацетилгалактозамины (GalNAc). Это позволяет
использовать их в раковой диагностике, так как клетки злокачественных опухолей часто имеют повышенный уровень
GalNAc-содержащих эпитопов на своей поверхности. Так, например, Tn-антиген, являющийся лигандом исследованного
нами лектина, не обнаруживается на поверхности здоровых клеток, но выносится на поверхность клетками 90% раковых
опухолей.[6]
Таким образом, Tn-антиген и его производные – чрезвычайно важные биомаркеры, и их изучение необходимо
для совершенствования методов диагностики и лечения раковых заболеваний [7]. С другой стороны, токсичность
многих из них может оказаться проблемой. Так, например, лектин из Vatairea guianensis способен индуцировать
развитие эдем – опуханий, вызванных избыточным накоплением воды в тканях [8].
Описание молекулы
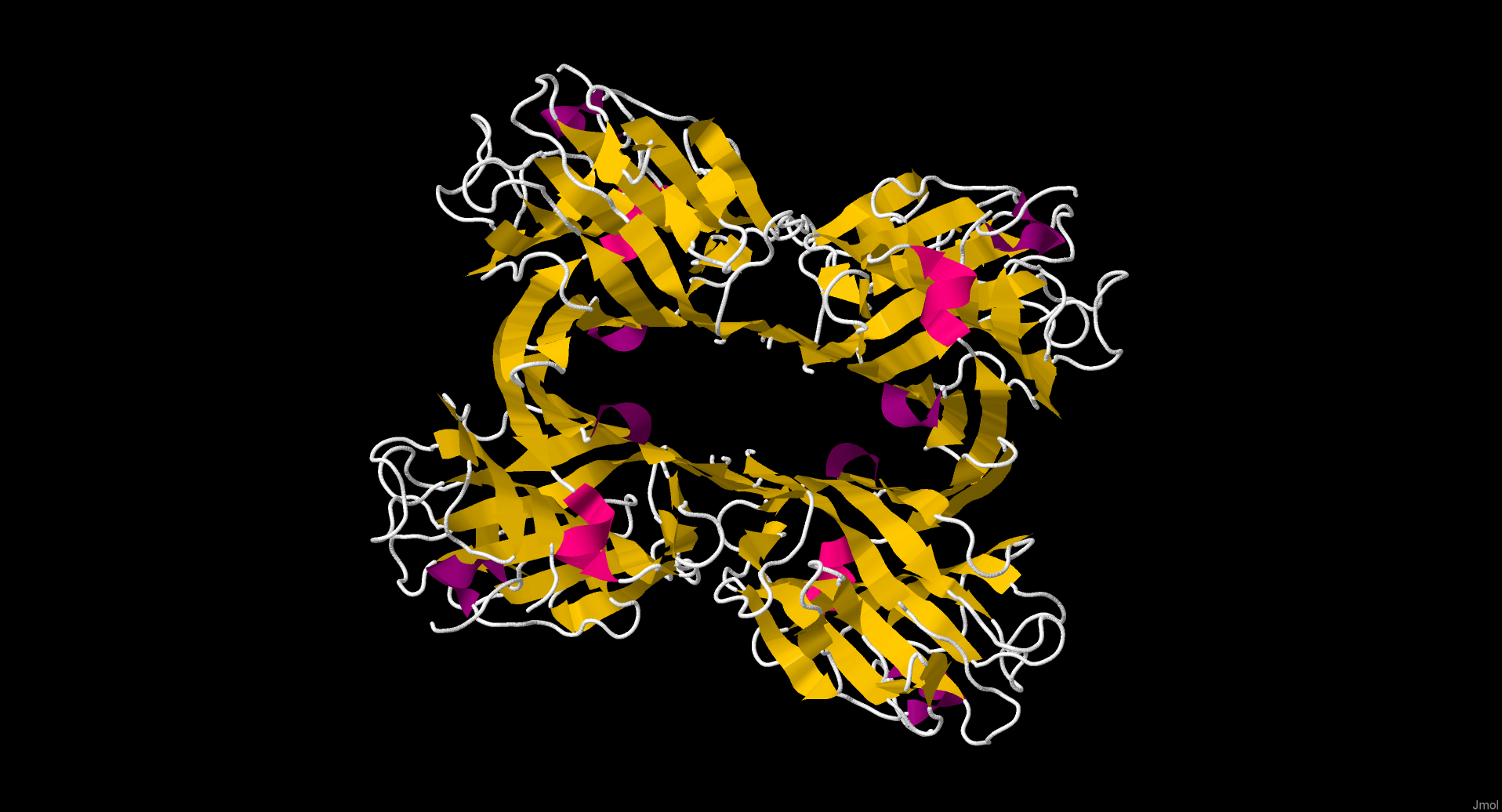
Итак, перейдем непосредственно к нашему белку, PDB ID: 4U36. Разрешение: 1.4 Å, то есть атомы водорода не отображены, но это не мешает изучению структуры.
Белок обладает четвертичной структурой, состоящей из четырех идентичных
асимметричных субъединиц, каждая из которых состоит из 240 аминокислот. Основные элементы вторичной структуры – бета-тяжи,
связанные петлями различной длины (одна из них формирует короткую альфа-спираль). Центральная полость между субъединицами
гидрофильна, что показывают покрывающие внутреннюю поверхность комплекса молекулы воды. Это типичная для лектинов бобовых
структура.
Любопытно, что внутри субъединицы имеется длинное «гидрофобное ядро» между бета-тяжами (по 6 с каждой стороны), куда
направлены гидрофобные остатки. Всего это ядро содержит 62 атома. Очевидно, это ядро необходимо для правильного
фолдинга белка.
Описание лигандов
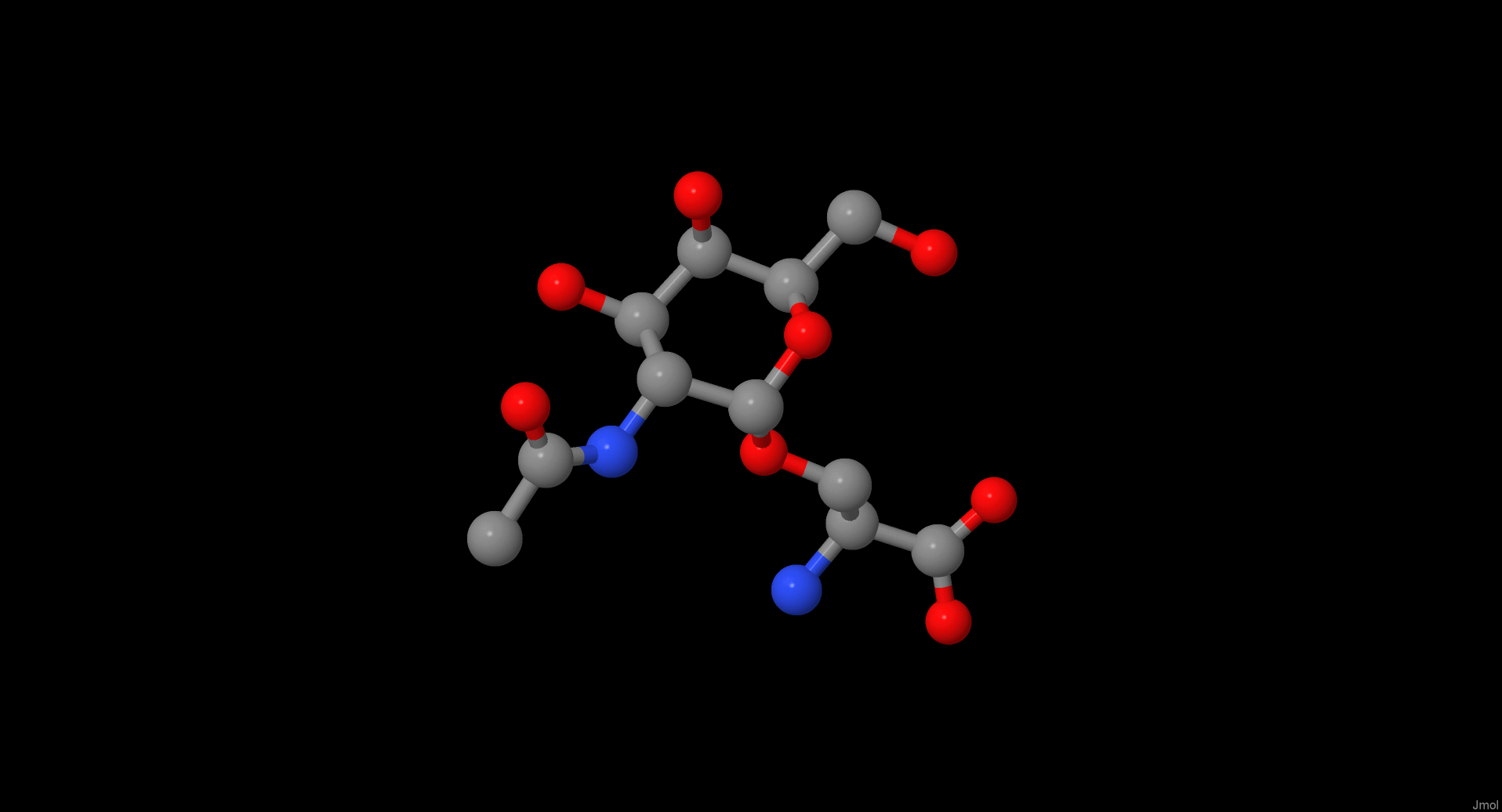
| Tn-антиген Название по IUPAC: (2S)-3-[(2S,3R,4R,5R,6R)-3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-2-aminopropanoic acid. Формула SMILES: CC(=O)NC1C(C(C(OC1OCC(C(=O)O)N)CO)O)O. Брутто-формула: C11H20N2O8. Молярная масса: 308.287 г/моль. Ссылка на Pubchem |
 |
|---|---|
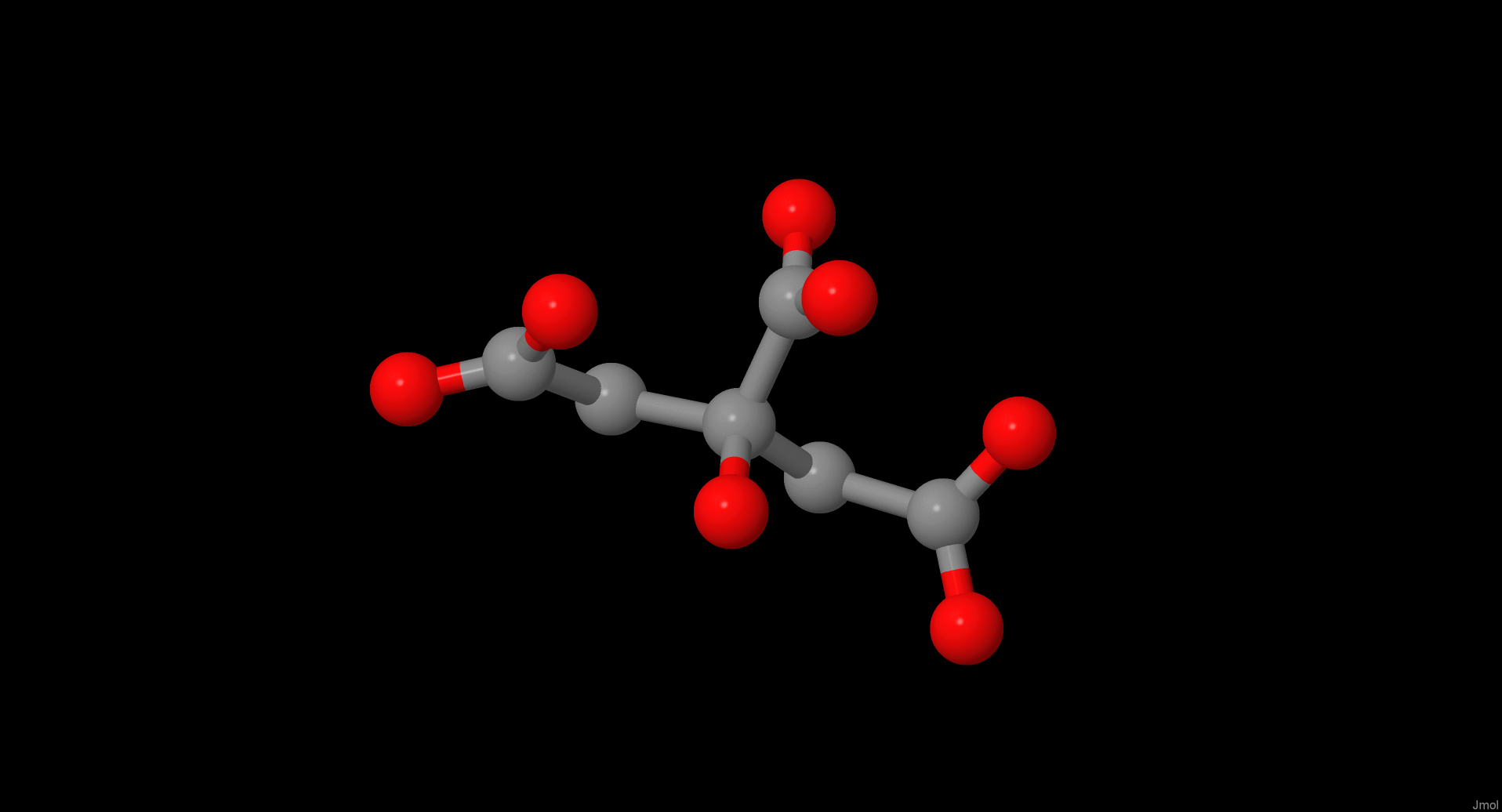
| Лимонная кислота Название по IUPAC: 2-hydroxypropane-1,2,3-tricarboxylic acid. Формула SMILES: C(C(=O)O)C(CC(=O)O)(C(=O)O)O. Брутто-формула: C6H8O7. Молярная масса: 192.123 г/моль. Ссылка на Pubchem |
 |
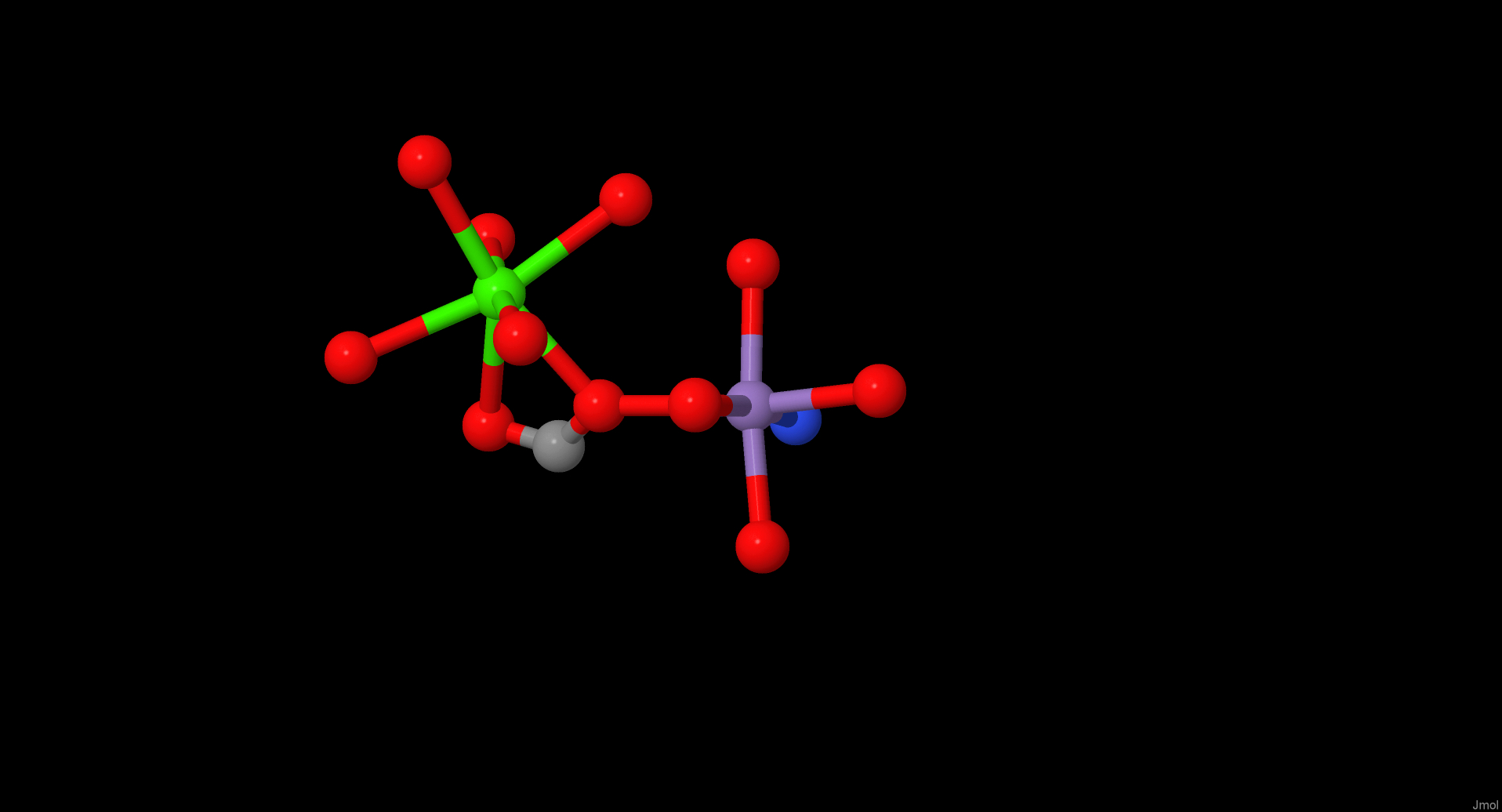
| Ионы марганца (II) и кальция (II) Ссылка на Pubchem Ссылка на Pubchem |
 |
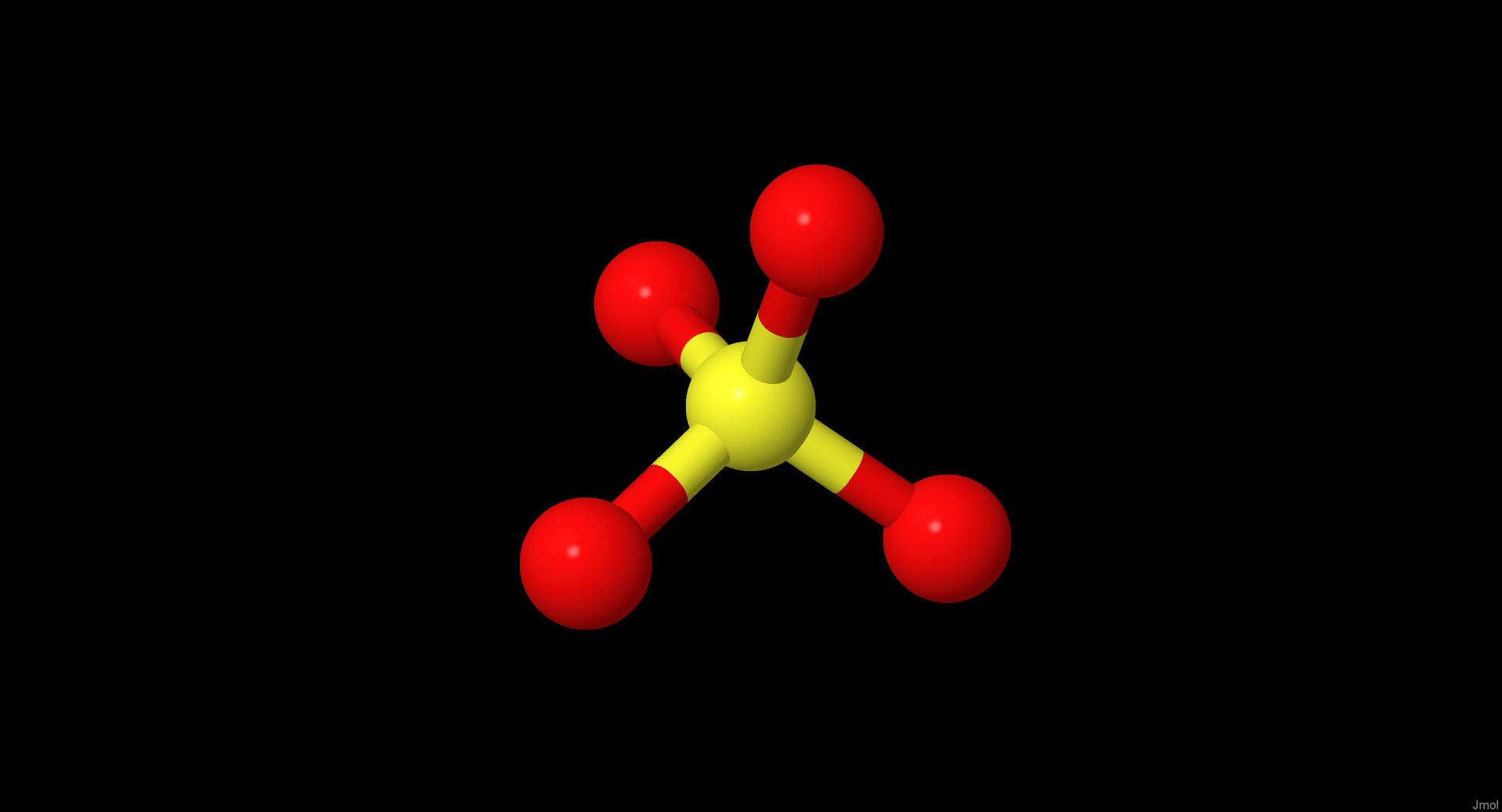
| Сульфат-ионы Ссылка на Pubchem |
 |
Белок-белковые взаимодействия
Солевые мостики
Солевые мостики возникают в результате электростатических взаимодействий
между отрицательно заряженными радикалами глутаминовой и аспарагиновой кислот и положительно заряженными радикалами лизина,
аргинина или гистидина.
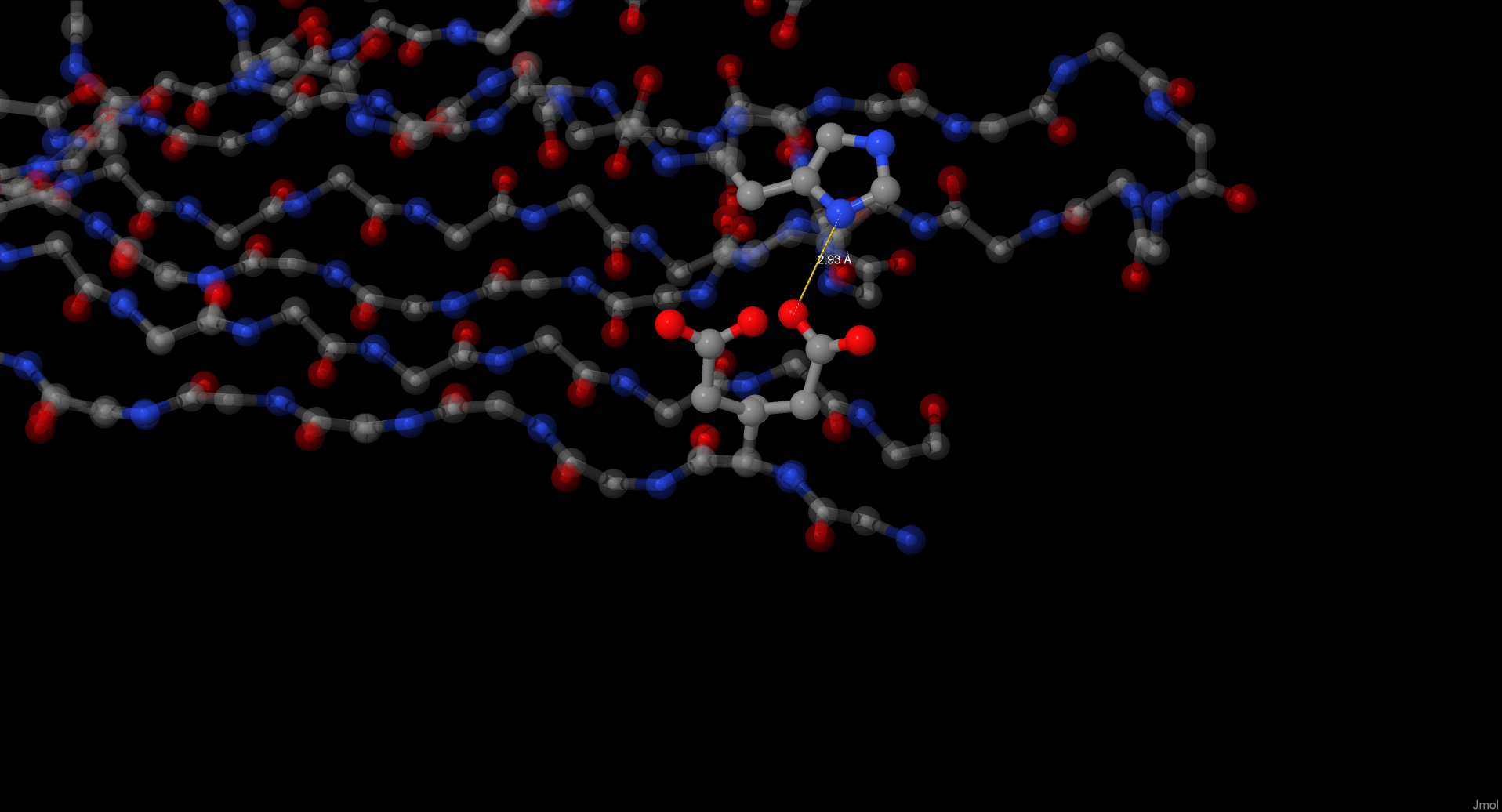
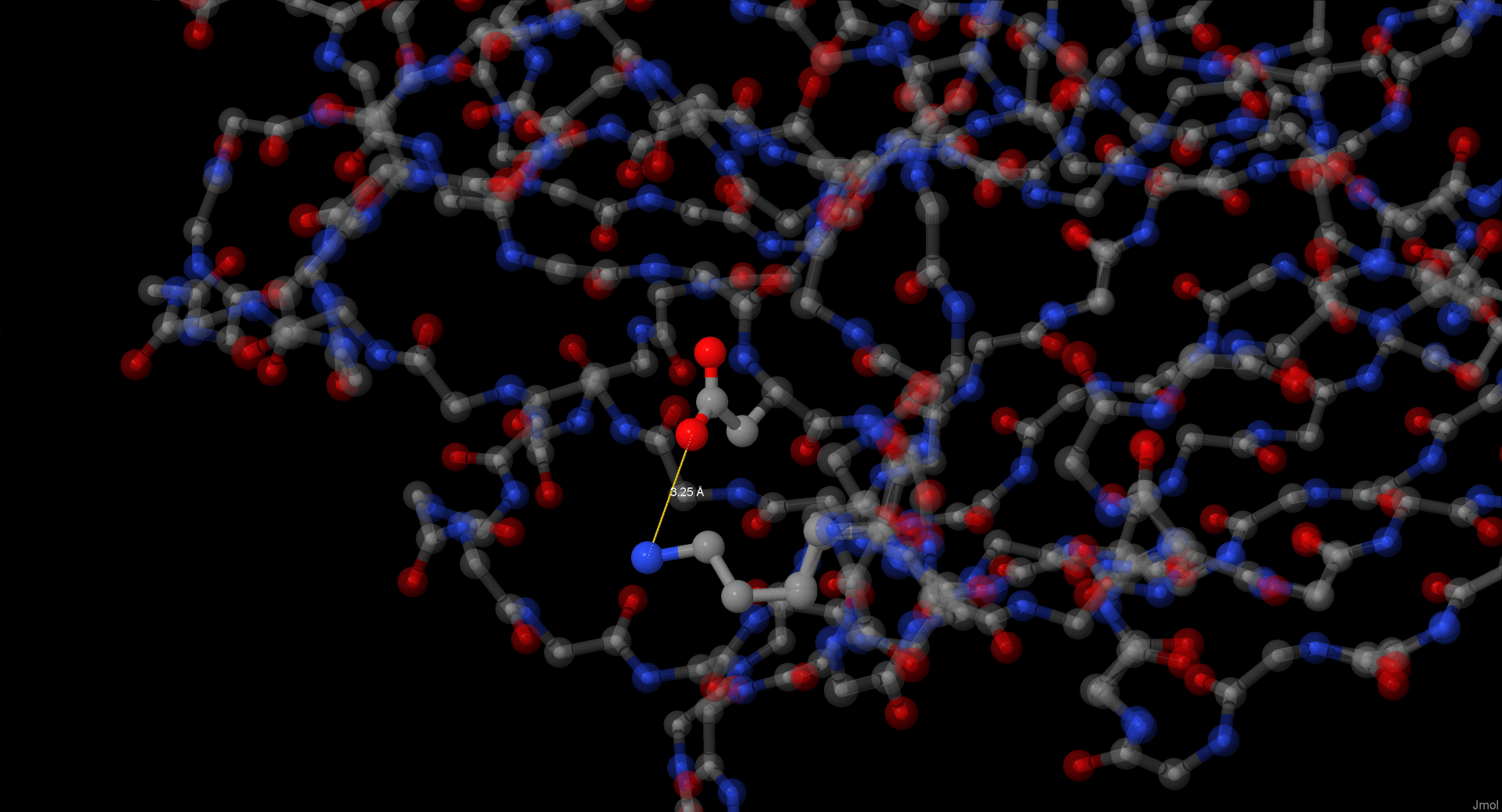
Для обнаружения солевых мостиков были окрашены положительно заряженные атомы азота и отрицательно – кислорода, при то
м интенсивность окраски зависела от расстояния между ними. Таким образом были обнаружены 2 пары атомов на расстоянии
мешьше 3,5А.
Солевой мостик между Glu2 и His57, возможно, удерживает начало аминокислотной цепи на своем месте и не дает ей разворачиваться. Мостик между Asp222 и Lys31, вероятно, просто помогает белку свернуться необходимым образом.
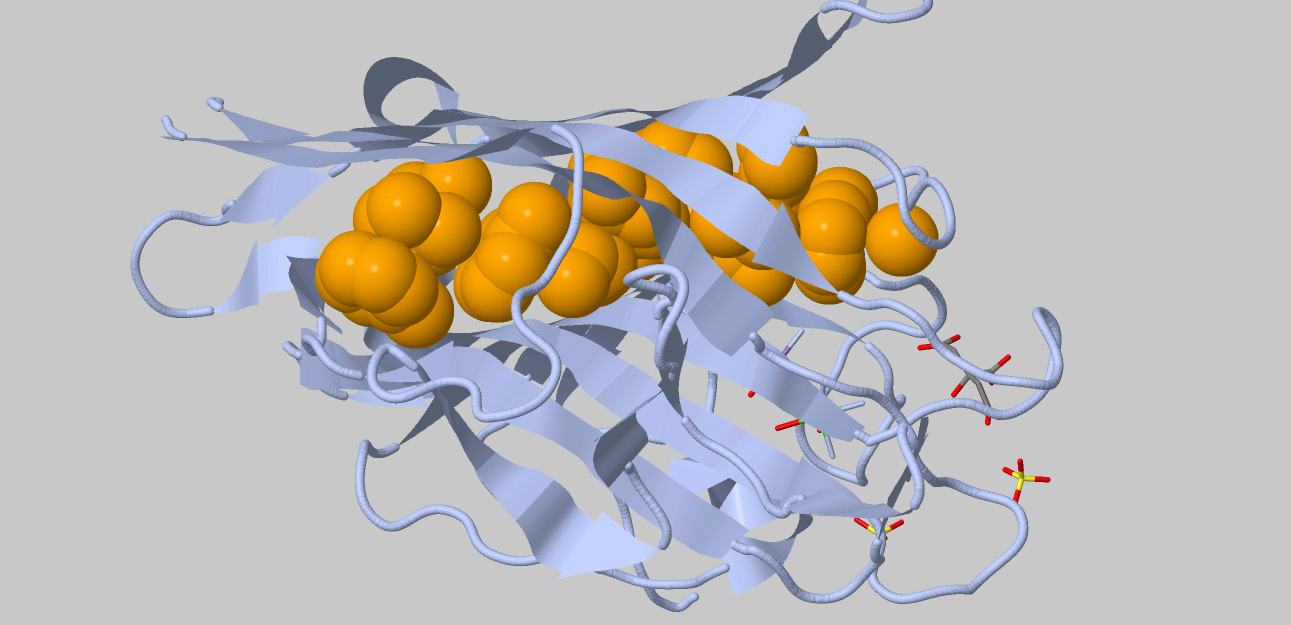
Гидрофобное ядро
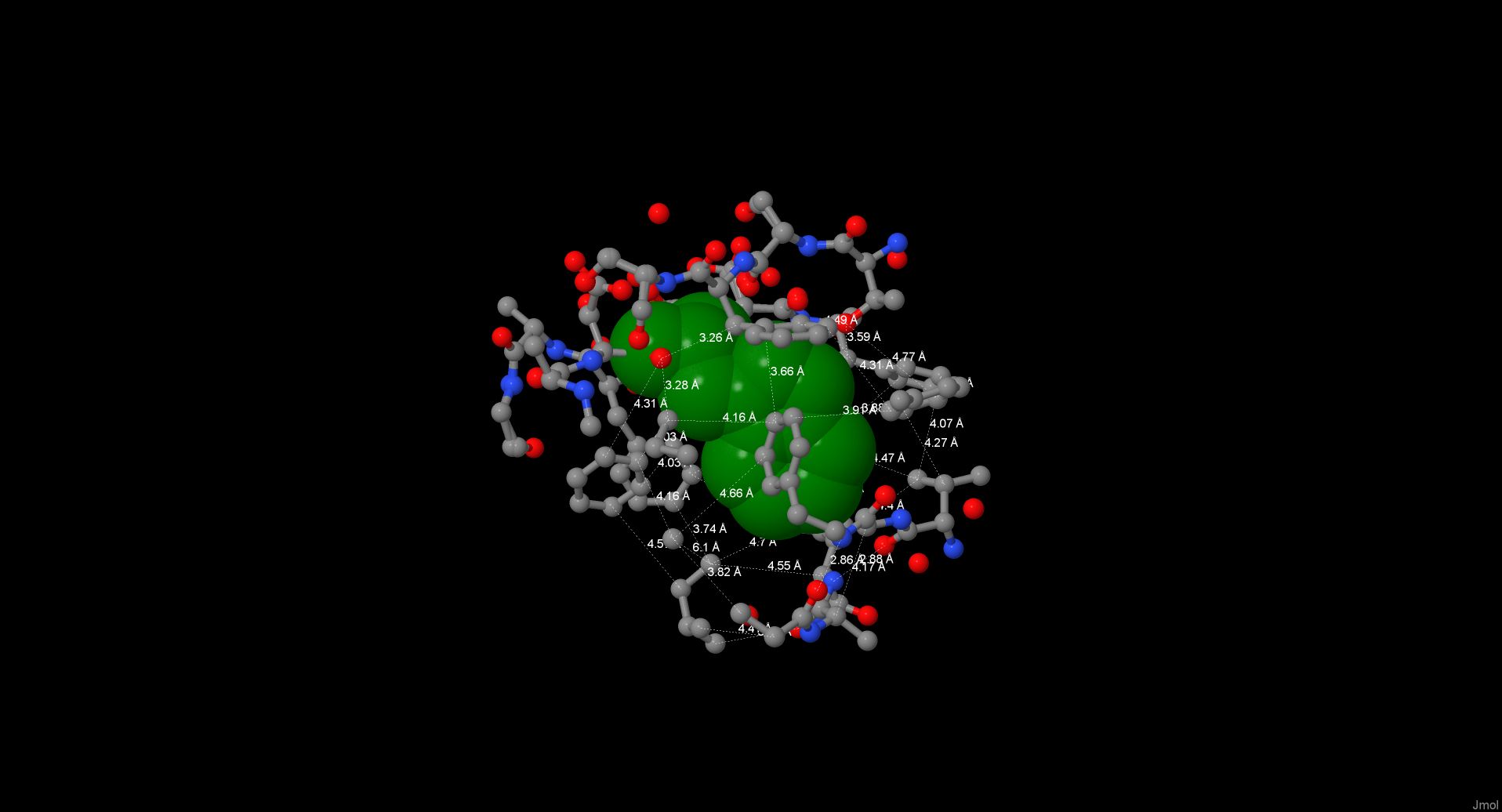
В качестве остатка MyResidue был взят остаток Trp226. Атомы в окружении 7
ангстрем почти полностью его закрывают. Для вычисления расстояний между соседними атомами гидрофобного ядра, не соединенными
ковалентными связями, было проведено 36 измерений, среднее расстояние между центрами составило 4,07 А, между границами
Ван-дер-Ваальсовых радиусов – 0,54А. Атом кислорода с радиусом 1,4 А не помещается между двумя соседними атомами.
Белок-лиганд
Водородные связи с Tn-антигеном
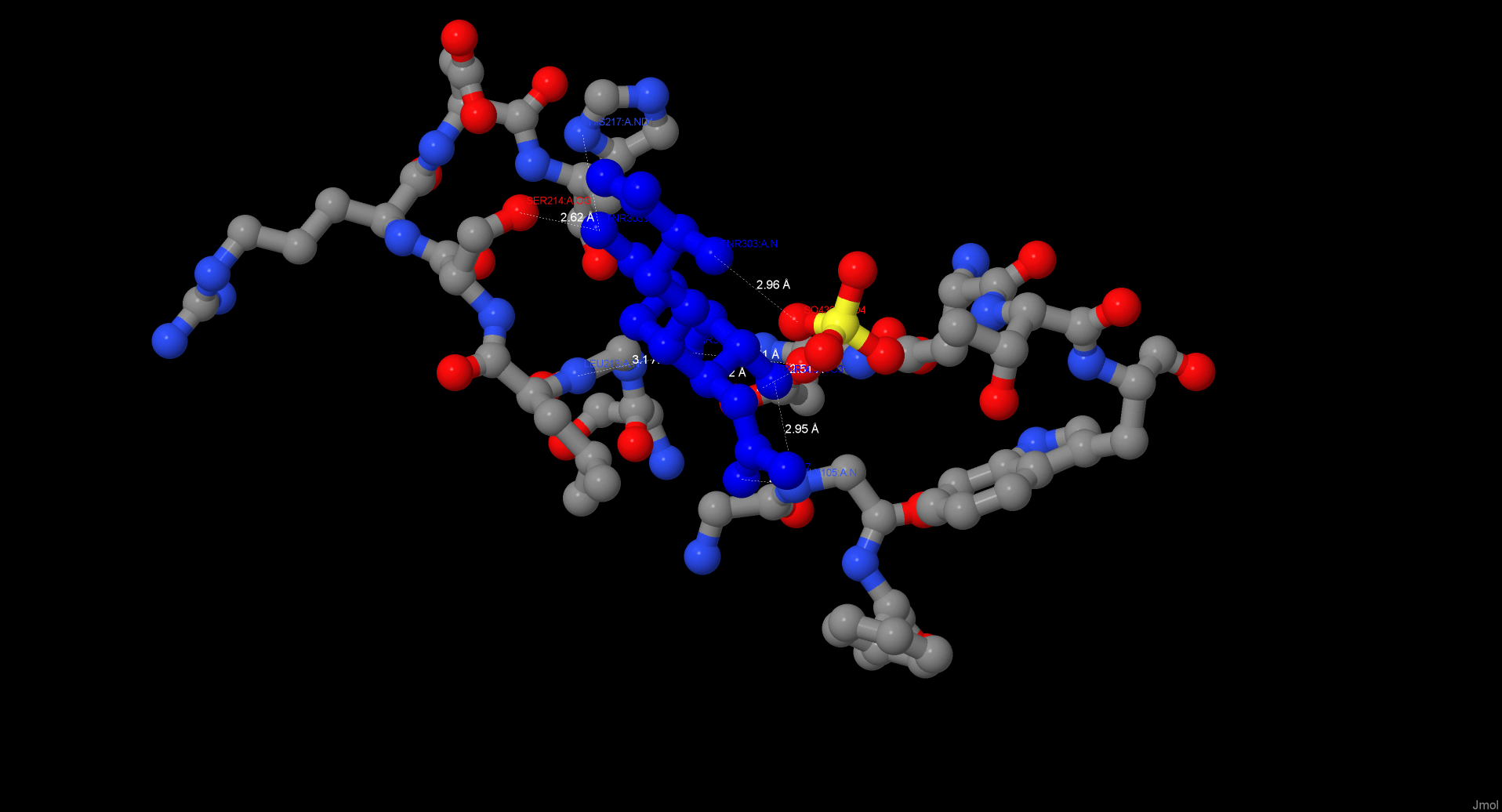
Tn-антиген связан с белком водородными связями через остатки Gly105 (N),
Asn129 (ND2), Asp87 (OD1 и OD2), Leu213 (N) и Ser214 (OG). Длины всех связей не превышают 3.1 Å. Кроме того, с антигеном
связаны, вероятно, 3 молекулы воды и один ион SO4(2-). Как было сказано выше, в отсутствие сульфат-ионов их место, скорее
всего, занимают молекулы воды. Сульфат-ион, в свою очередь, связан также водородными связями с Thr130 и Asn129.
Водородные связи с лимонной кислотой
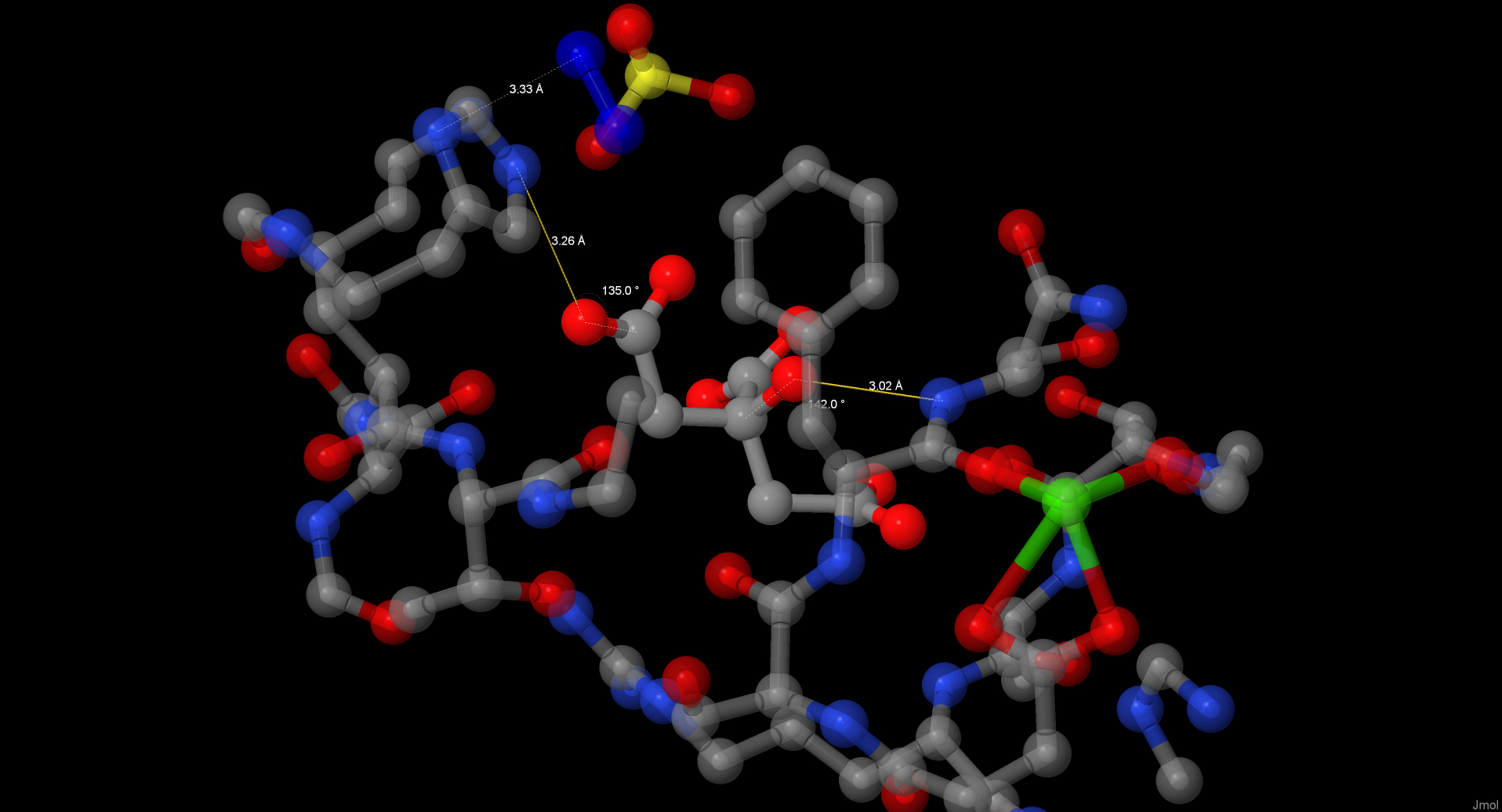
Лимонная кислота, вероятно, присутствует в структуре из-за того, что кристаллы помещали в цитратный буфер. Она образует 2 водородные связи с атомами белка: одну с His217 и вторую с Ser128.
Электростатические связи с лигандами
Для обнаружения подобных взаимодействий были выявлены атомы азота белка, способные образовывать водородные или солевые взаимодействия с сульфат-ионами. Было выяснено, что два иона расположены на расстоянии менее 3 ангстрем от гуанидильной группы аргинина, ещё один сульфат находится на расстоянии 2.82А от гистидина. Очевидно, они участвуют с солевых взаимодействиях и/или водородных связях Эти сульфаты, как указано выше, вероятно попали в белок в процессе приготовления его к спектроскопии, и не несут функционального значения.
Связи с ионами металлов
Ион Mn2+ связан с карбоксильными группами Asp132, Glu123 и Asp125, а также с имидазольной группой His137. Ион Ca2+ связан с радикалами Asp125, Asn129 и Asp132, а также с карбонильной группой Phe127 основной цепи. Оба иона также связаны с двумя молекулами воды.
Скачать скрипт:
- Соляные мостики
- Гидрофобное ядро
- tn-антиген
- Лимонная кислота
- Электростатические связи с лигандами
- Ионы металлов
Вклад авторов
Бобровский Даниил изучал литературу, описывал белок, а также описывал связи с ионами металлов и с tn-антигеном.
Скрипка Дмитрий исследовал солевые мостики, взаимодествия с ионами металлов, с tn-антигеном, электростатические взаимодействия с лигандами, также он написал соответствующие скрипты, описал электростатические взаимодействия с лигандами.
Дрождев Алексей исследовал гидрофобные взаимодействия, взаимодействия с лимонной кислотой и написал соответствующие скрипты. Описал соляные мостики, гидрофобные взаимодействия, взаимодействия с лимонной кислотой. Также выполнил верстку страницы и подобрал изображения.
Источники
- 1. Sharon N, Lis H. How proteins bind carbohydrates: lessons from legume lectins. J Agric Food Chem 2002;50:6586–91.
- 2. URS Rutishauser and Leo Sachs (May 1, 1975). "Cell-to-Cell Binding Induced by Different Lectins". Journal of Cell Biology. 65 (2): 247–257. doi:10.1083/jcb.65.2.247. PMC 2109424. PMID 805150
- 3. Maverakis E, Kim K, Shimoda M, Gershwin M, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (2015). "Glycans in the immune system and The Altered Glycan Theory of Autoimmunity". J Autoimmun. 57 (6): 1–13. doi:10.1016/j.jaut.2014.12.002. PMC 4340844. PMID 25578468
- 4. Komath SS, Kavitha M, Swamy MJ (March 2006). "Beyond carbohydrate binding: new directions in plant lectin research". Org. Biomol. Chem. 4 (6): 973–88. doi:10.1039/b515446d. PMID 16525538.
- 5. Sharon, N.; Lis, H (2004). "History of lectins: From hemagglutinins to biological recognition molecules". Glycobiology. 14 (11): 53R–62R. doi:10.1093/glycob/cwh122. PMID 15229195.
- 6. Sousa, B. L., Silva Filho, J. C., Kumar, P., Pereira, R. I., Łyskowski, A., Rocha, B. A. M., … Cavada, B. S. (2015). High-resolution structure of a new Tn antigen-binding lectin from Vatairea macrocarpa and a comparative analysis of Tn-binding legume lectins. The International Journal of Biochemistry & Cell Biology, 59, 103–110. doi:10.1016/j.biocel.2014.12.002
- 7. Poiroux, G., Barre, A., van Damme, E., Benoist, H., & Rougé, P. (2017). Plant Lectins Targeting O-Glycans at the Cell Surface as Tools for Cancer Diagnosis, Prognosis and Therapy. International Journal of Molecular Sciences, 18(6), 1232. doi:10.3390/ijms18061232
- 8. Marques, G. F. O., Osterne, V. J. S., Almeida, L. M., Oliveira, M. V., Brizeno, L. A. C., Pinto-Junior, V. R., … Assreuy, A. M. S. (2017). Contribution of the carbohydrate-binding ability of Vatairea guianensis lectin to induce edematogenic activity. Biochimie, 140, 58–65. doi:10.1016/j.biochi.2017.06.008