Учебный сайт Дюгая Ильи
Остовные водородные связи
α-спираль
Самым простым способом организации полипептидной цепи с ее жесткой пептидной связью и остальными связями,
способными к вращению, является спиральная структура - α-спираль. В этой структуре полипептидный остов
образует плотные витки вокруг длинной оси молекулы, тогда как R-группы аминокислотных остатков выступают из
спирального остова наружу. Во всех белках α-спираль закручена вправо. Около четверти всех аминокислотных
остатков в полипептидных цепях входят в состав α-спиралей (в разных белках это значение несколько
различается). Самая длинная и единственная α-спираль в белке Superoxide reductase выделена на рис.1.
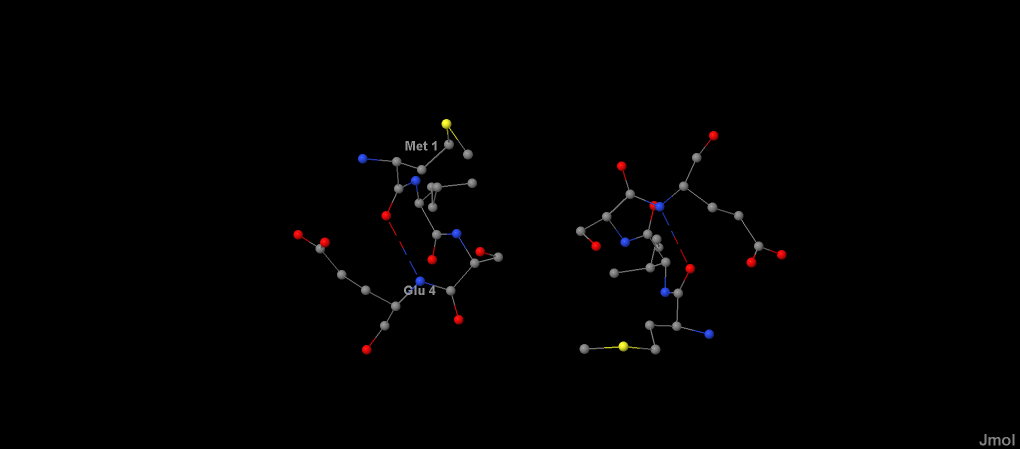
Рис.1 Самая длинная α-спираль в белке superoxide reductase
α-спираль из белка 2СХ1
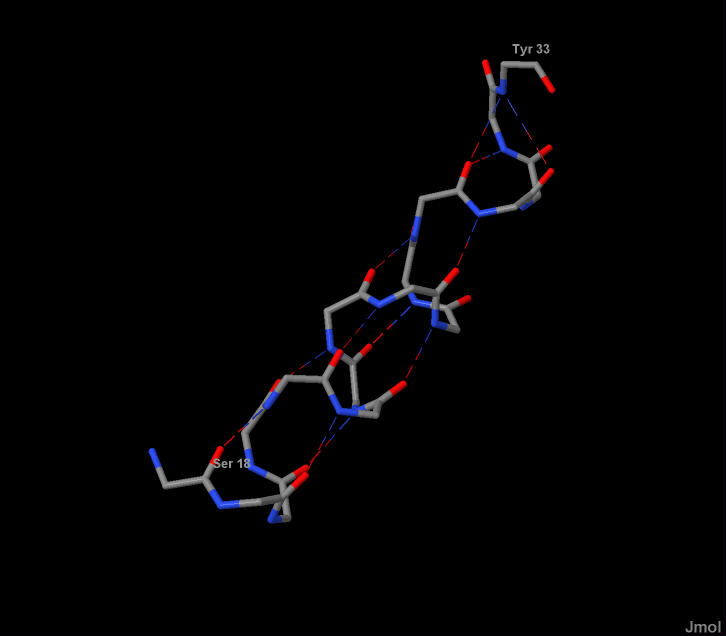
Рисю1.1 α-спираль из белка 2СХ1
Почему α-спираль образуется чаще других возможных структкр? До некоторой степени это объясняется тем, что в α-спирали оптимальным образом используются водородные связи внутри молекулы. Данная структура стабилизируется водородными связями между аминогруппой одной аминокислоты, и карбонильной группой другой аминокислоты . В образовании подобных водородных связей участвует каждая пептидная группа α-спирали (за исключением концевых групп).
β-лист
Второй тип регулярной организации пептидов - β-структура, при которой цепи находятся в более вытянутой
конформации. В данном случае остов полипептидной цепи образует не спиральную, а зигзагообразную структуру.
Зигзагообразные полипептидные цепи могут быть уложены параллельно, образуя ряд складок. В данных структурах,
называемых β-листами, водородные связи возникают между соседними участками полипептидной цепи. Обычно в
образовании β-листов участвуют фрагменты, расположенные в полипептидной цепи поблизости друг от друга,
но иногда это могут быть сравнительно удаленные участки последовательности и даже участки разных полипептидных
цепей. R-группы аминокислот выступают по обе стороны зигзагообразной структкры. Самый крупный β-лист в
белке Superoxide reductase состоит из 5 тяжей. Его наглядное изображение приведено на рис.2.
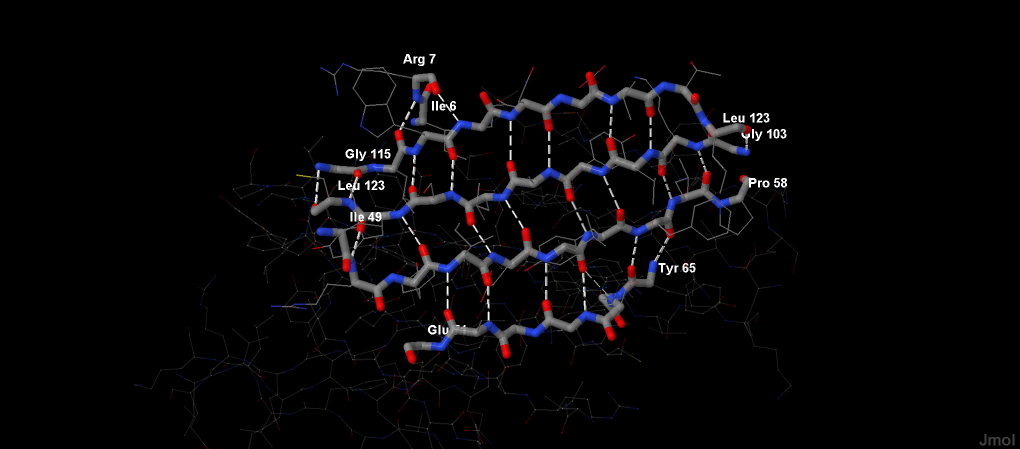
Рис.2 Самый крупный β-лист в белке Superoxide reductase
Прилегающие друг к другу в β-листах полипептидные цепи могут быть как параллельными, так и антипараллельными (т. е. иметь одну и ту же или разную C-N-ориентацию). Возникающие при этом структуры довольно похожи, но несколько различаются по размерам повторяющегося звена, и водородные связи в них организованы по-разному.
Дата последнего обновления: 01.05.2014
Copyright © Дюгай Илья, 2013.