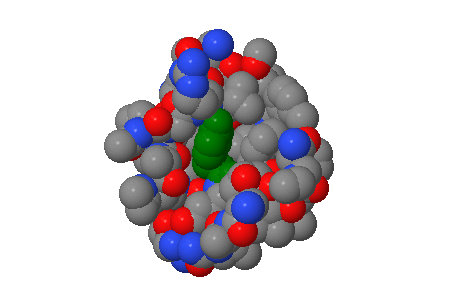
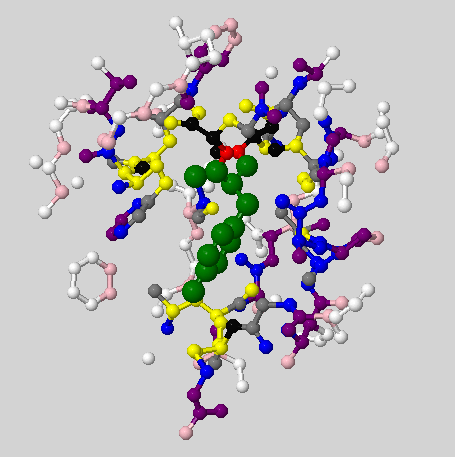
| Также можно примерно прикинуть характерное расстояние между соседними не связанными ковалентно атомами в белке, посмотрев сколько атомомов находятся от данного остатка на определенном расстоянии. На рис. 5 зеленым покрашен сам остаток, красным - атомы, находящиеся на расстоянии не менее 1 ангстрема и не более 2 ангстрем, черным - от 2 до 3 ангстрем, желтым - 3-4 ангстрем, серым - 4-5 ангстрем, синим - 5-6 ангстрем, фиолетовым - 6-7 ансгстрем, розовым - 7-8 ангстрем, белым - 8-9 ангстрем. Также видно, что на расстоянии не более 2 ангстрем только 2 атома, но они ковалентно связаны с остатком (то есть нам не подходят). Так что мы будем рассматривать расстояние от 2 ангстрем.
Из этой картинки можно извлесь следующую информацию:
| Расстояние от атома до остатка | Сколько атомов |
| 2-3 ангстрема | 8 |
| 3-4 ангстрема | 27 |
| 4-5 ангстрема | 22 |
| 5-6 ангстрема | 34 |
| 6-7 ангстрема | 36 |
| 7-8 ангстрема | 30 |
Видно, что почти все атомы уже на расстоянии 6 ангстрем от остатка уже не соседствуют с ним, как и большинство атомов на расстоянии не менеее 5 ангстрем - между ними есть другие атомы (это видно и в апплете) - поэтому имеет смысл рассматривать расстояние до 5 ангстрем. Видно, что больше всего атомов лежат на расстоянии 3-4 ангстрема. Что и можно назвать характерным расстоянием.
Понятно, что этот вывод носит сугубо приблизительный характер, а более серьезные выводы требуют большей выборки и более точных методов).
Что означает это расстояние? Может ли, например, поместиться между соседними не связанными ковалентно атомами поместиться вода? Для ответа на этот вопрос воспользуемся приближением, в котором размер молекулы воды равен размеру атома кислорода. Используя следующие значения ван-дер-ваальсовых радиусов: углерод - 1.85 ангстрема, азот - 1.54 ангстрема, кислород - 1.4 ангстрема (Дж. Эмсли. Элементы. 1993г.), несложно посчитать, что минимальное расстояние между атомами такое, что между ними помещается вода - 5,6 ангстрема (сумма радиусов воды*2 и обоих атомов:1,4+1,4*2+1,4), однако в этом случае оба атома должны быть кислородом. Гораздо проще найти случаи, в которых хотя бы один из атомов - углерод (в таком случае минимальное расстояние - 6,05 ангстрема). А как говорилось выше, почти все атомы на расстоянии не менее 6 ангстрем уже не являются соседними к остатку. Так что вода там не поместится.
|  |
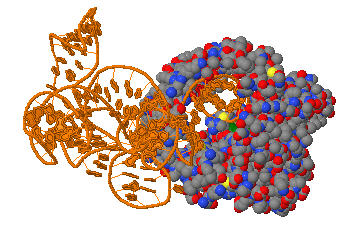
| III. Комплекс с ДНК. Следующий рассматриваемый белок - ДНК-полимераза эта (Pol η, PDB ID: 5KFP)- человеческая полимераза, участвующая в репарации ДНК [1]. Белок состоит из одной цепи, которая связан с ДНК, одна из цепей которой состоит из 11 нуклеотидов, а другая - из 9 (возможно, 2 "лишних" нуклеотида на 5' конце одной из цепей помогают ДНК связываться с белком).
В целом, белки, связанные с ДНК, могут выполнять самы разные функции: синтез новой ДНК/РНК по матрице старой (причем как в ходе репликации и транскрипции, так и в процессе репарации), компактизация ДНК (например, гистоны), регуляция степени активности ДНК (участия данного куска, например, в транскрипции), стабилизация одноцепочечных кусков (например, SSB-белки), спецефичное узнавание других последовательностей (хотя тут чаще с РНК) и другие.
IV. ДНК в комплексе с белком. При нажатии кнопки "DNA complex", появится изображение ДНК, с которой связан белок, в котором розовым покрашена малая бороздка, а фиолетовым - большая. Далее следует то же изображение с добавленным белком в виде проволочной модели. Затем следует изображение водородных связей (выделены черным цветом) между сахаро-фосфатным остовом ДНК и атомов белка, находящихся на расстоянии не более 5 ангстрем от ДНК. На следующем изображении показаны гидрофобные кластеры (синие, желтые, красные, черные и фиолетовые атомы). По крайней мере зрительно создается ощущение, что водородные связи принимают большее участия в связывании молекула ДНК с белком, нежели гидрофобные взаимодействия (синее гидрофобное ядро содержит как атомы ДНК, так и атомы белка, фиолетовое содержит только 2 атомы белка, другие же не содержат атомов ДНК). Также можно заметить, что предположение о том, что непарные нуклеотиды помогают связать две молекулы подтвердилось: один из них входит в синее гидрофобное ядро (впрочем, как и многие другие), а второй - аденин - находится непосредственно над радикалом триптофана (также состоящего из пятичленного и шестичленного ароматических колец), что способствует стекинг-взаимодействию. Если покрасить синее и фиолетовое гидрофобные ядра по элементам (следующее изображение), хорошо видно, что в этих ядрах есть только атомы углерода - то есть образующая их часть ДНК - углероды дезоксирибозы. Получается, что сахаро-фосфатный остов - главное место крепления ДНК к белку, принимающее участие как в образовании гидрофобных ядер, так и водородных связей.
V. Механизм реакции На видео приведена визуализация реакции, в которой остаток тирозина перенимает фосфат (соединенный простыми эфирными связями с двумя EtOH) от нитрофенолфосфата - то есть это реакция фосфорилирования. Механизм реакции - SN2 - нуклеофильное замещение по второму типу (образуется промежуточное соединение, в котором есть и уходящая группа, и атакующий нуклеофил).
|