



 |  |  |  |
Алгоритмы множественного выравнивания.Pfam |
Вернуться на страницу семестра Pазличия во множественных выравниваниях, построенных разными программамиВ практикуме 12 при помощи программы BLAST и последующего множественного выравнивания были найдены 3 белка, гомологичных дигуанилатциклазе AMD46139.1 из генома бактерии Bordetella holmesii H558. В данной работе мы сравним множественные выравнивания, построенные тремя разными программами: Tcoffee, Muscle, Mafft для 4 гомологичных белков: AMD46139.1 и трёх, найденных раньше. найденных в предыдущей работе. Рисунок 1. Выравнивание Tcoffee Рисунок 2. Выравнивание Muscle Рисунок 3. Выравнивание Mafft Таблица 1. Параметры выравниваний разными программами
Рисунок 4. Объединённые выравнивания (для удобства сравнения) в порядке: Tcoffee, Muscle, Mafft На рисунке 4 приведены объединённые выравнивания по 3 программам. Блоки, ограниченные чёрной окантовкой, с бледным тексом - полностью совпадающие участки выравниваний разными программами. Со 122 позиции начинаются различия: выравнивания Tcoffee и Muscle отличаются только положением колонки с гэпами, но программа Mafft вставляет довольно большой индель, которые сместил все а. м. о. в колонках этого участка относительно друг друга, затем программа вставляет дополнительный индель в 148-153 и следующие блоки выравниваний совпадают. Казалось бы, зачем она это сделала? Из таблицы 1 можно заметить, что в Mafft 84 (наибольшее число среди программ) абсолютно консервативных позиций, именно на этом участке в 139 позиции программа и получила лишнее совпадение аланинов, которое мне кажется маловероятным. В 148-153 позиции я сместила первые 2 можественных выравнивания, чтобы далее было удобнее сравнивать. Следующий блок различия на 212-220 позициях и 256-268. Здесь можно видеть, что Muscle в 268 позиции объединил серин в группу с лейцином и треонинами, в отличие от остальных 2 программ, объединивших его с аланином и лейцинами. При этом индель в этом блоке отличия одинаковый по длине, то есть различие именно в разных группах, а не в выигрыше от гэпов. С 367 позиции и до конца довольно интересное отличие - расположение фенилаланина и лейцина последнего белка, здесь удивила программа Tcoffee, которая вставила огромный индель в конце выравнивания, расположив лейцин на самой последней позиции - очень нелогичное действие с её стороны. Таким образом, для меня лучше всего показала себя программа Muscle, которая в моём примере не показала настолько явных ошибок, как 2 другие. Ссылка на скачивание выравнивания Tcoffee Ссылка на скачивание выравнивания Muscle Ссылка на скачивание выравнивания Mafft Описание трёх доменных архитектур, содержащих один и тот же доменДомен гельзолина на взяла из белка гельзолин человека P06396 [1], с которым я уже работала в практикуме 12.
Рисунок 6. Доменная архитектура гельзолина GELS_HUMAN (P06396)[3]
Из рисунка мы можем видеть, что в рассматриваемом белке встречаются только повторяющиеся домены
гельзолина. Архитектура - Gelsolin x 6.
Перейдя на страницу домена гельзолина в Pfam, мы можем увидеть распростарнённые архитектуры в порядке убывания количества соответствущих данной архитектуре белков. Оценить разнообразие архитектур можно на рис. 7. Далее мы рассмотрим 3 из них. Рисунок 7. 50 самых распространённых архитектур, содержащих гельзолин (из 129) [5].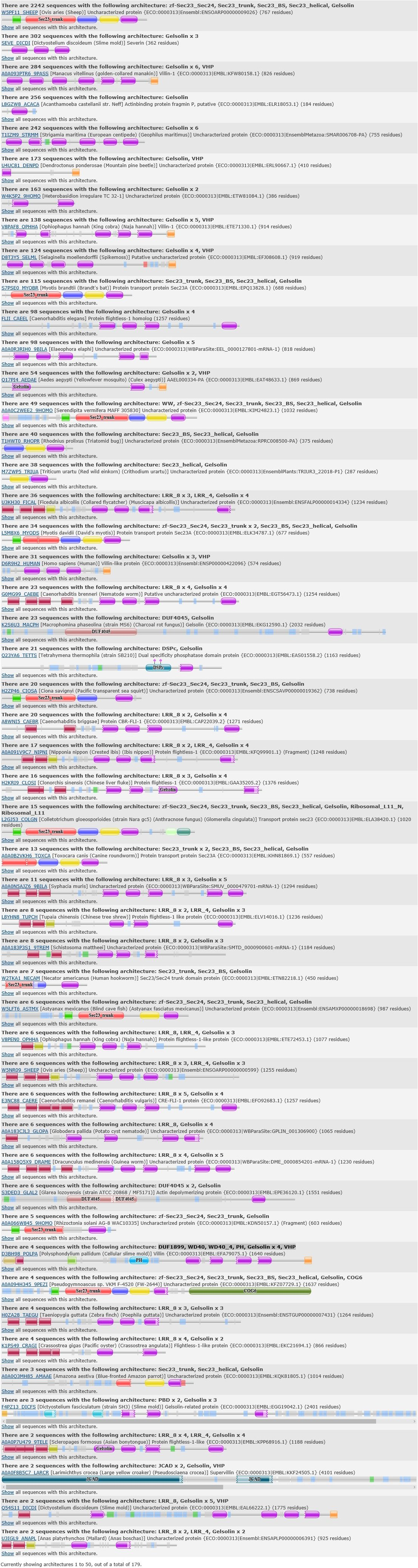 Доменная архитектура 1: zf-Sec23_Sec24, Sec23_trunk, Sec23_BS, Sec23_helical, GelsolinПервым рассмотрим самую распространённую архитектуру, которой соответствуют 2242 белка из базы данных. Рисунок 8. Доменная архитектура 1: A0A010QQV8_9PEZI (A0A010QQV8)[6]
Рассматриваемый белок принадлежит аскомицету Colletotrichum fioriniae PJ7, но она встречается и среди растений, и среди животных. Sec23 / Sec24 1 домен (отмечен зелёным) это Sec23/Sec24 цинковый палец. Это домен связывания цинка. COPII-покрытые везикулы переносят белки из эндоплазматического ретикулума в комплекс Гольджи. Этот везикулярный транспорт может быть воссоздан с использованием трех цитозольных компонентов, содержащих пять белков: малую GTPase Sar1p, комплекс Sec23p/24p и комплекс Sec13p/Sec31p. 2 домен это Sec23/Sec24 туловищный (trunk) домен. Этот домен известен как магистральный домен, имеет альфа и бета вторичные структуры и формирует интерфейс димера. 3 домен это Sec23/Sec24 бета-сэндвич домен, который характеризуется двумя противоположными антипараллельными бета-листами. Рисунок 9. Типичный бета-сэндвич (из белка 1TEN)
4 домен это Sec23/Sec24 спиральный (helical) домен. Этот домен состоит из пяти альфа-спиралей, типичный для описанных выше комплексов Sec23/Sec24. 5 домен это гельзолин, описание которого приведено выше в работе. Доменная архитектура 2: LRR_8 x 4, Gelsolin x 4Распространённую архитектуру, которой соответствуют далеко не так много белков, как первой - 23. Рисунок 9. Доменная архитектура 2: G0MG99_CAEBE (G0MG99)[7]
Рассматриваемый белок принадлежит нематоде Caenorhabditis brenneri. 1-4 домены это богатые лейцином повторы (LRR). Это белковые структурные мотивы, который образуют подковообразную складку альфа/бета. Они состоят из повторяющихся 20-30 аминокислотных остатков, которые необычно богаты гидрофобным аминокислотным лейцином. Эти повторы обычно сворачиваются вместе, образуя соленоидный белковый домен, называемый leucine-rich repeat (LRR). Как правило, каждый повторяющийся блок имеет бета-прямую-поворотную-альфа-спиральную структуру, а собранный домен, состоящий из множества таких повторов, имеет форму подковы с внутренним параллельным бета-листом и внешним массивом спиралей. Рисунок 10. Примеры структур LRR
5-8 домены это гельзолин. Доменная архитектура 3: DUF1899, WD40, WD40_4, PH, Gelsolin x 4, VHPДанной архитектуре соответствует только 4 белка. Рисунок 10. Доменная архитектура 3: D3BH98_POLPA (D3BH98)[8]
Рассматриваемый белок принадлежит представителю таксона Amoebozoa Polysphondylium pallidum, это виллин (сравнение гельзолина и виллина происходило в практикуме 12. 1 домен неизвестной функции, несмотря на то, что домен встречаетмя в 1635 белках. 2 домен это WD, G-бета повтор. Повтор WD40 (также известный как WD или бета-трансдуиновый повтор) представляет собой короткий структурный мотив приблизительно из 40 аминокислот, часто заканчивающийся дипептидом триптофана-аспарагиновой кислоты (W-D). Тандемные копии этих повторов обычно складываются вместе, образуя тип кольцевого соленоидного белкового домена, называемого доменом WD40. Рисунок 11. Пример структуры W40 домена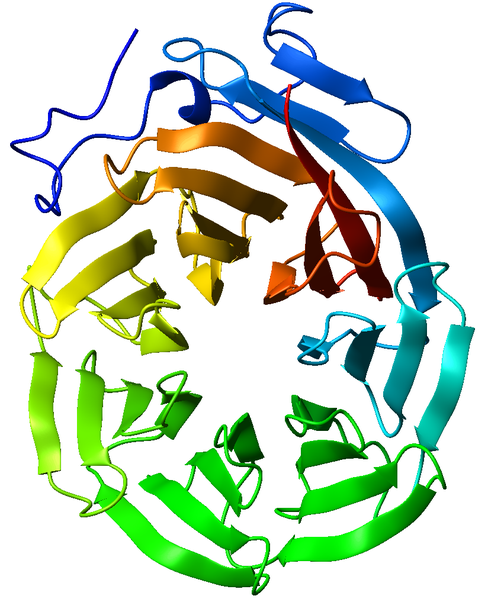
3 домен это один из типов WD-повтор домена. 4 домен это плекстрин-гомологичный (Pleckstrin homology) домен. Это белковый домен примерно из 120 аминокислот, который встречается в широком диапазоне белков, участвующих во внутриклеточной передаче сигналов, или в составе цитоскелета. Рисунок 11. Пример структуры PH-домена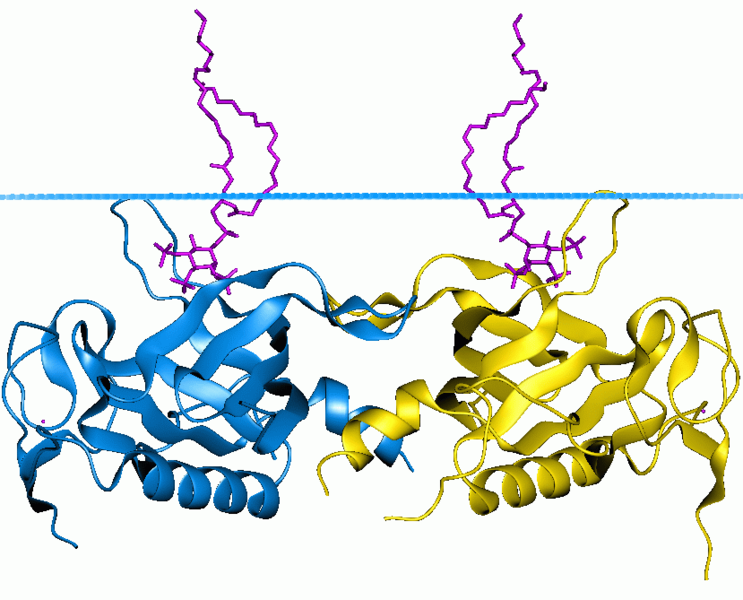
5-8 домены это гельзолин. 9 домен это домен N-конца (headpiece) виллина. Источники [1] UniProtKB/Swiss-Prot: P06396.1 [2] G.Isenberg . Actin-binding proteins - lipid interactions, 1991 [3] Pfam, Protein: GELS_HUMAN (P06396) [4] Pfam, Family: Gelsolin (PF00626), Pfam Clan [5] Pfam, Family: Gelsolin (PF00626), Domain organisation [6] Pfam, Protein: A0A010QQV8_9PEZI (A0A010QQV8) [7] Pfam, Protein: G0MG99_CAEBE (G0MG99) [8] Pfam, Protein: D3BH98_POLPA (D3BH98) |