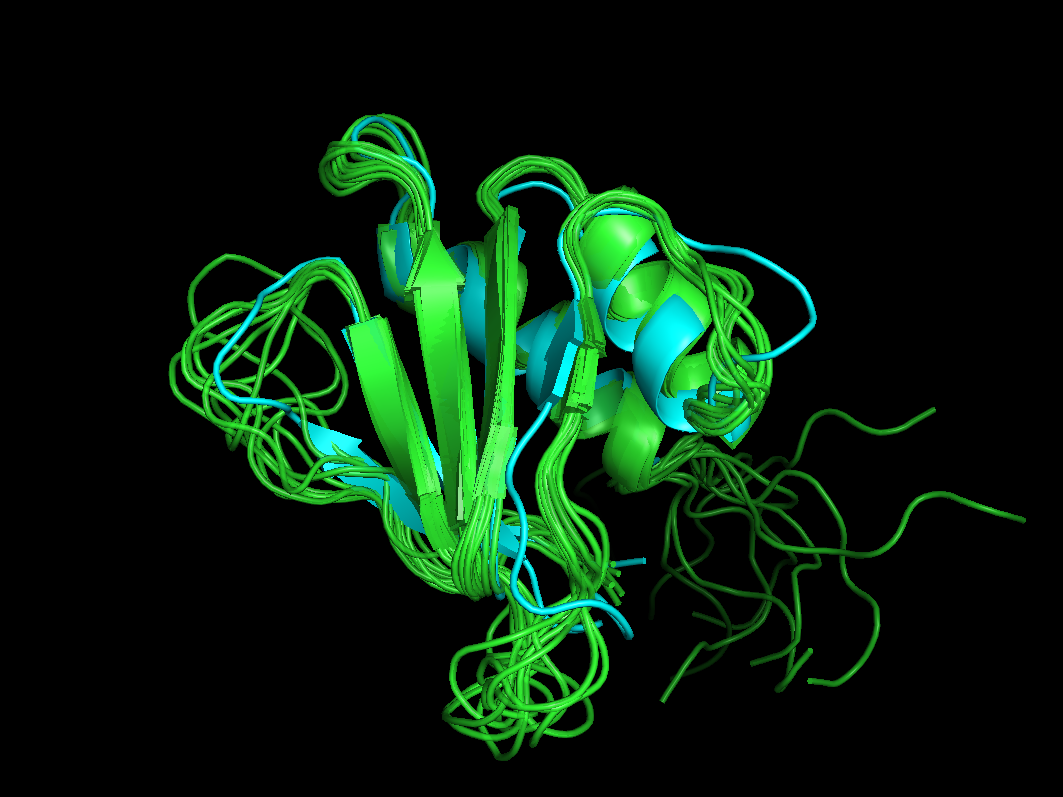
Рис 1. Наложение РСА-структуры и ЯМР-структур.
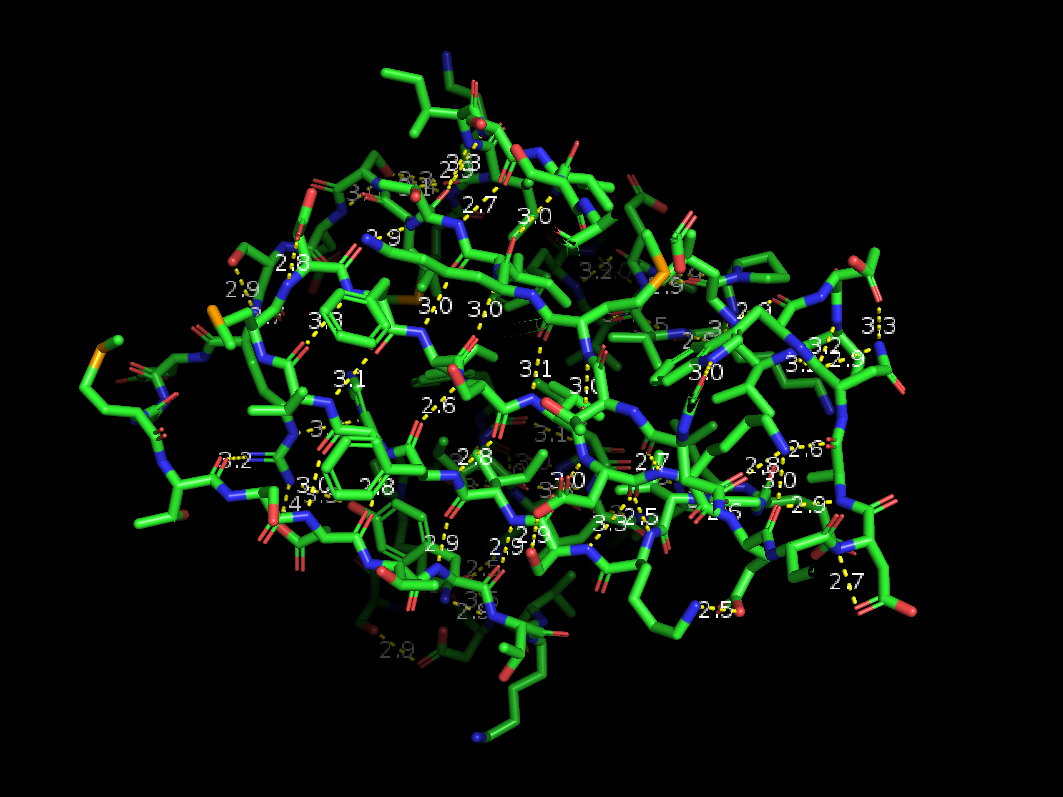
Рис 2. Водородные связи в РСА-структуре.
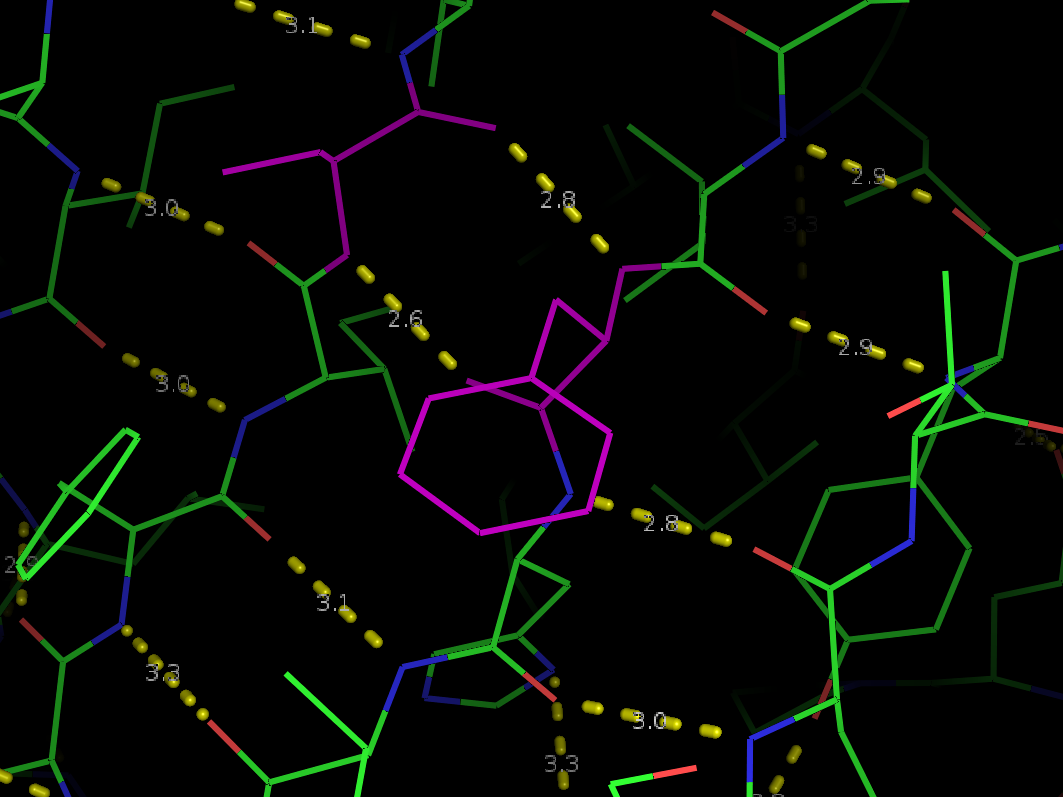
Рис 3а. Водородная связь в бета-складке.
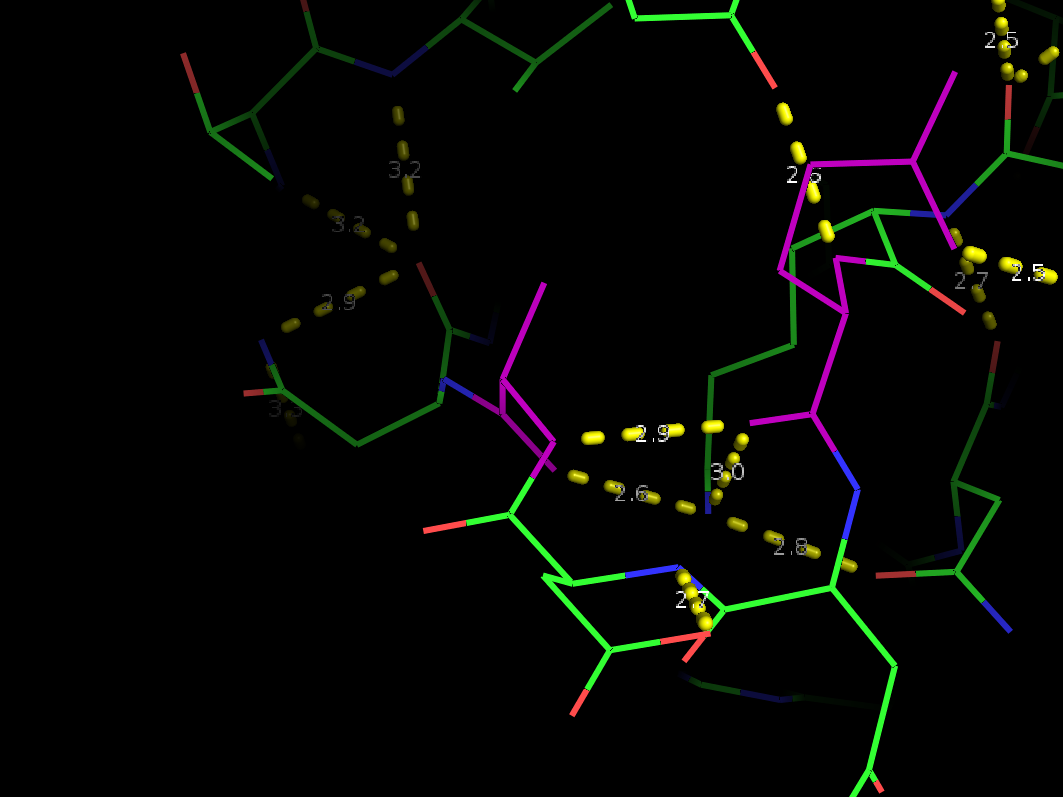
Рис 3б. Водородная связь во внешней петле.
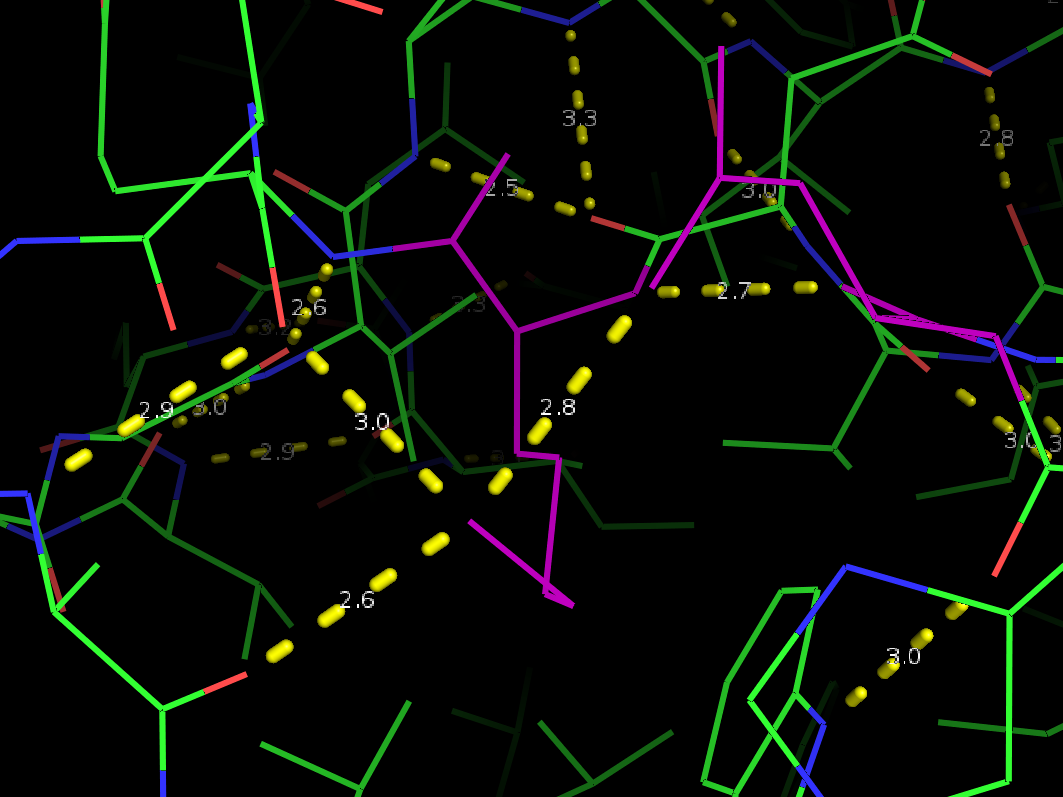
Рис 3в. Водородная связь между радикалами внутри глобулы.
| Связь | Расстояние между атомами в РСА, Å | Mинимум расстояний в ЯМР, Å | Mедиана расстояний в ЯМР, Å | Mаксимум расстояний в ЯМР, Å | Встречаемость в моделях ЯМР, число структур | Встречаемость в моделях ЯМР, % |
| PHE'55/N - SER'62/O | 2.8 | 2.73 | 2.93 | 3.17 | 10 | 100 |
| ALA'69/N - GLU'66/O | 2.9 | 2.53 | 3.36 | 5.41 | 5 | 50 |
| LYS'65/NZ - ASN'13/OD1 | 2.8 | 5.34 | 6.41 | 9.77 | 0 | 0 |