Молекулярная динамика биологических молекул в GROMACS¶
Моделирование плавления алфа-спирального пептида в формамиде¶
Технические детали
- Силовое поле используемое при построении топологии - amber99sb.
- Заряд системы = -1. Причины этого значения - заряженные аминокислоты в составе пептида.
- Размер ячейки - 5.06500 4.67000 4.22100, форма - кубическая.
Минимизация энергии:
- Алгоритм минимизации энергии - l-bfgs (quasi-Newtonian algorithm for energy minimization according to the low-memory Broyden-Fletcher-Goldfarb-Shanno approach)
- Алгоритм расчёта электростатики и Ван-дер-Ваальсовых взаимодействий - cut-off
- Модель, которой описывался растворитель - полноатомная модель формамида (был дан файл с ячейкой уравновешеных молекул формамида - fam_em.gro)
Утряска растворителя:
- Для биополимеров, укажите параметр который обуславливает неподвижность биополимера - define = -DPOSRES
- Число шагов - 1000
- Длина шага - 0,0002 ps
- Алгоритм расчёта электростатики и Ван-дер-Ваальсовых взаимодействий - pme, cut-off
- Алгоритмы термостата, xбаростата - V-rescale, no
Основной расчёт МД:
- Время моделирования - 6h13:53
- Количество процессоров - 8 OpenMPI Threads
- Эффективность масштабирования - Wait + Comm. 0.5%
- Длина траектории - 10000 ps
- Число шагов - 5000000
- Длина шага - 0,002 ps
- Алгоритм интегратора - md (leap-frog algorithm for integrating Newton’s equations of motion)
- Алгоритм расчёта электростатики и Ван-дер-Ваальсовых взаимодействий - pme, cut-off
- Алгоритмы термостата и баростата - v-rescale, Berendsen
Моделирование
6) В ходе оптимизации геометрии системы изменилось значение максимальное силы - от Fmax=2.295e+03 до Fmax=6.348e+02.
8) В ячейку было добавлено 901 молекула формамида (FAM).
10) На этом шаге была произведена процедура нейтрализации заряда системы. До этого заряд системы до был -1.000000, после стал 0.0 (добавился Na).
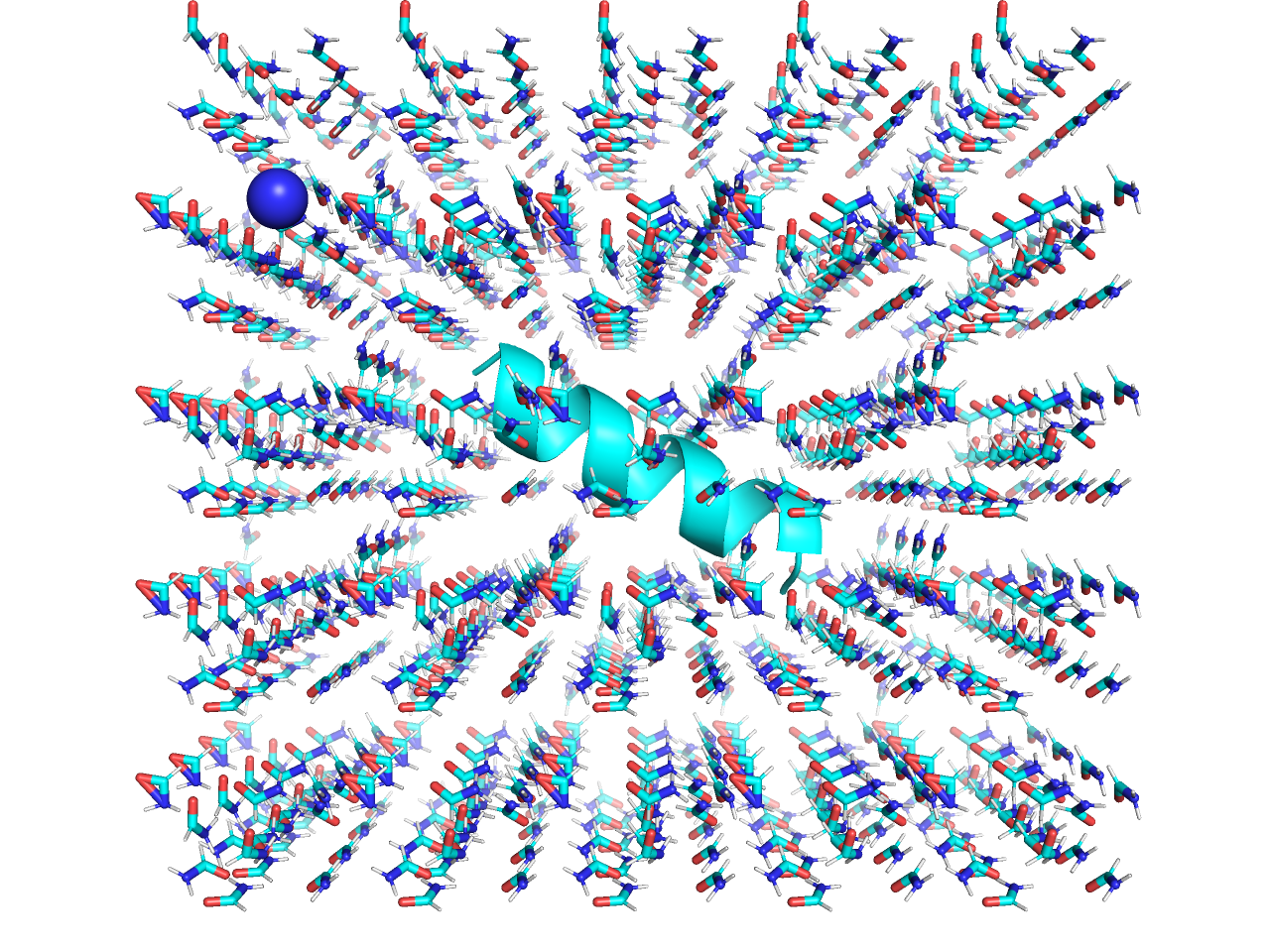
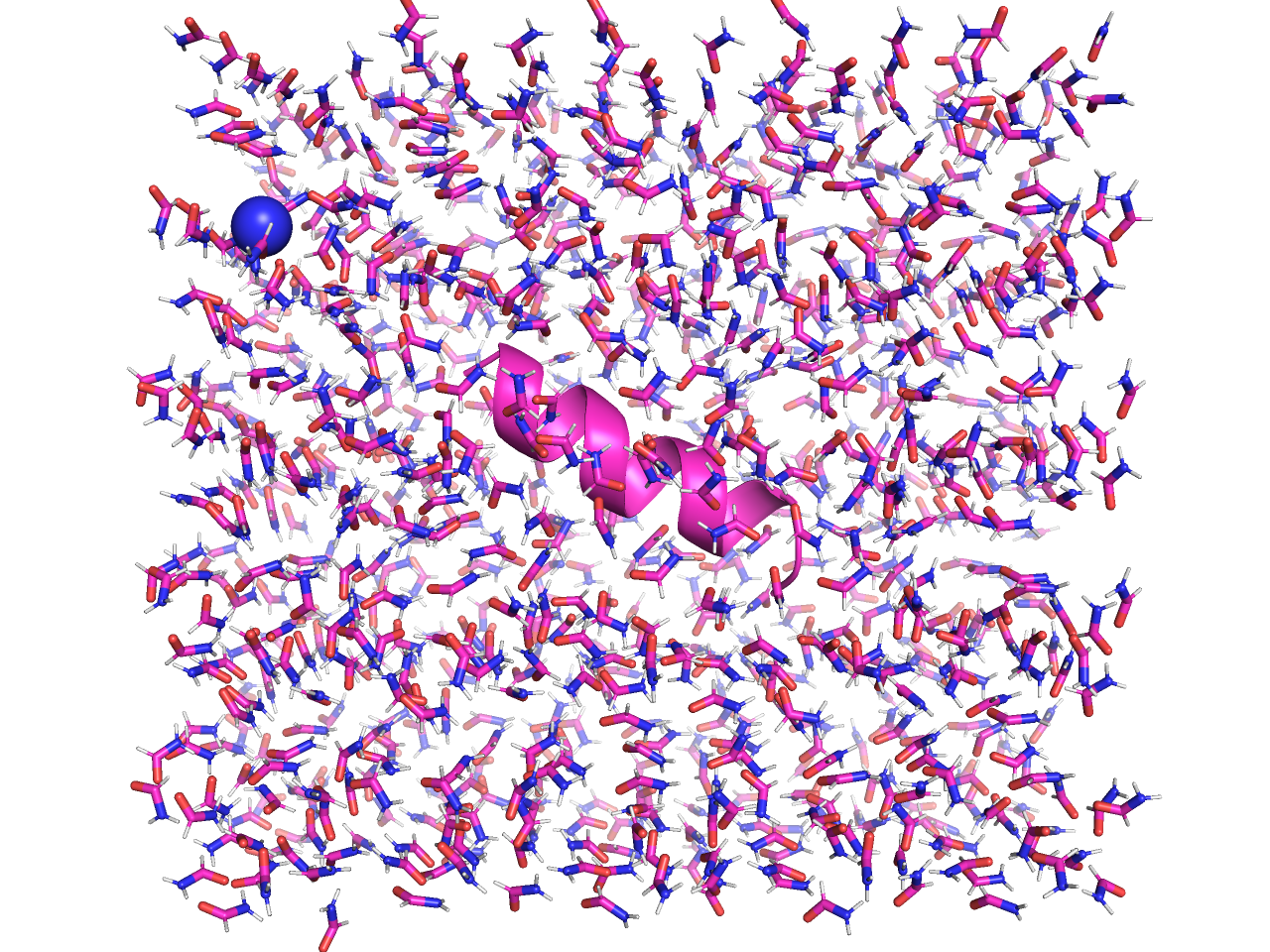
12) После утряски молекулы растворителя стали распологаться более хаотично.
Анализ
1) Визуальный анализ
Значимые изменения в 17-й модели (t= 3200.00000). В этот момент концевые участки белка расходятся в стороны и нарушается структура альфа-спирали. Но в целом все равно структура пептида сохраняется.
import pymol_mac
from pymol_mac import cmd
pymol_mac.finish_launching()
cmd.load('pep_fit_1.pdb')
cmd.orient()
cmd.move('z', 30)
cmd.bg_color('white')
cmd.do(f'mpng movie/, width={1920//3}, height={1080//3}')
import imageio
with imageio.get_writer('movie.gif', mode='I', fps=30) as writer:
for x in range(0, 50):
filename = f'movie/{x+1:04}.png'
image = imageio.imread(filename)
writer.append_data(image)
from IPython.display import Image
display(Image('movie.gif', format='png'))
2) Средне-квадратичное отклонение
Максимальное средне-квадратичное отклонение относительно стартовой структуры наблюдается при t=8290 и составляет 0,4141793. При расчете отклонения для каждой предыдущей структуры на растоянии 400 кадров ближе к концу оно уменьшается, что свидетельствует об окончании конформационного перехода.
3) Изменение поверхностей доступных растворителю
Значительных изменений в ходе моделирования не наблюдается. Можно отметить повышение гирофильной поверхности в области t= 3200.00000, что можно связать с нарушением альфа-спиральной структуры в концевой области пептида и экспонированием гилрофильных атомов на поверхность.
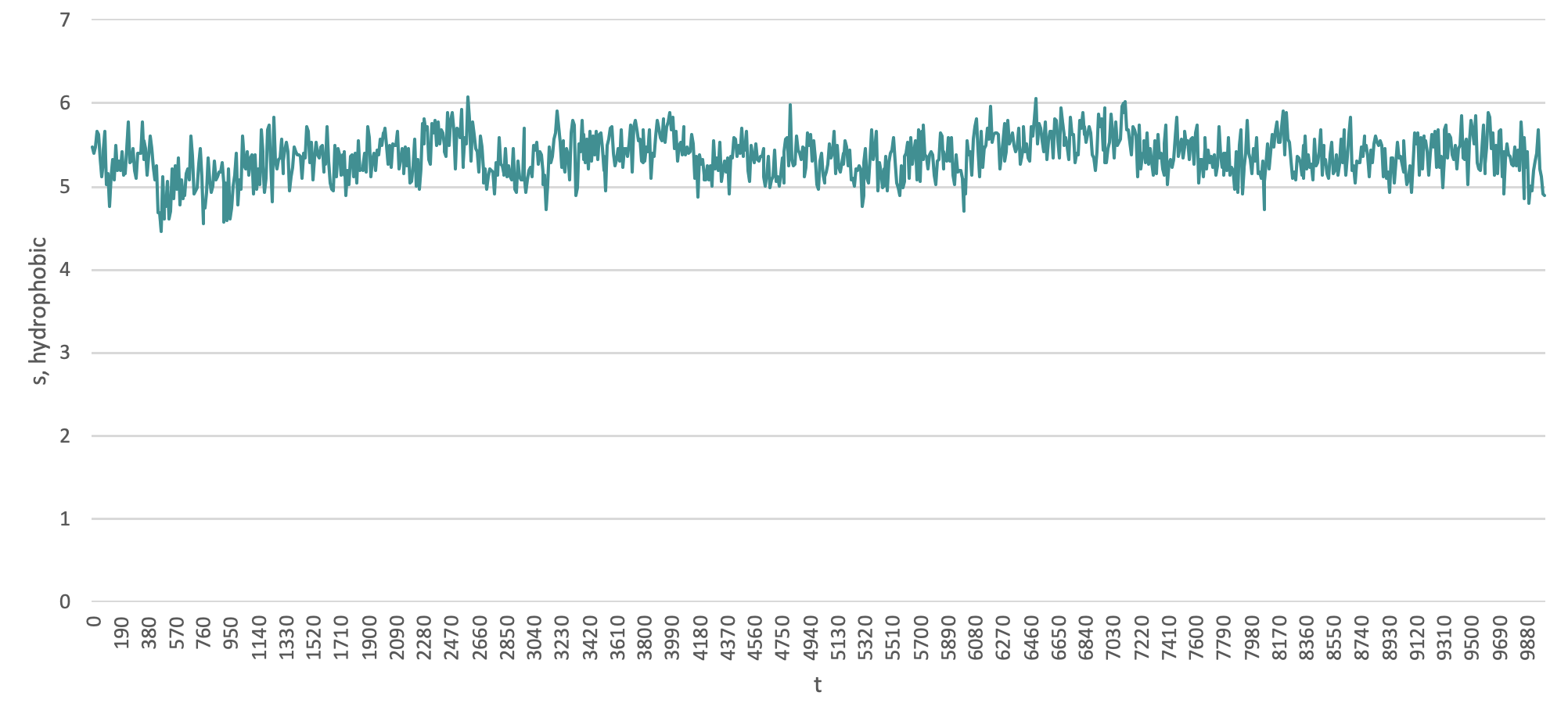
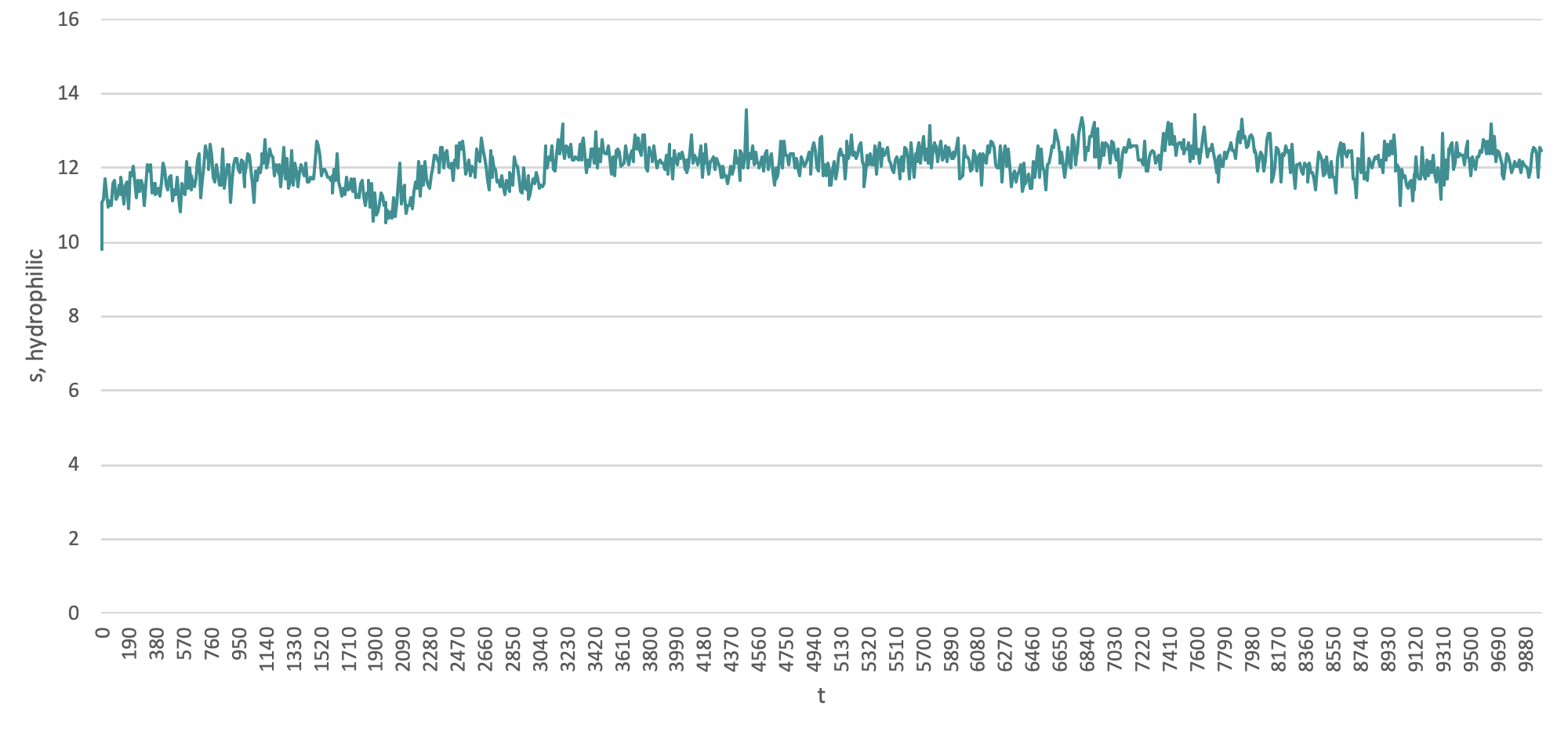
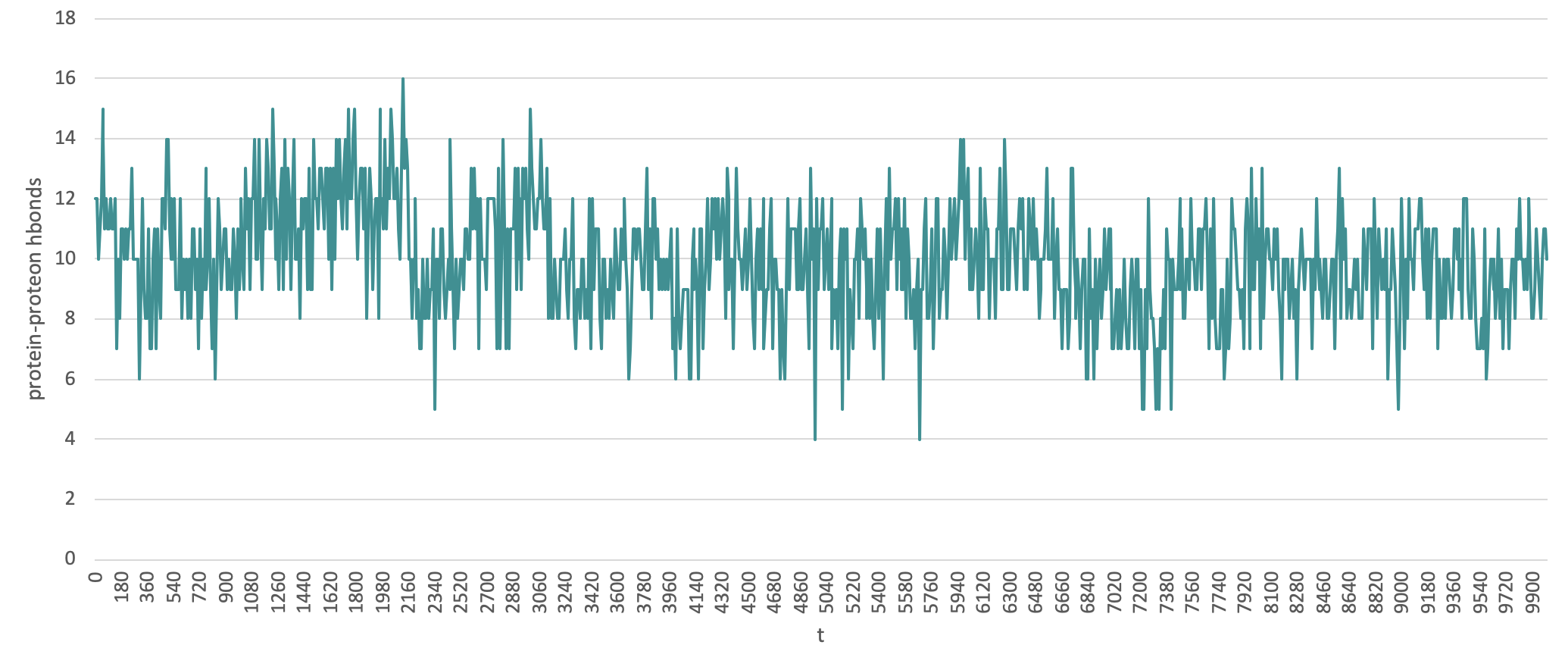
4) Водородные связи в пептиде
В начальный момент моделирования водородных связей в пептиде было 12. На конечный момент их стало 10, что связано опять же с нарушением структуры альфа-спирали в концевых участках пептида.
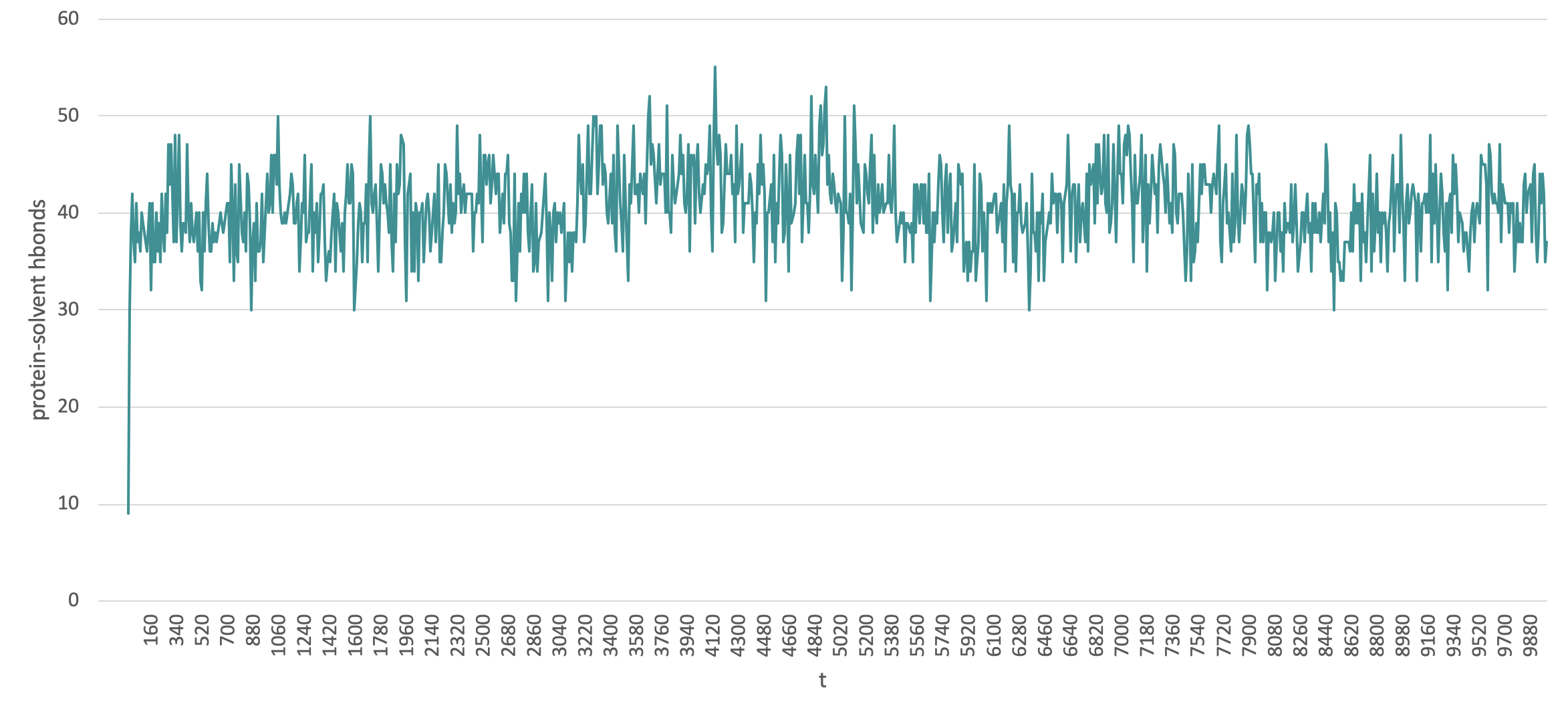
5) Количество водородных связей пептид-формамид.
В начальный момент времени пептид после утряски воды еще не релаксирован, поэтому количество водородных связей мало (9). На протяжении основного моделирования сильных изменений в числе водородных связей с растворителем не происходит.
6) Зависимость вторичной структуры от времени
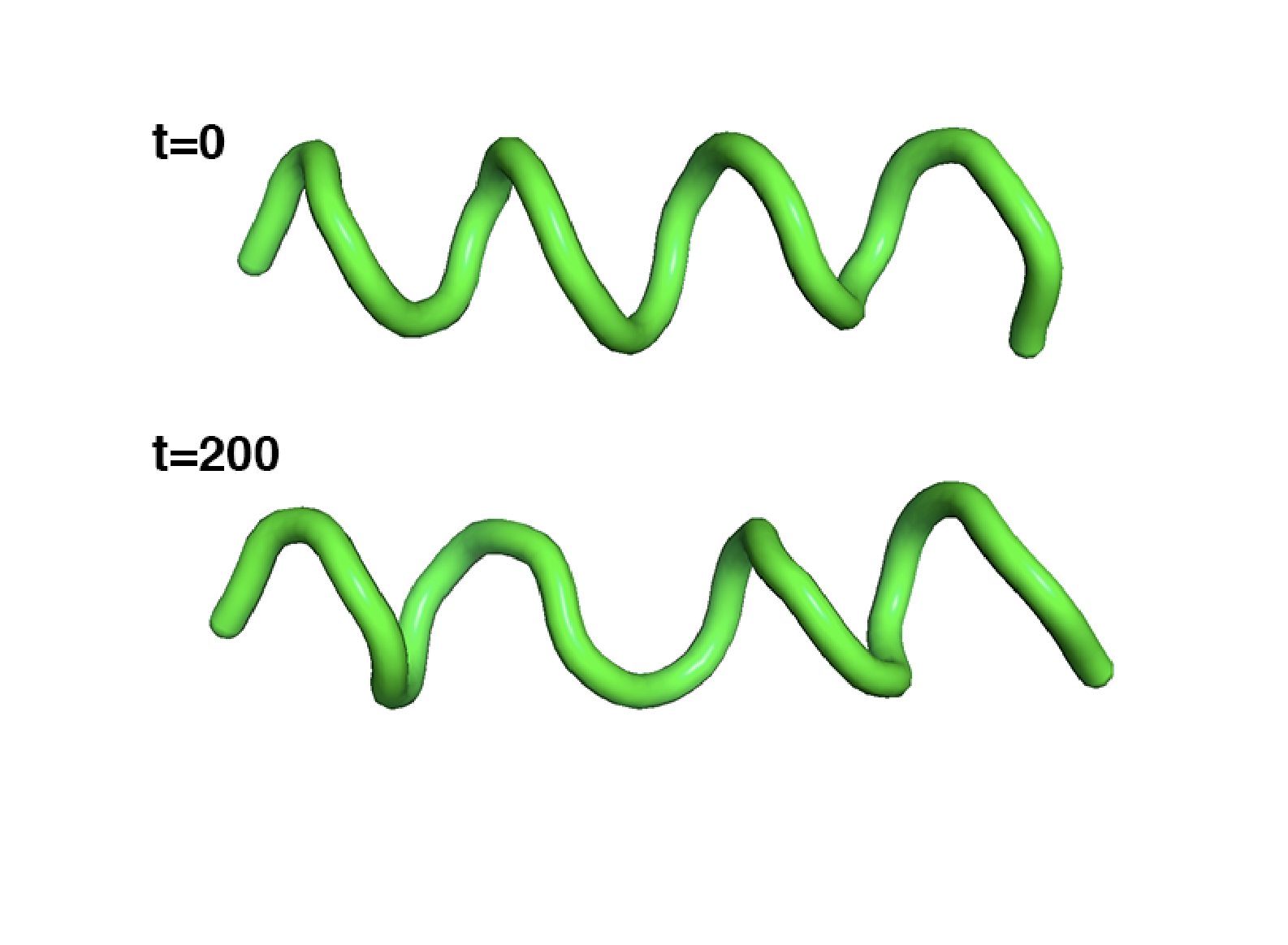
После начального момента времени альфа-спираль сильно деформируется (рис.8), но после 1000 пс она снова уравновешивается (рис.7). В конце моделирования (~после 7000 пс) наблюдается плавление с краев.