Обсуждения:
1. С базы данных
CluD была взята информация
о гидрофобных ядрах белка 3HZ3(ID). Согласно информации с этого сайта, всего имеются 35 гидрофобных ядра, из которых особо стоит отметить core10,
чей размер равен 1550 атомам, что составляет 75.5% от общего вклада атомов в купу гидрофобных ядер (соответственно всего 2053 атома слагают гидрофобное
ядро молекулы).
2. Был выбран остаток TYR797:A, так как является крупной аминокислотой с фенолом, связанным с -CH2 группой.
Минимальное расстояние, на котором остаток почти не виден, равно примерно 7А. Первые же атомы появляются уже на расстоянии
2А от аминокислотного остатка. Несложно проверить, что среднее расстояние, на котором находятся соседние ковалентно не связанные
между собой атомы в белке, равно примерно 4.5А. Диаметр атома кислорода в молекуле воды равен 2.8А, согласно данным, приведённым на
сайте. Так как среднее расстояние, вычисленное ранее, равно
4.5А, нетрудно понять, что молекула воды не поместиться даже в самый крупный промежуток, ведь (1.85*2+2.8)>4.5.
 |
| Рис. 1. Контактирующие аминокислоты.
|
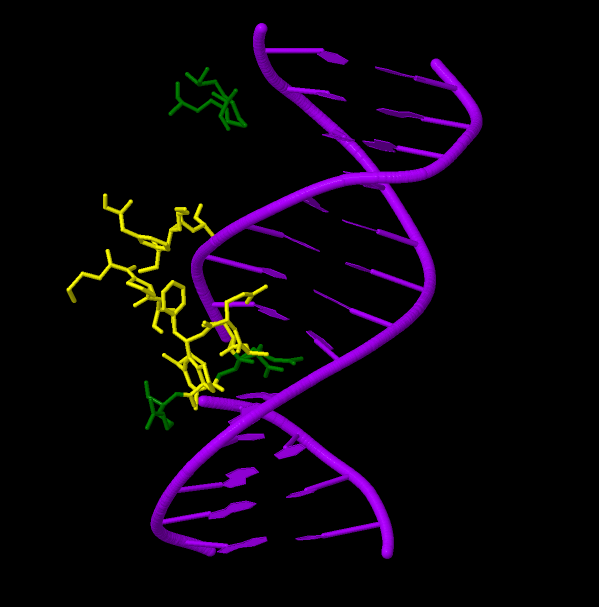
3. Последняя работа в 3 изображении иллюстрирует боковые радикалы остатков, сами остатки, которые находятся на расстоянии 5А от ДНК.
Интересно, что в одной цепочке ДНК отсутствует одно основание, которое является местом вхождения части белка. Обнаружена некоторая зависимость расположения
аминокислотных остатков в этой 'свободной' области. На рис.1 видны (сиреневый цвет) остатки заряженных аминокислот, а жёлтым цветом показаны гидрофобные остатки, такие как
пролин, цистеин, метионин, аланин, фенилаланин... Большая часть белка контактирует с сахарофосфатным остовом и большой бороздкой ДНК. С малой бороздкой контактируют
всего три остатка лизина.
Что касается роли ДНК-связанных белков, необходимо отметить их специфичную афинность, с чем и будут связаны большинство функций данных белков.
Белки могут выполнять следующие роли: [1]
- Содержать факторы транскрипции
- Гистоны, участвующие в упаковке генетического материала
- Усиление связи ДНК-белок
- Регуляция почти всех механизмов, происходящих с ДНК, таких как рестрикция, реплицирование, разрезание...
4. С помощью
рентгеноструктурного анализа можно восстановить
структуру ДНК. Схема описана в ссылке, поэтому остановимся только на главных моментах. Одним из самых действенных, простых и распространённых методов данного анализа является
пропускание элементарных частиц через структуру ДНК. Таким образом, определённые атомы, являющиеся донорами или акцепторами, в структуре будут слагать остов, который и может служить
ответом на вопрос.
5. Данная реакция относится к реакциям типа замещения (это понятно, судя по последней стадии, когда отщепляется п-нитрофенол, а на противоположное ему 'место' присоединяется 2-амино-3(5-гидроксифенил)пропановая кислота, Y+(-OH)).
Реакция проходит условно в четыре стадии:
- (Stable Complex) На первой стадии Y+(-OH)-соединение (1) 'подходит' к устойчивому комплексу с п-нитрофенолом (2)
- (Early State) На второй стадии происходит образование водородной связи между (1) и (2)
- (Late State) Третья стадия характеризуется перераспределением связей (ослабление с п-нитрофенолом, усиление с Y+(-O)) и некоторых атомов (H от (1))
- (Product) На последней стадии п-нитрофенол окончательно отщепляется от комплекса, а Y+(-O) окончательно присоединяется
Источники информации:
[1]: CluD
(Источник)
[2]: Wikipedia
(Источник)
[3]: RGB
(Источник)
[4]: dic.academic
(Источник)