Мембранные белки
База данных OPM
Была выдана цепь трансмембранного белка 4g1u (а именно 4g1u_A), ответственного за транспорт гемина, гем, где к атому железа присоединен атом хлора. В БД OPM было найдено предсказание расположения в мембране этого белка. Также нужно было выписать некоторые характеристики этого белка, а также белка, у которого трансмембранная часть представлена β-листами, 3dzm:
| Таблица 1. Сравнение характеристик трансмембранных белков, имеющих различную топологию в трансмембранной части | ||
|---|---|---|
| Характеристики | Белок 4g1u_A | Белок 3dzm |
| Толщина гидрофобной части мембраны | 29.8 ± 0.5 Å | 28.5 ± 2.6 Å |
| Координаты трансмембранных спиралей | 1(7-28), 2(56-77), 3(92-106), 4(115-137), 5(148-167), 6(191-211), 7(237-253), 8(259-271), 9(279-301), 10(309-324) | 1(4-12), 2(16-25), 3(33-42), 4(74-83), 5(93-104), 6(128-139), 7(144-155), 8(195-206) |
| Среднее количество остатков в одной трансмембранной спирали | 18.2 | 9.875 |
| Мембрана | внутрення часть мембраны Yersinia pestis | внешняя часть мембраны Thermus thermophilus |
Здесь можно скачать/посмотреть изображение белка (всего белка, а не какой-то цепи!), где p-сторона направлена вверх.
Анализ предсказания трансмембранных спиралей
В этом задании качественно сравнивались выдачи сервисов TMHMM и Phobius предсказания трансмембранных участков.
Для этого был скачан fasta файл белка, причем в этом файле C-конец в начале файла, а N - в конце. Результаты приведены ниже:
Текстовая выдача TMHMM и текстовая выдача Phobius.
Ниже приведена графическая выдача TMHMM:
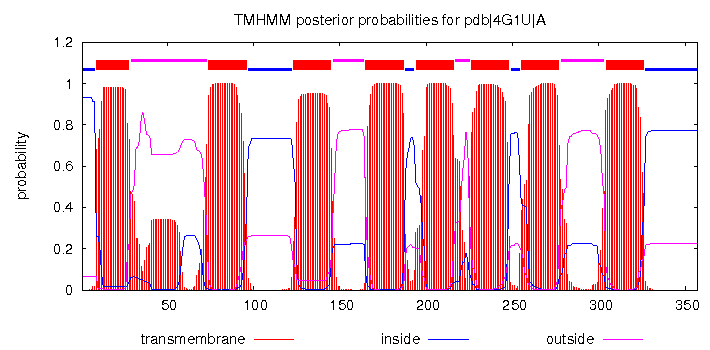
По оси x отложена длина последовательности, где каждому значению соответствует аминокислота, по оси y - апостериорная вероятность, то есть в нашем случае это вероятность расположения какой-то определенной амнинокислоты посчитанная со знанием того, что это за аминокислота. Другими словами для каждой аминокислоты мы предсказываем наиболее вероятную локализацию. Поэтому понятно, почему одной точке может соответствовать несколько значений, при этом в сумме все эти значения должны давать 1 (вероятность события равна 1).
Красным отмечено трансмембранное положение, синим - цитоплазматическое, лиловым - положение в окружающей среде. TMHMM предсказал 9 трансмембранных участков, причем только 5 более-менее совпали с реальными данными (совпадение с 1, 6, 7, 8 и 10). При этом остальные предсказанные трансмембранные участки занимают промежуточные положения между реальными трансмембранными участками. В целом предсказание TMHMM не очень удачное.
Ниже приведена графическая выдача Phobius:
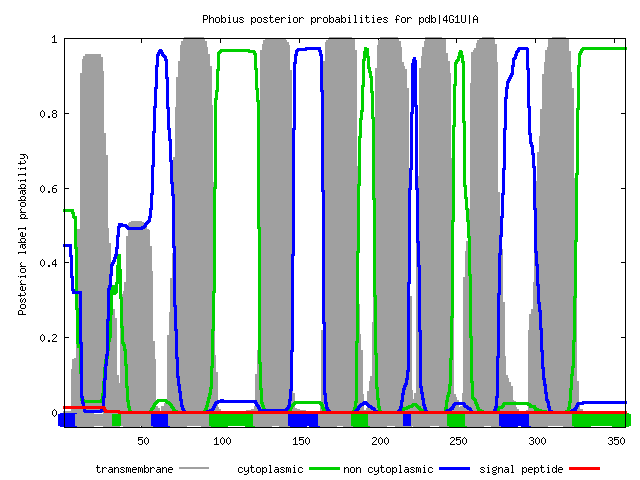
По осям отложено тоже самое, что и на предыдущем рисунке. Серым цветом отмечены трансмембранные участки, синим - участки (белка) вне клетки, зеленым - участки внутри клетки. Phobius предсказал примерно также как и TMHMM. Из 9 трансмембранных участков, которые он предсказал, 5 более-менее совпали с реальными трансмембранными участками (совпадение с 1, 2, 6, 8 и 10).
**Дополнительное задание: чем отличаются алгоритмы Phobius и TMHMM.
Стоит сказать, что оба этих метода отталкиваются от двух правил - первое, трансмембранные участки (ТМУ) должны содержать преимущественно гидрофобные аминокислоты, второе, участок, находящийся внутри клетки, должен содержать большое количество положительно заряженных аминокислот. Также оба метода используют за основу скрытую марковскую модель. Это такая статистическая модель, у которой есть неизвестные параметры, и на их основе рассчитываются другие параметры.
Изначально, до TMHMM, почти все алгоритмы, предсказывающие топологию трансмембранных белков, предсказывали только количество трансмембранных участков. TMHMM появилсяв 2001 году и научился предсказывать еще и длину таких участков.
Толчком к созданию Phobius стала следующая проблема - программы, которые предсказывают топологию трансмембранных белков, часто путают гидрофобные участки белка с сигнальными пептидами. Обратная ситуация с программами, которые предсказывают сигнальные пептиды. Чтобы решить эту проблему, необходимо было изменить алгоритм поиска ТМУ.
Вместо сканирования последовательности на ТМУ и последующей сортировки топологии на втором этапе, поиск на ТМУ может быть интегрирован с оценкой возможных топологий за один шаг. Распределение аминокислот исследуемой последовательности сравнивают с заранее рассчитанными ожидаемыми аминокислотными распределениями в каждом типе региона белка. Учитывая корреляционные измерения между аминокислотными распределениями исследуемого белка и ожидаемыми распределениями аминокислот в разных регионах, можно предсказать наиболее вероятную топологию. Phobius в таком случае должен работать лучше, так как должным образом взвешивает ВСЕ топогенные сигналы, а не только гидрофобные. [1][2]
База данных TCBD
БД TCBD представляет систему классификации транспортных мембранных белков. Каждому белку присваивается номер вида V.W.X.Y.Z, где V (число), W (буква), X (число), Y (число) - "таксоны" белка-транспортера (класс, семейство...), а Z (число) - субстрат.
В результате поиска в БД TCBD был найден 4g1u_a c тамошним идентификатором 3.A.1.14.5, где:
3 - Первичные активные транспортеры. Эти транспортеры используют первичный источник энергии для управления активным переносом растворенного вещества против градиента концентрации;
A - Транспортеры с гидролизом P-P связи. Транспортеры включены в этот подкласс, если они гидролизуют дифосфатную связь неорганического пирофосфата, АТФ или другого нуклеозидтрифосфата;
1 - Суперсемейство ABC (АТФ-связывающие кассеты) содержит транспортеры, которые способны к вкачиванию и выкачиванию вещества в клетку и из клетки соответственно. Члены этого семейства принимают непосредственное участие в процессе множественной лекарственной устойчивости;
14 - Транспортер арабинозы, фруктозы и ксилозы;
5 - Гемин.
Далее поиск велся по 3dzm. В итоге, был найден идентификатор 1.B.6.8.1, где:
1 - Белки этой категории имеют трансмембранные каналы, которые состоят в основном из α-спиральных или β-листов. Транспортеры этого типа катализируют облегченную диффузию;
B - Эти белки образуют трансмембранные поры, которые обычно обеспечивают независимый от энергии проход растворенных веществ через мембрану. Трансмембранные части этих белков состоят исключительно из β-листов, которые образуют β-бочку.;
6 - Большое семейство OOP (OmpA-OmpF porin) включает функционально хорошо охарактеризованный OmpA порин E.coli, а также OmpF порин P. aeruginosa;
8 - гомологи OmpA;
1 - ? (переносит ионы Ca2+).
**Дополнительное задание по описанию функции белков с идентификаторами 4g1u и 3dzm.
Характеристика 4g1u:
Субстратом является гемин (Ссылка).
Метаболические пути: перенос комплекса железа (FhuB, помечено красным) (Ссылка).
| Таблица 2. Отнесение белка 4g1u к терминам GO | |
|---|---|
| Термины GO | Характеристика белка |
| клеточный компонент | интегрирован с плазматической мембраной |
| молекулярная функция | активность белка-транспортера |
| биологический процесс | транспорт ионов железа |
COG для 4g1u: COG0609 с функцией "ABC-транспортная система (тип Fe3+), пермеазный компонент".
{Ссылка на картинку геномного окружения для белка}.
Характеристика 3dzm:
Субстратом является ? (Ссылка. Гипотетический белок).
Метаболические пути: неизвестно.
| Таблица 3. Отнесение белка 3dzm к терминам GO | |
|---|---|
| Термины GO | Характеристика белка |
| молекулярная функция | связывание ионов металла (Ca2+) |
COG для 3dzm: нет, есть NOG (не ортологичная группа) - NOG172477.
{Ссылка на картинку "геномного окружения" для белка}.
Ссылки:
1) Krogh et al. - Predicting transmembrane protein topology with a HMM: application to complete genomes. J.Mol.Biol.(2001); 305, 567-580.
2) Kall et al. - A combined transmembrane topology and signal peptide prediction method. J.Mol.Biol.(2004); 338, 1027-1036.
3) Wikipedia.
⌘
© Emir Radkevich, 2016