NMR vs RSA
Сравниваемые структуры
Для работы был выбран домен транскрипционного фактора, регулирующий экспрессию генов теплового шока, чья структура была расшифрована методом РСА (PDB ID: 2HTS, разрешение структуры: 1.83 Å) и ЯМР (PDB ID: 3HSF, количество моделей в структуре ЯМР: 30).
На рисунках ниже показано наложение структур, полученных обоими методами: РСА структура показана серым, а розовым — ЯМР структура. Левая картинка иллюстрирует наложение РСА структуры и ЯМР структуры, являющейся суперпозицией 30 ЯМР структур; на правой — изображено наложение всех 30 ЯМР структур и РСА структуры.
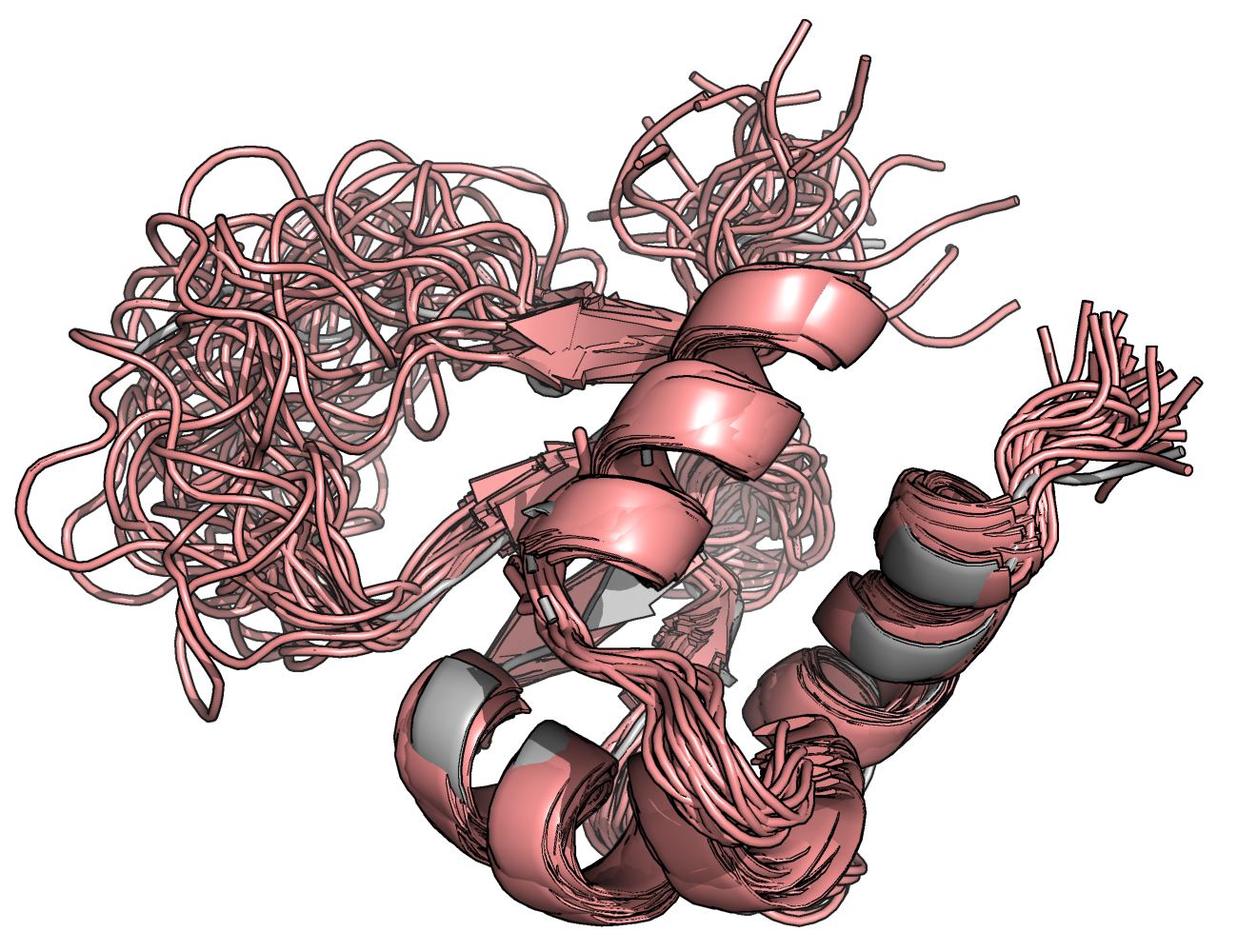
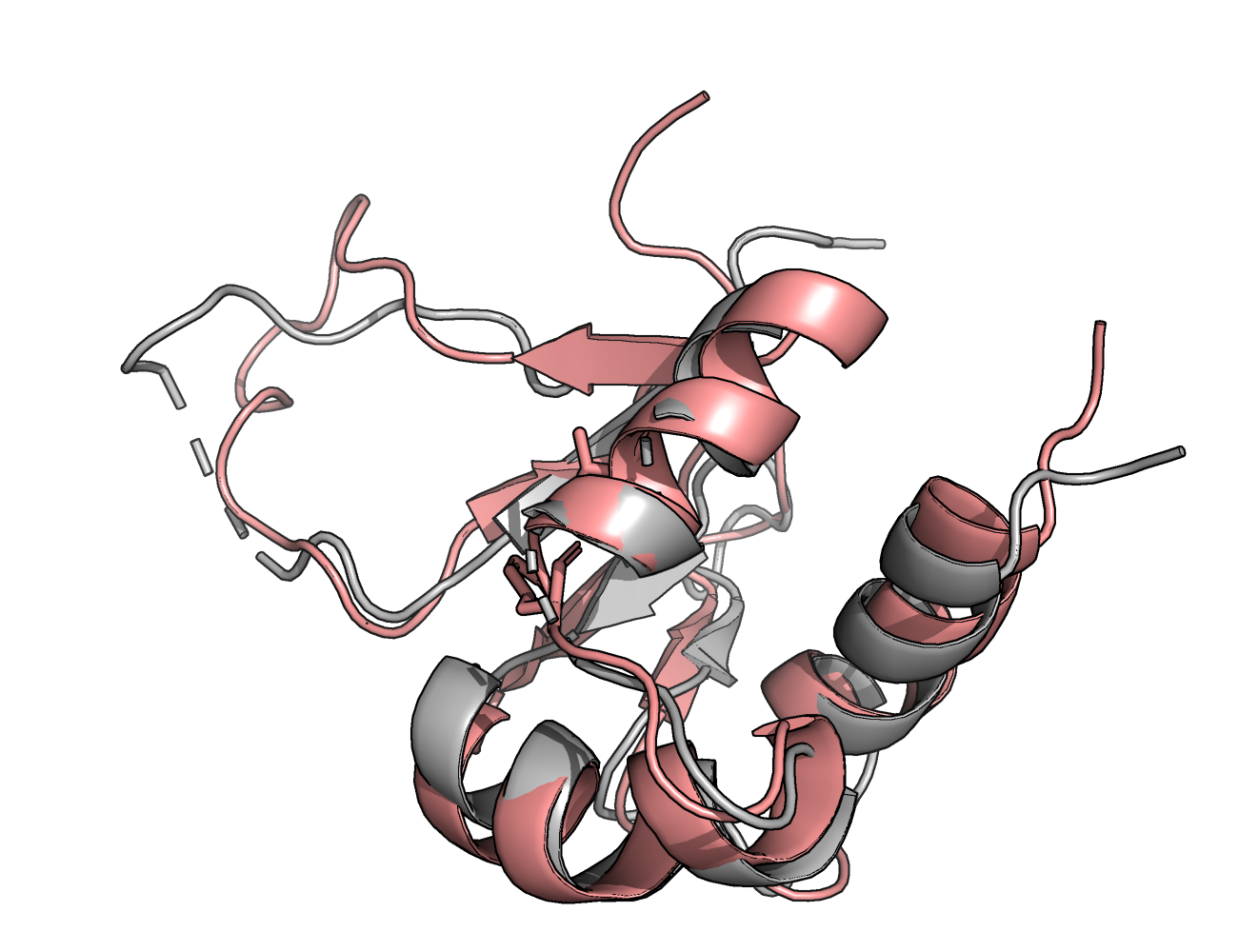
Видно, что структуры не очень похожи: сильные отличия видны в подвижных петлях, незначительные в элементах вторичной структуры.
Водородные связи
Между донором и акцептором протона есть водородная связь, если расстояние между ними ≤ 3,5 Å. Были выбраны три водородные связи: в α-спирали, в петле на поверхности и между β-стрэндами в ядре. Взаимодействующие остатки показаны ниже; в таблице 1 приведено описание рассмотренных связей.
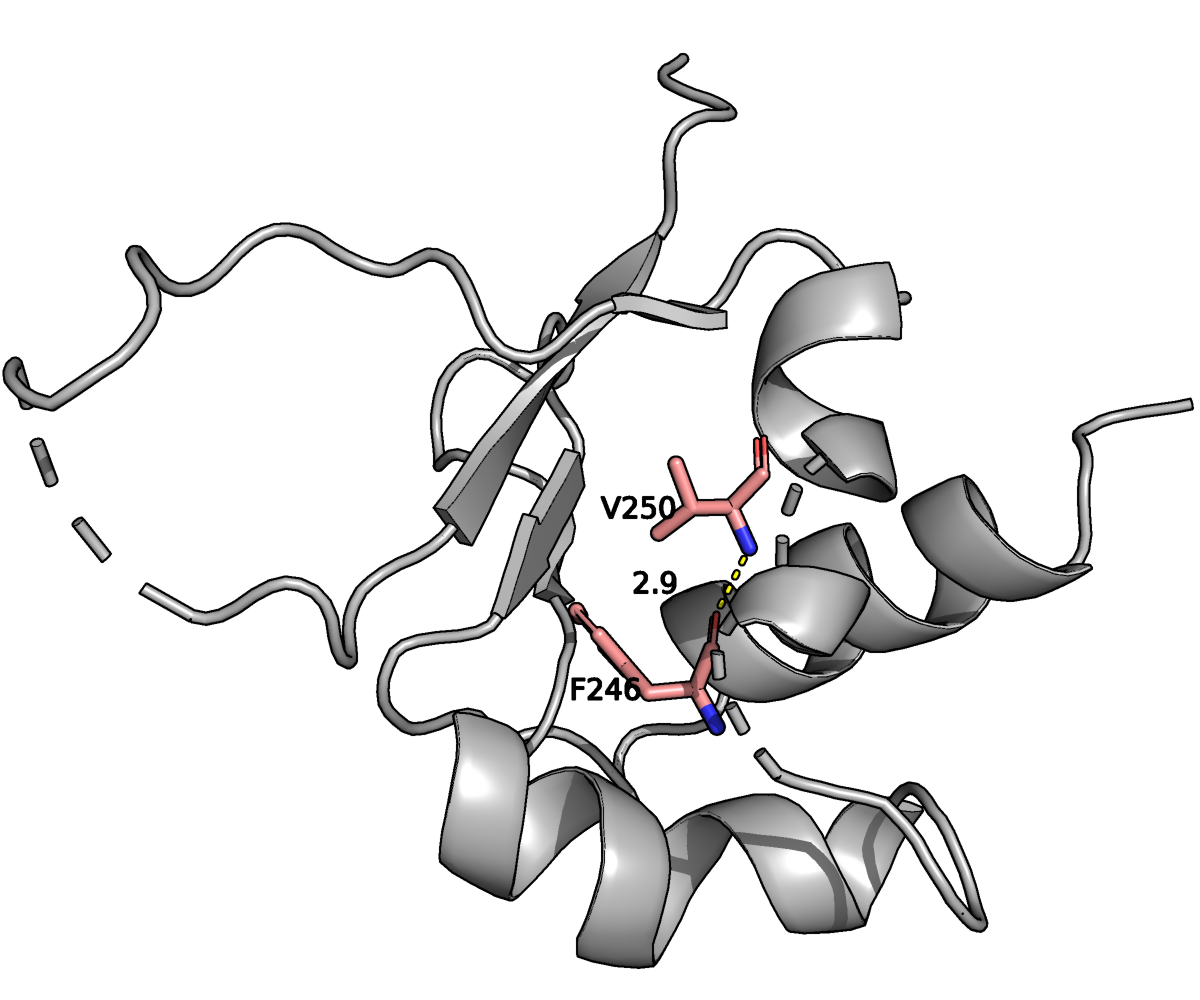 На рисунке приведено изображение водородной связи (желтая пунктирная линия) с длиной в 2.9
Å между атомом N остатка V250 и атомом O остатка F246 (обе молекулы показаны в виде
стиков; розовым отмечены Cα-атомы, красным — атомы кислорода, а синим — атомы
азота).
На рисунке приведено изображение водородной связи (желтая пунктирная линия) с длиной в 2.9
Å между атомом N остатка V250 и атомом O остатка F246 (обе молекулы показаны в виде
стиков; розовым отмечены Cα-атомы, красным — атомы кислорода, а синим — атомы
азота).
Оба остатка находятся внутри α-спирали, находящяейся внутри белка (в ядре).
Во всех 30 ЯМР структурах были найдены водородные связи (полярные контакты до 3.5 Å)
между этими остатками. Минимальная длина водородной связи между V250-N и F246-O в одной из моделей
ЯМР составила 2.2 Å, максимальная — 3.4 Å, а медиана — 2.7 Å.
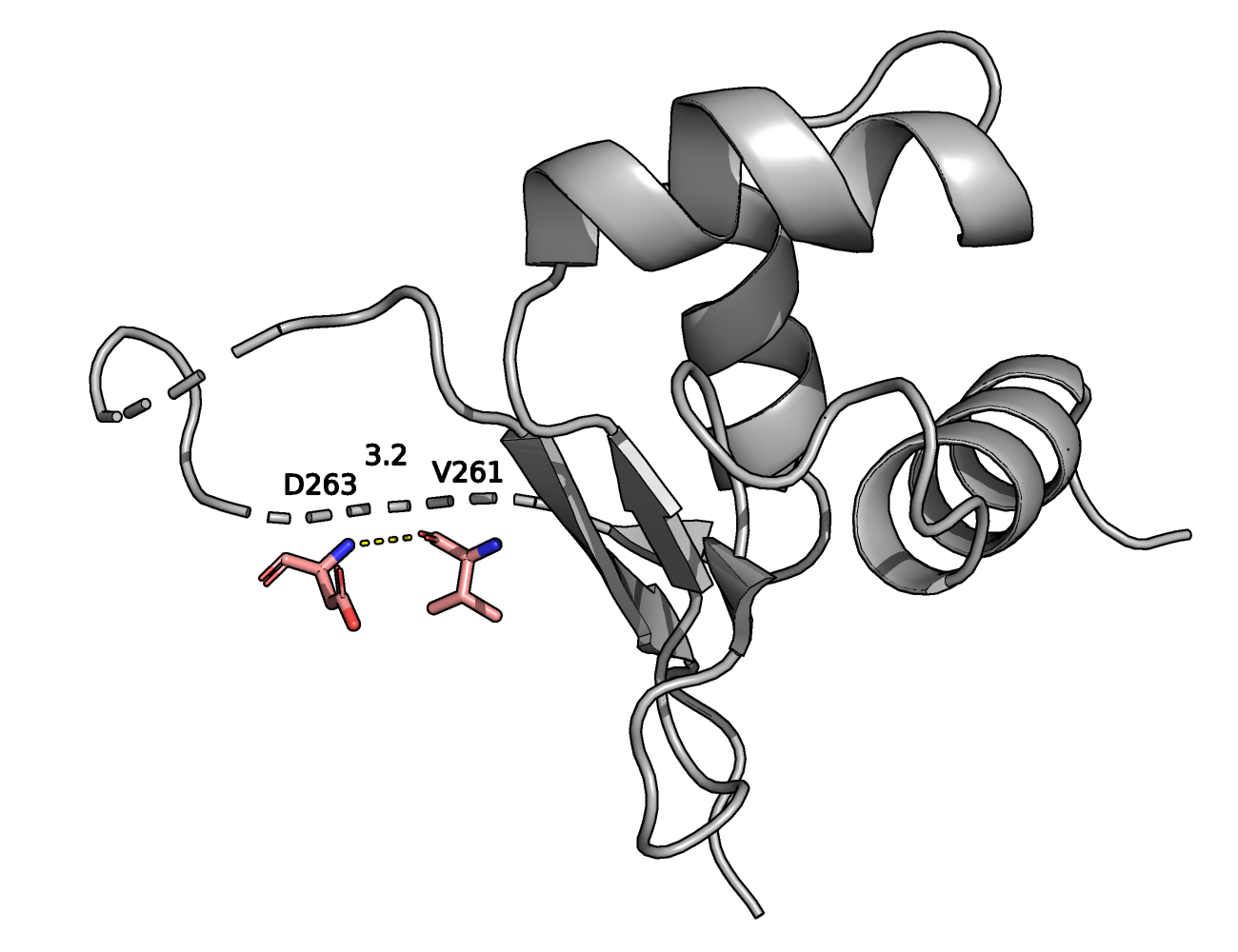 На рисунке изображена водородная связь (желтая пунктирная линия) с длиной в 3.2
Å между атомом N остатка D263 и атомом O остатка V261 (обе молекулы показаны в виде
стиков; розовым отмечены Cα-атомы, красным — атомы кислорода, а синим — атомы
азота).
На рисунке изображена водородная связь (желтая пунктирная линия) с длиной в 3.2
Å между атомом N остатка D263 и атомом O остатка V261 (обе молекулы показаны в виде
стиков; розовым отмечены Cα-атомы, красным — атомы кислорода, а синим — атомы
азота).
Оба остатка находятся в петле, находящяейся на поверхности белка.
В двух ЯМР структурах были найдены водородные связи (полярные контакты до 3.5 Å)
между этими остатками. Минимальная длина водородной связи между D263-N и V261-O в одной из моделей
ЯМР составила 2.7 Å, максимальная — 3.5 Å, а медиана — 3.1 Å.
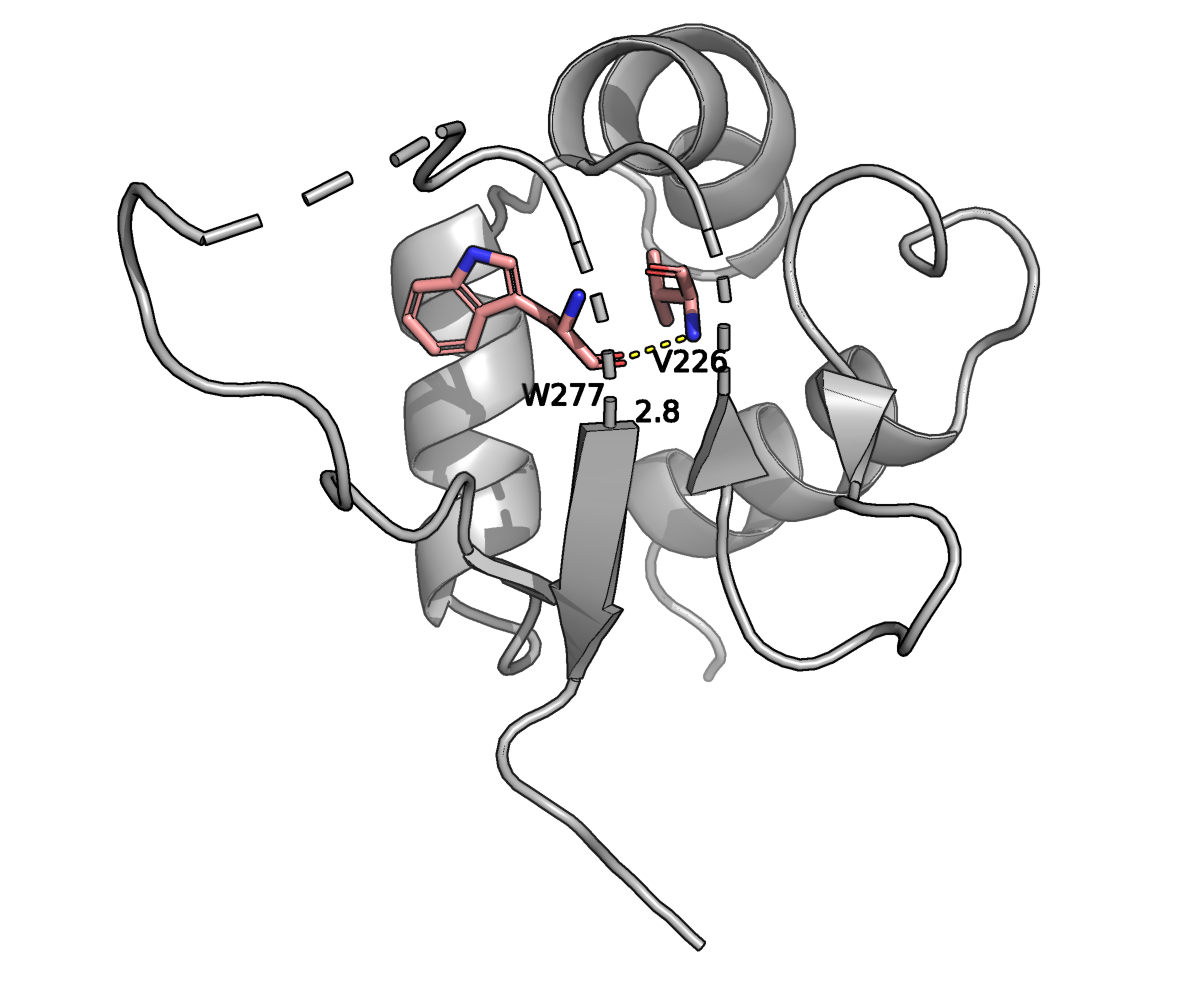 На рисунке приведено изображение водородной связи (желтая пунктирная линия) с длиной в 2.8
Å между атомом O остатка W227 и атомом N остатка V226 (обе молекулы показаны в виде
стиков; розовым отмечены Cα-атомы, красным — атомы кислорода, а синим — атомы
азота).
На рисунке приведено изображение водородной связи (желтая пунктирная линия) с длиной в 2.8
Å между атомом O остатка W227 и атомом N остатка V226 (обе молекулы показаны в виде
стиков; розовым отмечены Cα-атомы, красным — атомы кислорода, а синим — атомы
азота).
Оба остатка находятся в β-стрэндах, находящихся недалеко от поверхности белка.
В 12 ЯМР структурах были найдены водородные связи (полярные контакты до 3.5 Å)
между этими остатками. Минимальная длина водородной связи между W227-O и V226-N в одной из моделей
ЯМР составила 2.0 Å, максимальная — 3.4 Å, а медиана — 2.3 Å.
| Таблица 1. Описание водородных связей в ЯМР и РСА структурах | ||||||
|---|---|---|---|---|---|---|
| Атомы остатков | Расположение остатков | Длина связи, Å | Число моделей со связью (ЯМР) | Min длина связи, Å (ЯМР) | Max длина связи, Å (ЯМР) | Медиана длины связи, Å (ЯМР) |
| V250-N ::: F246-O | Внутри α-спирали | 2.9 | 30 | 2.2 | 3.4 | 2.7 |
| D263-N ::: V261-O | В петле | 3.2 | 2 | 2.7 | 3.5 | 3.1 |
| W227-O ::: V226-N | Между β-стрэндами | 2.8 | 12 | 2.0 | 3.4 | 2.3 |
Видно, что во всех 30 ЯМР структурах были обнаружены водородные связи между атомами остатков, находящихся в α-спирали в ядре белка. Это довольно предсказуемо, учитывая то, что этот участок является относительно неподвижным. С другой стороны, в петле, наиболее неподвижном участке белка, наблюдается наибольшая динамика остатков, соответственно и водородных связей между атомами этих остатков (в данном случае было найдено всего 2 модели с водородной связью между исследуемыми остатками в петле).
Почти в половине моделей ЯМР (12) были найдены водородные связи между атомами остатков, находящихся в β-стрэндах недалеко от поверхности белка. Это ожидаемый результат, так как даже несмотря на то, что остатки находятся в элементах вторичной структуры, сами β-стрэнды экспонированы наружу, что повышает подвижность этого участка белка.