Цистеин | Cysteine
Цистеин — это стандартная аминокислота, необходимая людям для нормального функционирования.
Она особенна тем, что содержит в своём составе функциональную тиольную (—SH) группу.
| Основные сведения |
| Однобуквенный код | C |
| Трёхбуквенный код | Cys |
| Название по IUPAC | (2R)-2-амино-3-сульфанилпропановая кислота |
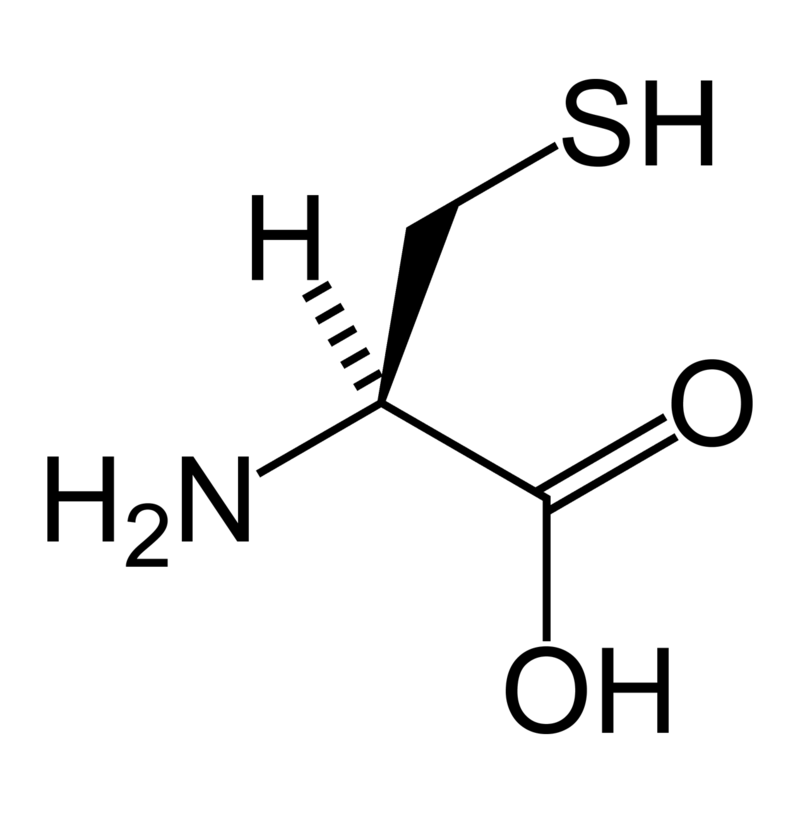
| Химическая формула | HO2CCH(NH2)CH2SH |
| Брутто-формула | C3H7NO2S |
| Идентификатор PubChem | 5862 |
Физико-химические свойства |
| Молярная масса | 121,16 г/моль |
| pK1 | 1.96 |
| pK2 | 10.28 |
| pKR | 8.18 |
| pI | 5.07 |
| Гидропатический индекс | 2.5 |
Общее |
| Встречаемость в белках | 1.9% |
| Заменимость | заменимая |
|
|
—SH-Группа особенна тем, что является хорошим нуклеофилом, поэтому может вступать в реакции
нуклеофильного присоединения или замещения. Остатки цистеина в белках имеют константу диссоциации
pKa, близкую к нейтральной, поэтому часто они находятся в форме тиолат-иона: именно в такой форме
цистеин наиболее реакционно активен.
Существует ряд ферментов, принцип действия которых основан на нуклеофильной атаке цистеина. К ним
относится, например, убиквитинлигаза, которая ковалентно присоединяет убиквитин (прим.: Убиквитин —
это небольшой регуляторный белок, выполняющий ряд важных функций в клетках эукариот.) к белку-мишени
изопептидной связью. Также нуклеофилами благодаря цистеину являются белки-каспазы (cysteine-dependent
aspartate specific protease), которые играют важную роль в процессах апоптоза, некроптоза и проч.
Структурно цистеин
очень похож на серин, однако, в отличие от серина, цистеин склонен участвовать в окислительно-
восстановительных реакциях: так, окисление цистеина приводит к возникновению связи между двумя
атомами серы из двух разных остатков этой аминокислоты.
Такие ковалентные связи между двумя атомами серы часто назыают «дисульфидными мостиками». Они играют
важную роль при фолдинге белков и поддержинии их устойчивости. Например, в белках, которые выделяются
во внеклеточную среду, число SS-мостиков избыточно, чтобы увеличить стабильность молекулы
в суровых условиях, а также усилить протеолитическую сопротивляемость. В белках же, которые используются
внутри клетки, дисульфидные мостики играют роль в поддержании третичной структуры белка. Так, в инсулине
две отдельные полипептидные цепи «сшиты» парой дисульфидных связей.
Цистеин может проявлять себя в различных ДНК-белковых взаимодействиях, входя в состав различных белковых структур, таких как,
например, цинковые пальцы. Цинковый палец - небольшой белковый мотив, стабилизированный одним или двумя ионами цинка, связанными
координационными связями с аминокислотными остатками белка. Как правило, цинковый палец включает около 20 аминокислот, а сам ион
цинка связывает 2 гистидина и 2 цистеина. Цинковые пальцы являются белковыми модулями, взаимодействующими с ДНК, РНК, другими
белками или небольшими молекулами. Основными группами белков с цинковыми пальцами являются ДНК-связывающие факторы транскрипции, а
также искусственные ферменты рестрикции, получаемые слиянием ДНК-связывающего домена цинкового пальца с ДНК-разрезающим доменом.
Домен цинкового пальца может быть спроектирован так, чтобы узнавать желаемую последовательность ДНК и связываться с ней.
Важную роль цистеин играет в молекуле рецептора витамина D. Молекула РВД состоит из трех функциональных доменов. Первый из них,
С1, - гидрофильный домен, эволюционно наиболее консервативен и имеет большое сходство с ядерными рецепторами. Он расположенный на
N-конце РВД, содержит 70 аминокислот и богат цистеином, лизином и аргинином. В функционально активной молекуле РВД первые 8
цистеинов связаны с двумя атомами цинка и образуют структуру цинковых пальцев, которая, взаимодействуя с ДНК, может регулировать
работу многих генов мишеней. Мутации, приводящие к замене любого из этих цистеинов, блокируют связывание РВД со специфической
последовательностью ДНК, прерывая, таким образом, РВД-зависимую активацию генов-мишеней. Известно, что такие мутации чаще всего
несовместимы с жизнью или могут приводить к редкому моногенному заболеванию - витамин-D-резистентному рахиту.
Источники
- Википедия: Цистеин
- New World Encyclopedia: Cysteine
- Генетический паспорт - осонова индивидуальной
и предиктивной медицины. /Под редакцией В. С. Баранова. - СПб.: Изд-во Н-Л, 2009.-528 c.:ил.
-
Википедия: Цинковый палец

