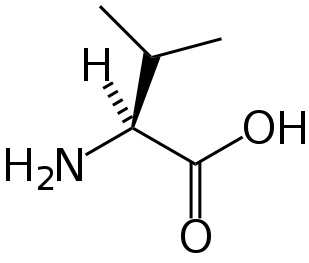
Валин | Valine
Валин — алифатическая α-аминокислота, одна из 20 протеиногенных аминокислот, входит в состав практически всех известных белков. Названа в честь растения валерианы.
| Основные сведения |
| Однобуквенный код | V |
| Трёхбуквенный код | Val |
| Название по IUPAC | 2-амино-3-метилбутановая кислота |
| Химическая формула | HO2CCH(NH2)CH(CH3)2 |
| Брутто-формула | C5H11NO2 |
| Идентификатор PubChem | 1182 |
Физико-химические свойства |
| Молярная масса | 117.15 г/моль |
| pK1 | 2.32 |
| pK2 | 9.62 |
| pKR | - |
| pI | 5.97 |
| Гидропатический индекс | 4.2 |
Общее |
| Встречаемость в белках | 6.6% |
| Заменимость | незаменимая |
|
|
Эта аминокислота является алифатической, поэтому в составе белков при различных pH находится в одной и той же форме.
Валин играет важную роль в фолдинге белков, так как является неполярной и может входить в состав гидрофобных ядер
и формировать так называемые «липкие» гидрофобные контакты. Так, при серповидноклеточной анемии аномальные свойства
гемоглобина объясняются заменой всего одной аминокислоты — остаток глутаминовой кислоты в положении 6 в β-цепях замещается остатком валина.
Она не несёт электрического заряда, тогда как глутаминовая кислота при pH 7.4 имеет отрицательный заряд.
В результате у мутировавшего гемоглобина (S) на две отрицательно заряженные группы меньше, чем у нормального гемоглобина (A)
— по одной в каждой β-цепи. Образовавшиеся «липкие» гидрофобные контакты приводят к тому, что молекулы дезоксигемоглобина S
слипаются и образуют аномально длинные нитевидные агрегаты, характерные для серповидноклеточной анемии.
Валин склонен образовывать водородные связи посредством атомов остова с сахаро-фосфатным остовом
ДНК.
Аминокислоты белкового домена могут интеркалировать в структуру ДНК в случае ее изгиба, выпетливания или выщепления азотистого основания,
а также если торец ДНК контактирует с белковым доменом. Валин часто бывает задействован в таких интеркаляциях.
Например в ряде случаев интеркаляция происходит за счет изгиба ДНК (например в структуре 1azp) , и аминокислотные остатки
аланина, валина и метионина, встраиваясь между нуклеотидами, образуют гидрофобный контакт с атомами азотистого основания,
относящимися к большой бороздке.
Также валин входит в шестерку консервативных аминокислот лейциновой молнии.
Источники
- Википедия: Валин
- New World Encyclopedia: Valine
- Mandel-Gutfreund Y., Schueler O., Margalit H. Comprehensive analysis of hydrogen bonds in regulatory protein
DNA-complexes: in search of common principles. // J. Mol. Biol. – 1995. – Vol. 253. – № 2. – P. 370–382.
- Сравнительная характеристика структур ДНК-белковых комплексов

