Протонирование
В данном практикуме мы работали с сервисом PDB2PQR, в котором реализован алгоритм PROPKA, предсказывающий pKa ионизируемых групп. Я работала со структурой модифицированной оксидазы L-аминокислот 7C4N, полученной методом восстановления предковой последовательности в рамках задачи по получению улучшенной версии этого фермента [1]. Кристаллизация структуры происходила при pH 3.5.
Я отобрала несколько аминокислот из набора {D,E,H}, для которых предсказанный pKa сильно выше ожидаемого. В скобках значение pKa для свободной аминокислоты. Для гистидина не было обнаружено остатков, предсказанный pKa которых заметно отличается от теоретического.
- ASP 580, pKa=8.39 (3.80)
- ASP 250, pKa=7.56 (3.80)
- GLU 83, pKa=7.83 (4.50)
- GLU 573, pKa=9.61 (4.50)
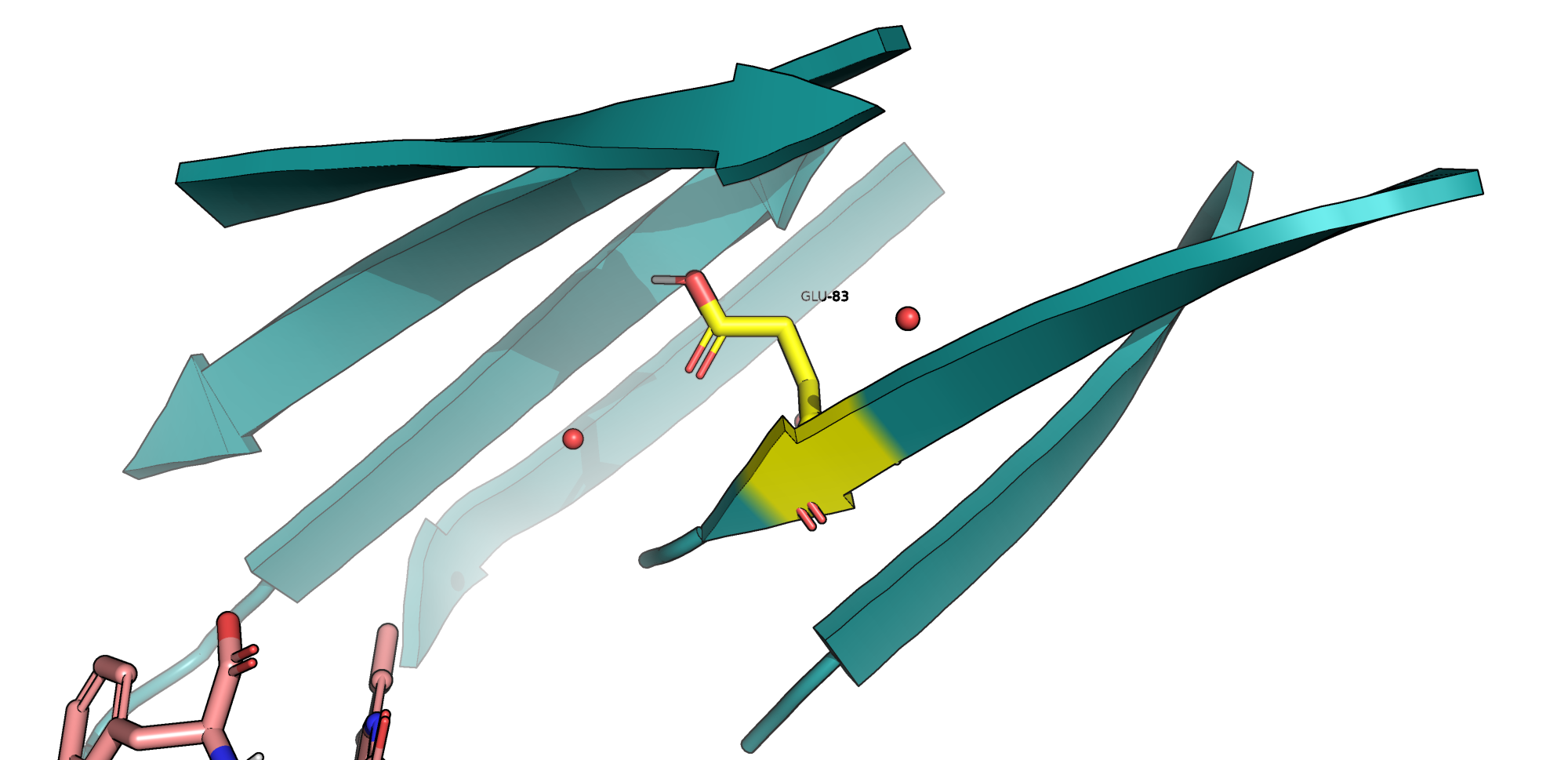
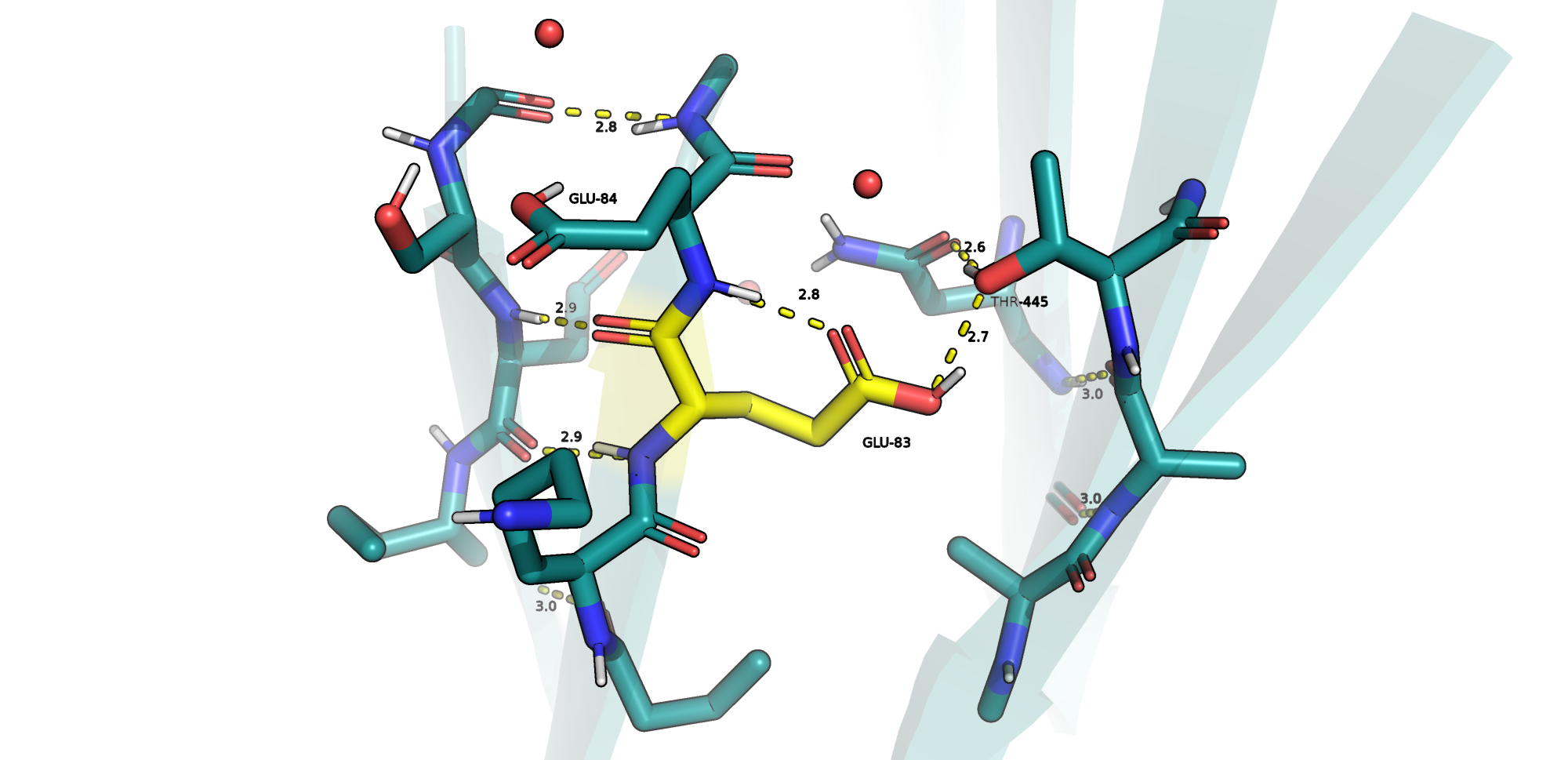
GLU-83
Данный остаток расположен между двумя бета-листами (Рис. 1). В протонированной форме он образует водородные связи как донор и акцептор (с NH-группой остова GLU-84 и с OH-группой THR-445), что показано на Рис.2. Таким образом, думаю, что предсказание факта протонирования не ошибочно.
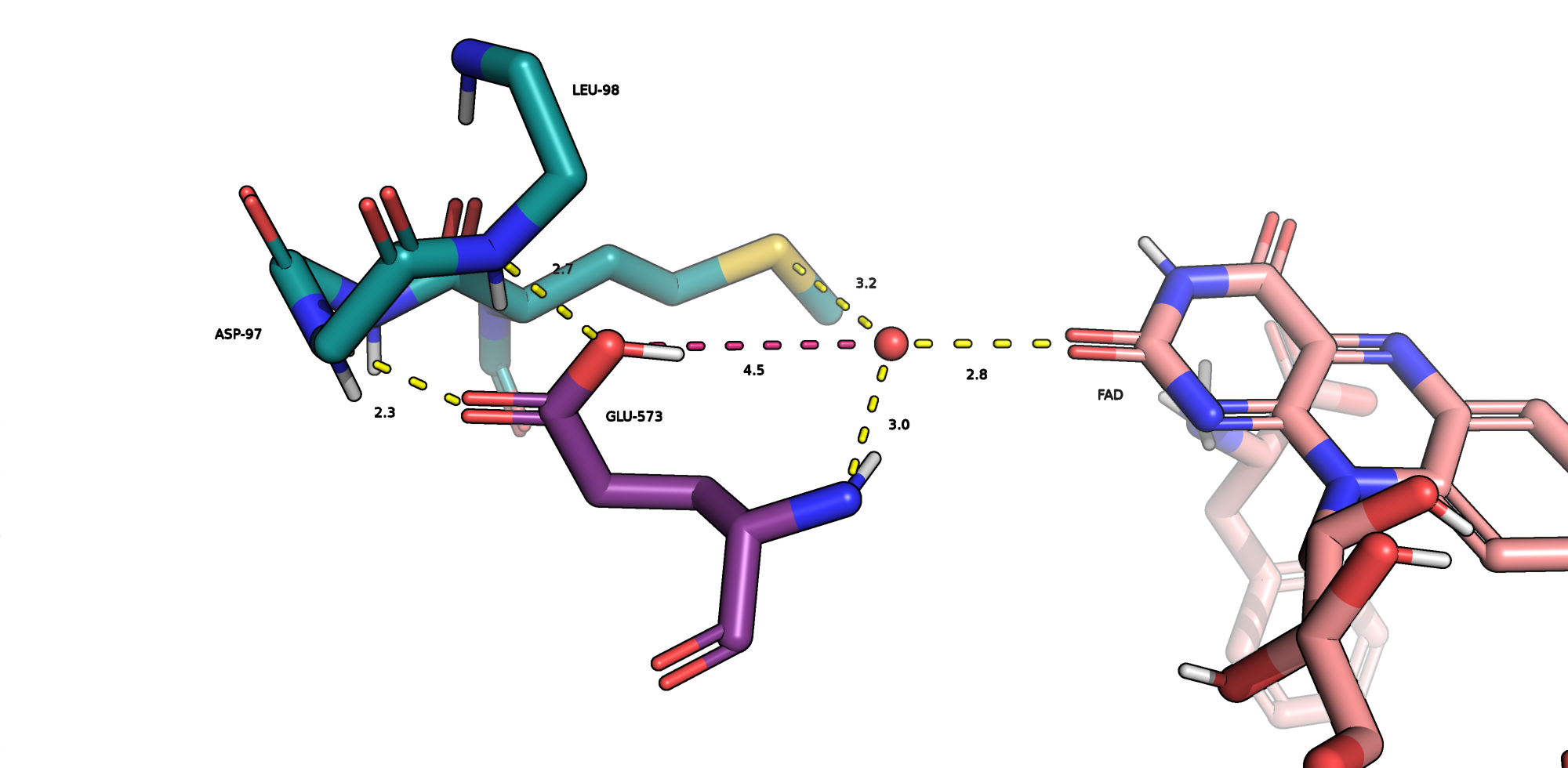
GLU-573
Он имеет самый высокий pKa из рассматриваемых остатков. На Рис.3 отмечены предполагаемые водородные связи, образуемые GLU-573: с NH-группами остова ASP-97 и LEU-98. Красным цветом на этом же рисунке показано расстояние между кислородом воды и карбоксильной группы GLU-573, оно составляет 4.5 Å и указывает на отсутствие образования даже слабой водородной связи. При этом я не обнаружила других кандидатов на образование третьего(четвертого*) водяного мостика с рассматриваемой молекулой воды. Возможно, происходят конформационные изменения, которые позволяют всем трем (четырем*) обозначенным остаткам формировать водяные мостики между ними и кофактором (FAD). Таким образом, для данного остатка нельзя дать однозначное обоснование как для наличия протонированной, так и депротонированной формы GLU-573.
* Уточнение про количество аминокислот, образующих водородные мостики с водой, относится к метионину, показанному на Рис.3. Расстояния до двух потенциальных акцепторов водородной связи (NH-группа остова и молекула воды), вписываются в критерии водородной связи, но метионин не склонен их образовывать...
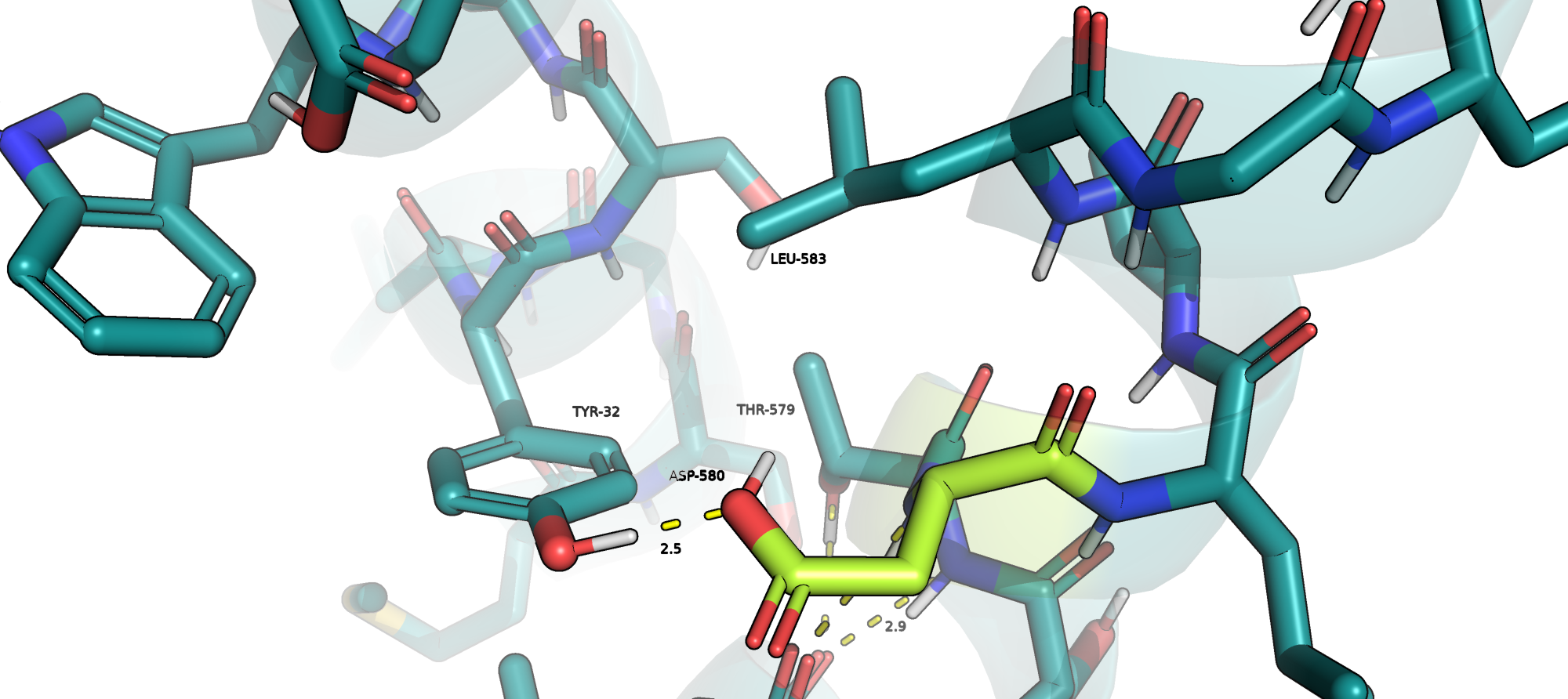
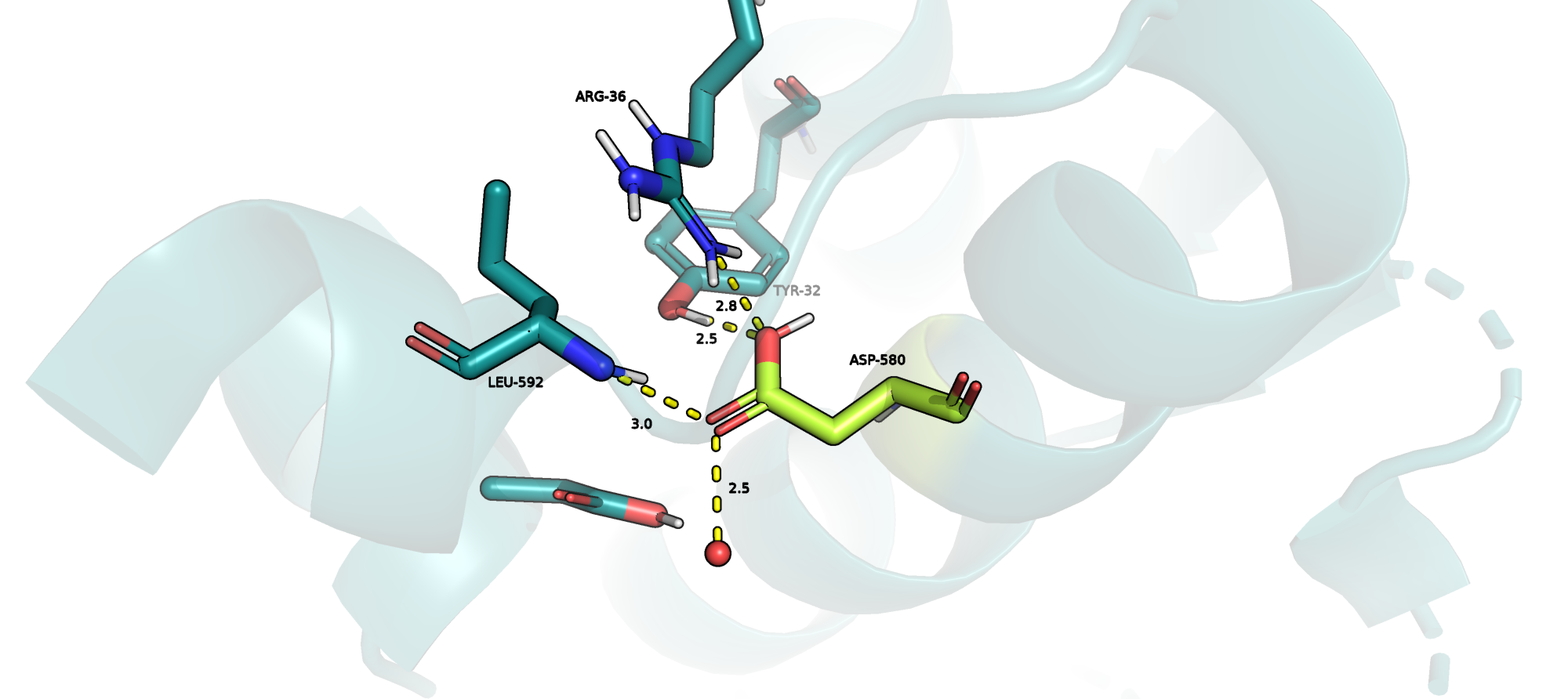
ASP-580
В данном случае также нельзя сказать однозначно, почему ASP-580 должен или не должен находиться в протонированной форме: он образует водородные связи с NH-группой остова LEU-592, с OH-группой TYR-32 и c ARG-36, однако выступает в роли донора. Более того, рядом с ним находится протонированный ARG-36, и потенциально он мог бы формировать солевой мостик с ним в депротонированной форме. Обширных гидрофобных карманов вокруг него я не обнаружила (см. Рис.5).
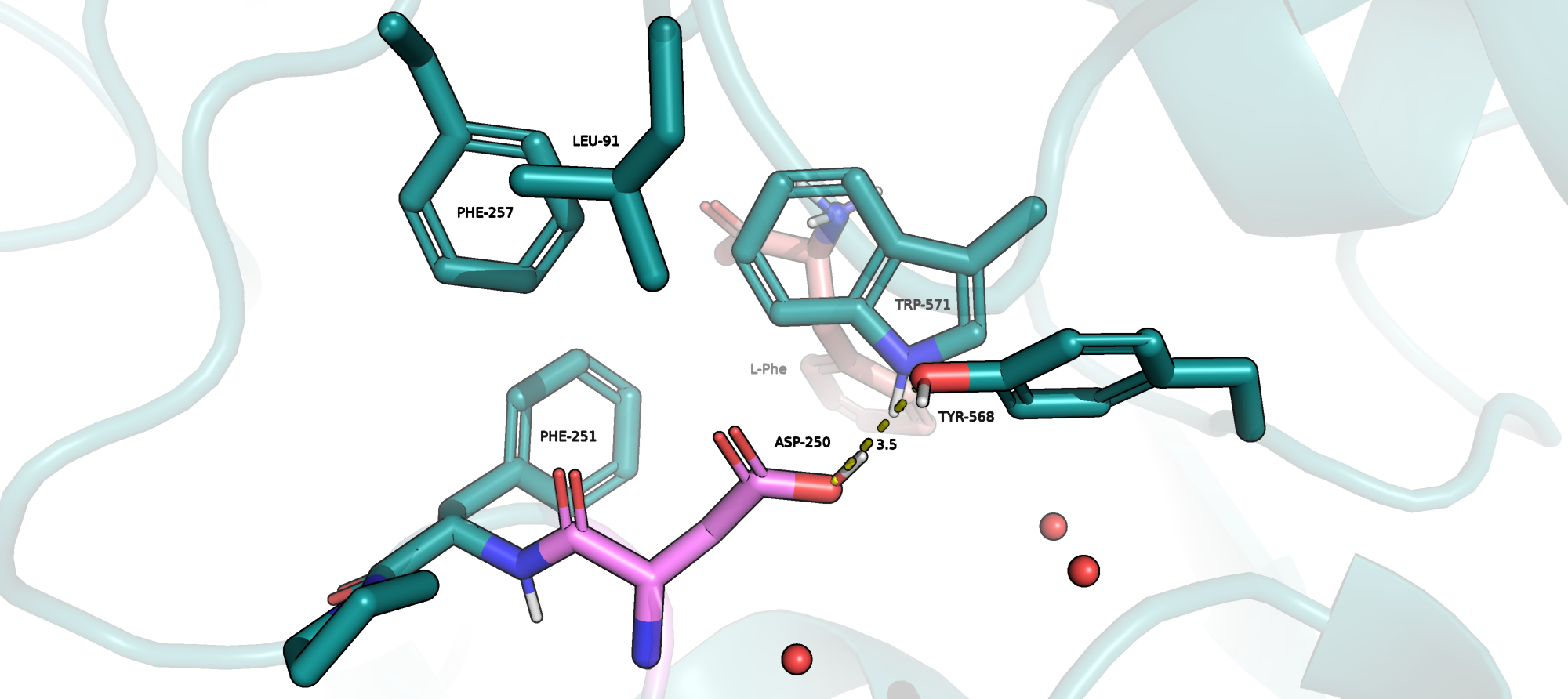
ASP-250
Рядом с этим остатком находится карман с ароматическими аминокислотами, поскольку он находится недалеко от субстрата (L-Tyr), могу предположить, что карман задействован в его связывании. Поэтому наличие протонированного аспартата имеет смысл, к тому же, данный остаток образует водородную связь с TYR-568 как акцептор, находясь в протонированной форме. Из всего этого могу заключить, что ASP-250 должен находиться в протонированной форме.
Скачать выдачу PDB2PQR, относящуюся к заданию можно здесь, PyMOL-сессию по ссылке.
Литература
- Nakano, S., Kozuka, K., Minamino, Y. et al. Ancestral L-amino acid oxidases for deracemization and stereoinversion of amino acids. Commun Chem 3, 181 (2020). https://doi.org/10.1038/s42004-020-00432-8
I don't know how to make footer properly. You may as well pretend you haven't seen this phrase!