РСА vs ЯМР
Задание 1
Мне было предложено работать со структурами 6M2C (РСА) и 6K2K (ЯМР), содержащими RING-домен белка MUL1. Разрешение структуры 2.70 Å. Структура, полученная методом РСА, также содержит белок UBE2D2. К слову, RING расшифровывается как Really Interesting New Gene!
В качестве водородной связи между элементами остова в альфа-спирали или бета-листе, я выбрала связь между N VAL-313 (акцептор) и O ILE-347 (донор) в бета-листе. В соответствующей ЯМР-структуре видим "на глаз", что эта водородная связь сохраняется во всех моделях и ее длина слабо варьируется (см рис.1).
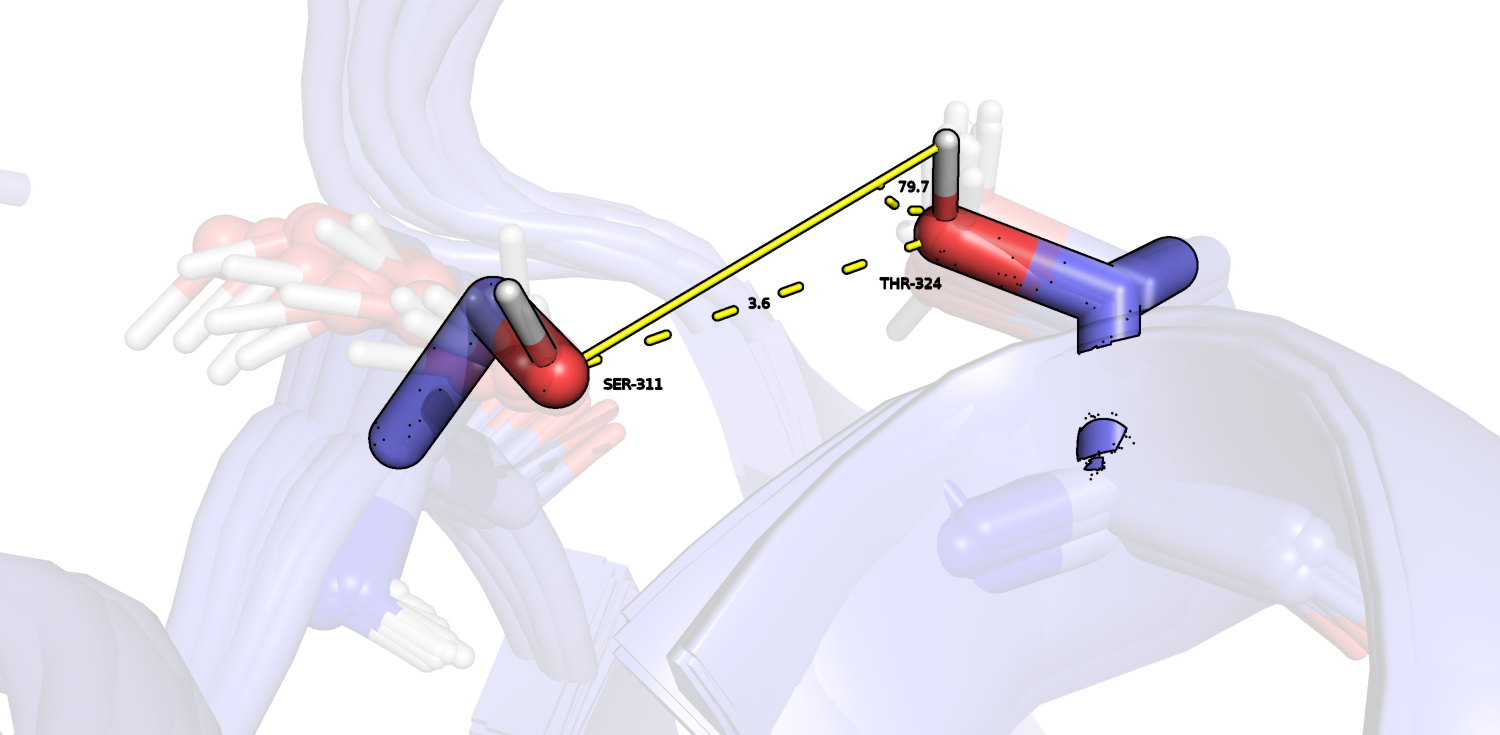
Для поиска связи между боковыми радикалами аминокислот в ядре белка был выполнен автоматический поиск полярных контактов в PyMOL между боковыми цепями. В результате была найдена одна ☺ предположительная водородная связь между OG SER-311 (акцептор) и OG1 THR-324 (донор). Она показана на Рис.2. При этом угол водородной связи составляет около 122°, что выходит за допустимые пределы, к тому же, эти остатки не сильно подвижны по сравнению с остальной структурой (см рис.3), но если смотреть на абсолютные значения, окажется, что "baseline" для B-факторра у структуры довольно высокий, в районе 30.
В ЯМР-моделях при этом водородной связи нет: превышается верхний порог на расстояние (минимальное - 3.56 Å) и неправильный угол водородной связи (к тому же, потенциальные участники меняются ролями (донор и акцептор) - см. рис.4).
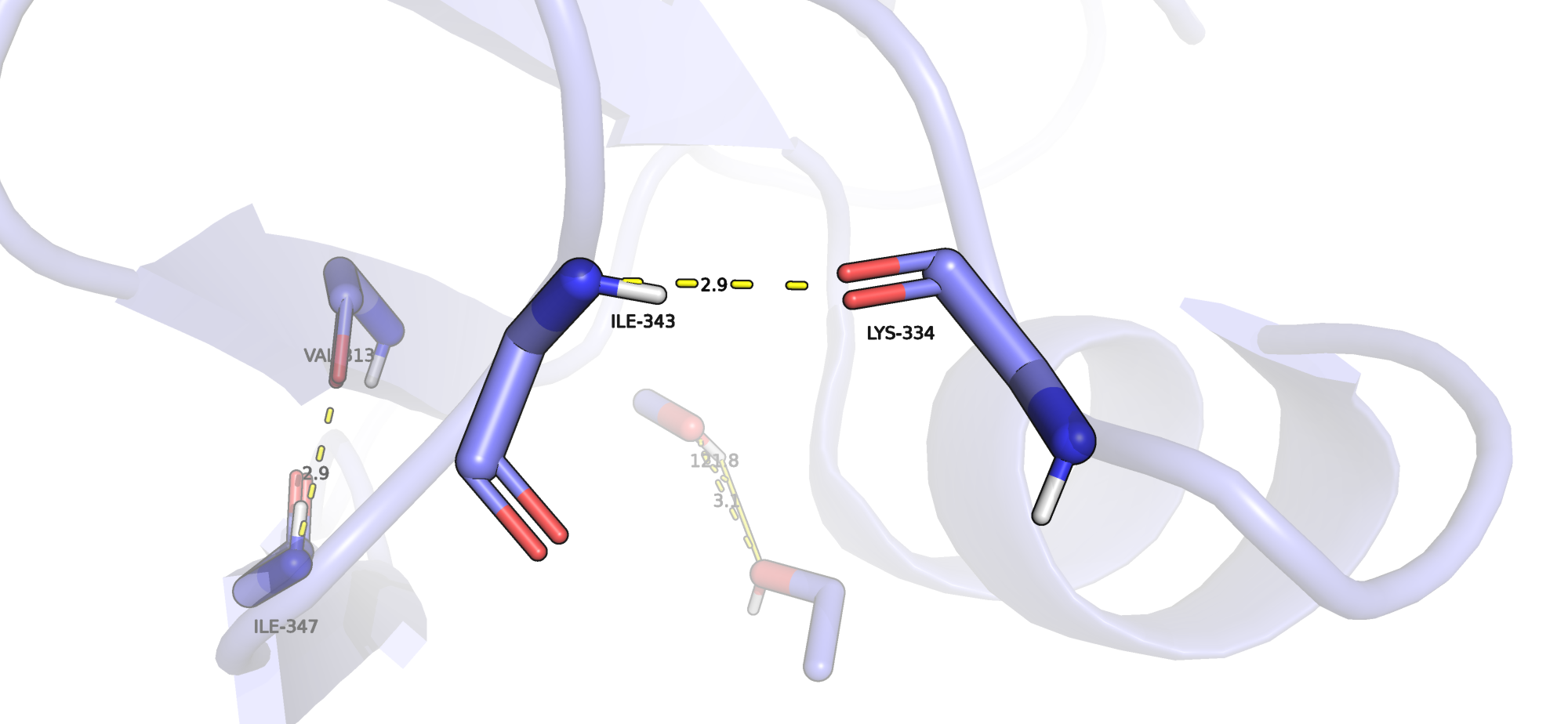
Поиск связи между атомами выходящих на поверхность петель глобулы также проводился с помощью средств PyMOL для обнаружения полярных контактов. Я выбрала связь между остовом двух петель, образуемую N ILE-343 (акцептор) и O LYS-334 (донор).
Результаты вышеприведенных измерений собраны в Таблице 1. Соответствующие PyMOL-сессии: РСА, ЯМР.
| Элемент вторичной структуры | Номера и тип остатков, образующих водородную связь | Расстояние в РСА | Среднее расстояние в ЯМР | % ЯМР-моделей, в которых есть водородная связь | Минимальное, медианное и максимальное расстояние в ЯМР-моделях |
| Бета слой (остов) | N VAL-313 (акцептор) и O ILE-347 (донор) | 2.9 Å | 2.82 Å (20 моделей) | 100 | 2.77 Å, 2.89 Å, 2.92 Å |
| Боковые цепи в ядре белка | OG SER-311 (акцептор) и OG1 THR-324 (донор) | 2.9 Å | 4.52 Å | 0 | 3.56 Å, 4.6 Å, 5.98 Å |
| Петли на поверхности глобулы (остов-остов) | N ILE-343 (акцептор) и O LYS-334 (донор) | 2.9 Å | 3.11 Å | 100 | 2.9 Å, 3.14 Å, 3.21 Å |
Задание 2
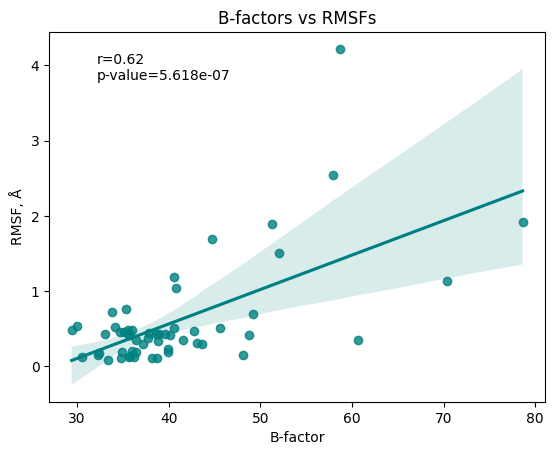
В данном задании будем рассматривать взаимосвязь RMSF (Root Mean Square Fluctuation) и B-факторов с помощью библиотеки ProDy. Поскольку в ассиметрической ячекйке имеется 4 рассматриваемых белка, значения B-факторов усредняются по ним. Также были удалены небелковые молекулы: вода и ионы, в остальном, помимо 2 дополнительных аминокислот на N-конце белка в ЯМР-структуре, белки совпали. Ниже приведены результаты для усредненного значения B-факторов по аминокислотному остатку и цепи. Видим, что наблюдается корреляция между значениями RMSF для ЯМР- структуры и усредненных B-факторов для структуры, полученной методом РСА (r=0.62, p-value << 0.05). Также стоит отметить, что большая часть значений концентрируется в левой нижней области графика, соответствующей низким значениями как B-фактора, так и RMSF, что соответствует меньшей подвижности как в полученной кристаллографическим методом структуре, так и в структуре, полученной методом ЯМР.
Заметим, что поскольку белок небольшой (55 аминокислот в РСА-модели и 57 в ЯМР-модели), то число точек, соответствующих высоким значениям RMSF и/или B-факторов, не достигает и десятка, что немного, поэтому к таким результатам стоит относится с осторожностью. Хотя взаимосвязь RMSF ЯМР-модели и B-факторов РСА-моделей наблюдается "в целом" и описывается линейным уравнением, с чем согласуются полученные в данном практикуме результаты. Последним замечанием будет то, что значения B-факторов для РСА-модели довольно высокие: ниже 30 (см. Рис.6) не имеется. Думаю, это, опять же, связано с небольшими размерами белка.
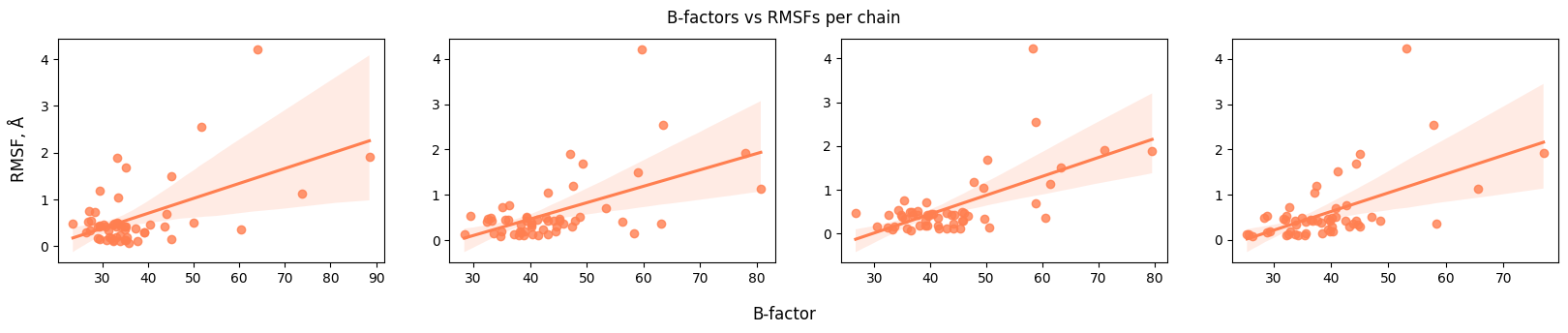
Также посмотрим на зависимости отдельно по цепям, а не усредненные. Мы ожидаем, что корреляция будет наблюдаться во всех четырех случаях. Это и правда так.
Также прикладываю ноутбук для этого этого и предыдущего задания.
I don't know how to make footer properly. You may as well pretend you haven't seen this phrase!