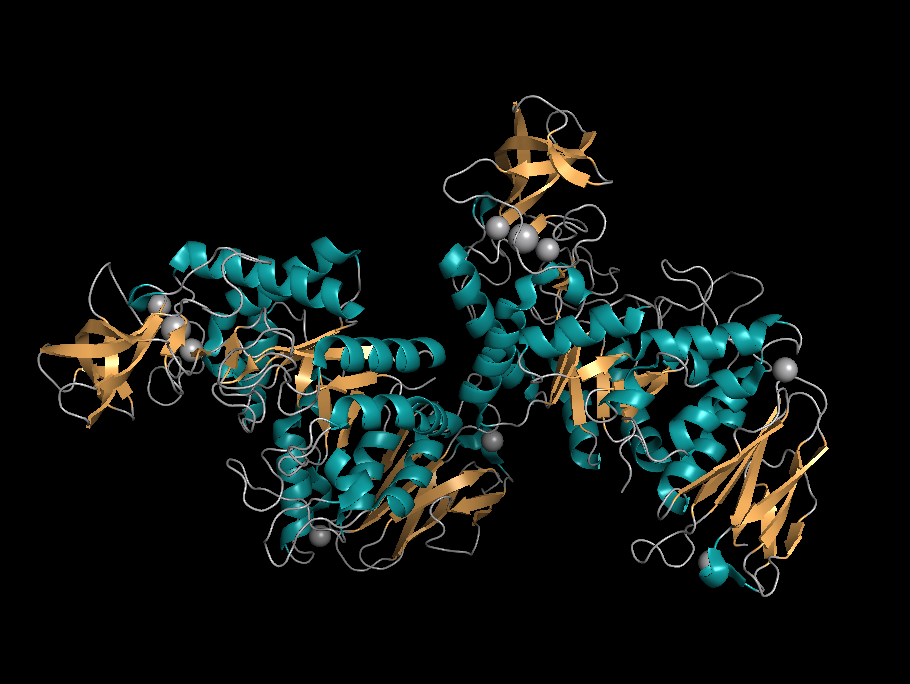
Выбрана структура белка альфа-амилазы Bacillus amyloliquefaciens, производящей эндогидролиз (1->4)-альфа-D-гликозидной связи в полисахаридах, содержащий три или более остатка, соединённых такими свзязями. Длина фермента - 483 аминокислотных остатков, теоретический вес - 54.9 KDa. Структура была получена для изучения температурной стабильности ферментов такого типа. Финальная структура содержит две молекулы белка, что авторы статьи рассматривают как артефакт кристаллизации, ионы кальция и натрия.

Изображение 1. 3bh4, α-спирали окрашены в голубо-зелёный цвет, β-листы в рыжий.
Окрашивание получено в PyMOL через установку цветов в меню Settings>Colors... и команды:
color helix, ss 'H'Где helix - название созданного цвета, ss 'H' - атомы спиралей (ss 'S' - бета-листов, not ss 'H' and not ss 'S' - всё остальное).
Для аннотации вторичной структуры использовался веб-сервис алгоритмы Stride, файл, содержащий его выдачу.
Таблица 1: выдача сервиса о альфа-спиралях находится справа, тогда как данные о вторичной структуре из PDB-файла - слева. Данные организованы в формате (тип вторичной структуры - остаток в начале струткуры - остаток в конце).
HELIX 1 1 GLN A 19 GLY A 35 1 17 HELIX 2 2 THR A 78 ARG A 92 1 15 HELIX 3 3 HIS A 155 TYR A 157 5 3 HELIX 4 4 HIS A 206 SER A 225 1 20 HELIX 5 5 ALA A 233 ILE A 237 5 5 HELIX 6 6 LYS A 238 GLY A 254 1 17 HELIX 7 7 ASN A 267 THR A 278 1 12 HELIX 8 8 ASP A 286 GLN A 299 1 14 HELIX 9 9 ASP A 304 LEU A 308 5 5 HELIX 10 10 THR A 312 HIS A 317 1 6 HELIX 11 11 PHE A 344 THR A 354 1 11 HELIX 12 12 TYR A 364 GLY A 369 1 6 HELIX 13 13 LEU A 381 TYR A 395 1 15 HELIX 14 14 GLY A 442 ALA A 446 5 5 HELIX 15 15 GLN B 19 GLY B 35 1 17 HELIX 16 16 THR B 78 ARG B 92 1 15 HELIX 17 17 HIS B 155 TYR B 157 5 3 HELIX 18 18 HIS B 206 SER B 225 1 20 HELIX 19 19 ALA B 233 ILE B 237 5 5 HELIX 20 20 LYS B 238 GLY B 254 1 17 HELIX 21 21 ASN B 267 THR B 278 1 12 HELIX 22 22 ASP B 286 GLN B 299 1 14 HELIX 23 23 ASP B 304 LEU B 308 5 5 HELIX 24 24 THR B 312 HIS B 317 1 6 HELIX 25 25 PHE B 344 THR B 354 1 11 HELIX 26 26 TYR B 364 GLY B 369 1 6 HELIX 27 27 LEU B 381 TYR B 395 1 15 HELIX 28 28 GLY B 442 ALA B 446 5 5 |
LOC AlphaHelix GLN 19 A ILE 34 A 3BH4 LOC AlphaHelix LYS 79 A ARG 92 A 3BH4 LOC AlphaHelix PRO 207 A LEU 224 A 3BH4 LOC AlphaHelix PHE 239 A THR 253 A 3BH4 LOC AlphaHelix ALA 268 A THR 278 A 3BH4 LOC AlphaHelix VAL 287 A SER 298 A 3BH4 LOC AlphaHelix LYS 345 A THR 354 A 3BH4 LOC AlphaHelix TYR 364 A TYR 368 A 3BH4 LOC AlphaHelix LEU 381 A TYR 395 A 3BH4 LOC AlphaHelix GLN 19 B ILE 34 B 3BH4 LOC AlphaHelix LYS 79 B ARG 92 B 3BH4 LOC AlphaHelix PRO 207 B LEU 224 B 3BH4 LOC AlphaHelix PHE 239 B THR 253 B 3BH4 LOC AlphaHelix ALA 268 B THR 278 B 3BH4 LOC AlphaHelix VAL 287 B SER 298 B 3BH4 LOC AlphaHelix VAL 313 B ARG 316 B 3BH4 LOC AlphaHelix LYS 345 B THR 354 B 3BH4 LOC AlphaHelix TYR 364 B TYR 368 B 3BH4 LOC AlphaHelix LEU 381 B TYR 395 B 3BH4 |
Цепь А:
Цепь B содержит тот же белок, что и цепь А, их разметка вторичной структуры в PDB-файле совпадает, Stride находит в цепи B на одну спираль больше, у спирали карйне подозрительный размер - 4 осттака.
Таблица 2: выдача сервиса о бета-листах находится справа, тогда как данные о вторичной структуре из PDB-файла - слева (данные организованы: номер цепи в листе - идентификатор листа - ифнормация о начальном остатке - информация о конечном остатке - +/- цепь относительно предыдущих - информация о атомах текущей и предыдущей цепей, образующих водородную связь (кроме первой цепи)).
SHEET 1 A 9 LEU A 6 GLN A 8 0 SHEET 2 A 9 ALA A 38 ILE A 41 1 O TRP A 40 N MET A 7 SHEET 3 A 9 GLN A 95 VAL A 100 1 O TYR A 97 N VAL A 39 SHEET 4 A 9 GLY A 228 ILE A 231 1 O ARG A 230 N VAL A 100 SHEET 5 A 9 PHE A 258 ALA A 261 1 O VAL A 260 N ILE A 231 SHEET 6 A 9 SER A 283 PHE A 285 1 O SER A 283 N ALA A 261 SHEET 7 A 9 ALA A 321 PHE A 324 1 O VAL A 322 N VAL A 284 SHEET 8 A 9 TYR A 359 PHE A 363 1 O TYR A 359 N ALA A 321 SHEET 9 A 9 LEU A 6 GLN A 8 1 N LEU A 6 O VAL A 362 SHEET 1 B 2 LYS A 46 GLY A 47 0 SHEET 2 B 2 PRO A 57 ASP A 59 -1 O TYR A 58 N LYS A 46 SHEET 1 C 6 HIS A 104 LYS A 105 0 SHEET 2 C 6 ALA A 200 VAL A 202 -1 O ALA A 200 N LYS A 105 SHEET 3 C 6 PHE A 159 ASP A 165 -1 N ASP A 160 O ASP A 201 SHEET 4 C 6 ILE A 170 PHE A 176 -1 O PHE A 174 N ALA A 162 SHEET 5 C 6 ALA A 110 ASN A 120 -1 N VAL A 117 O LYS A 175 SHEET 6 C 6 ASN A 123 GLU A 127 -1 O GLN A 126 N ASN A 120 SHEET 1 D 6 HIS A 104 LYS A 105 0 SHEET 2 D 6 ALA A 200 VAL A 202 -1 O ALA A 200 N LYS A 105 SHEET 3 D 6 PHE A 159 ASP A 165 -1 N ASP A 160 O ASP A 201 SHEET 4 D 6 ILE A 170 PHE A 176 -1 O PHE A 174 N ALA A 162 SHEET 5 D 6 ALA A 110 ASN A 120 -1 N VAL A 117 O LYS A 175 SHEET 6 D 6 TYR A 132 ASP A 139 -1 O ILE A 134 N VAL A 114 SHEET 1 E 6 GLN A 400 TYR A 403 0 SHEET 2 E 6 VAL A 409 ARG A 414 -1 O GLY A 411 N TYR A 403 SHEET 3 E 6 LEU A 425 THR A 430 -1 O ALA A 427 N TRP A 412 SHEET 4 E 6 VAL A 478 GLN A 483 -1 O TYR A 481 N ALA A 426 SHEET 5 E 6 THR A 449 ASP A 452 -1 N TYR A 451 O VAL A 482 SHEET 6 E 6 THR A 460 LYS A 462 -1 O VAL A 461 N TRP A 450 SHEET 1 F 2 GLY A 435 TYR A 440 0 SHEET 2 F 2 TRP A 468 VAL A 473 -1 O PHE A 471 N LYS A 437 SHEET 1 G 9 LEU B 6 GLN B 8 0 SHEET 2 G 9 ALA B 38 ILE B 41 1 O TRP B 40 N MET B 7 SHEET 3 G 9 GLN B 95 VAL B 100 1 O TYR B 97 N VAL B 39 SHEET 4 G 9 GLY B 228 ILE B 231 1 O ARG B 230 N VAL B 100 SHEET 5 G 9 PHE B 258 ALA B 261 1 O VAL B 260 N ILE B 231 SHEET 6 G 9 SER B 283 PHE B 285 1 O SER B 283 N THR B 259 SHEET 7 G 9 ALA B 321 PHE B 324 1 O VAL B 322 N VAL B 284 SHEET 8 G 9 TYR B 359 PHE B 363 1 O TYR B 359 N ALA B 321 SHEET 9 G 9 LEU B 6 GLN B 8 1 N LEU B 6 O VAL B 362 SHEET 1 H 2 LYS B 46 GLY B 47 0 SHEET 2 H 2 PRO B 57 ASP B 59 -1 O TYR B 58 N LYS B 46 SHEET 1 I 6 HIS B 104 LYS B 105 0 SHEET 2 I 6 ALA B 200 VAL B 202 -1 O ALA B 200 N LYS B 105 SHEET 3 I 6 PHE B 159 ASP B 165 -1 N ASP B 160 O ASP B 201 SHEET 4 I 6 ILE B 170 PHE B 176 -1 O PHE B 174 N ALA B 162 SHEET 5 I 6 ALA B 110 ASN B 120 -1 N VAL B 117 O LYS B 175 SHEET 6 I 6 ASN B 123 GLU B 127 -1 O GLN B 126 N ASN B 120 SHEET 1 J 6 HIS B 104 LYS B 105 0 SHEET 2 J 6 ALA B 200 VAL B 202 -1 O ALA B 200 N LYS B 105 SHEET 3 J 6 PHE B 159 ASP B 165 -1 N ASP B 160 O ASP B 201 SHEET 4 J 6 ILE B 170 PHE B 176 -1 O PHE B 174 N ALA B 162 SHEET 5 J 6 ALA B 110 ASN B 120 -1 N VAL B 117 O LYS B 175 SHEET 6 J 6 TYR B 132 ASP B 139 -1 O ILE B 134 N VAL B 114 SHEET 1 K 6 GLN B 400 TYR B 403 0 SHEET 2 K 6 VAL B 409 ARG B 414 -1 O GLY B 411 N TYR B 403 SHEET 3 K 6 LEU B 425 THR B 430 -1 O ALA B 427 N TRP B 412 SHEET 4 K 6 VAL B 478 GLN B 483 -1 O TYR B 481 N ALA B 426 SHEET 5 K 6 THR B 449 ASP B 452 -1 N TYR B 451 O VAL B 482 SHEET 6 K 6 VAL B 461 LYS B 462 -1 O VAL B 461 N TRP B 450 SHEET 1 L 2 GLY B 435 TYR B 440 0 SHEET 2 L 2 TRP B 468 VAL B 473 -1 O PHE B 471 N LYS B 437 |
LOC Strand LEU 6 A GLN 8 A 3BH4 LOC Strand ALA 38 A ILE 41 A 3BH4 LOC Strand LYS 46 A GLY 47 A 3BH4 LOC Strand PRO 57 A ASP 59 A 3BH4 LOC Strand GLN 95 A VAL 100 A 3BH4 LOC Strand HIS 104 A LYS 105 A 3BH4 LOC Strand ALA 110 A GLU 118 A 3BH4 LOC Strand TYR 132 A ASP 139 A 3BH4 LOC Strand PHE 159 A ASP 165 A 3BH4 LOC Strand ILE 170 A PHE 176 A 3BH4 LOC Strand ALA 200 A VAL 202 A 3BH4 LOC Strand GLY 228 A ILE 231 A 3BH4 LOC Strand PHE 258 A ALA 261 A 3BH4 LOC Strand SER 283 A PHE 285 A 3BH4 LOC Strand ALA 321 A PHE 324 A 3BH4 LOC Strand TYR 359 A PHE 363 A 3BH4 LOC Strand GLN 400 A TYR 403 A 3BH4 LOC Strand VAL 409 A ARG 414 A 3BH4 LOC Strand LEU 425 A THR 430 A 3BH4 LOC Strand GLY 435 A TYR 440 A 3BH4 LOC Strand GLU 448 A ASP 452 A 3BH4 LOC Strand THR 460 A ILE 463 A 3BH4 LOC Strand TRP 468 A VAL 473 A 3BH4 LOC Strand VAL 478 A GLN 483 A 3BH4 LOC Strand LEU 6 B GLN 8 B 3BH4 LOC Strand ALA 38 B ILE 41 B 3BH4 LOC Strand LYS 46 B GLY 47 B 3BH4 LOC Strand PRO 57 B ASP 59 B 3BH4 LOC Strand GLN 95 B VAL 100 B 3BH4 LOC Strand HIS 104 B LYS 105 B 3BH4 LOC Strand ALA 110 B VAL 119 B 3BH4 LOC Strand GLU 127 B ASP 139 B 3BH4 LOC Strand PHE 159 B ASP 165 B 3BH4 LOC Strand ILE 170 B PHE 176 B 3BH4 LOC Strand ALA 200 B VAL 202 B 3BH4 LOC Strand GLY 228 B ILE 231 B 3BH4 LOC Strand PHE 258 B ALA 261 B 3BH4 LOC Strand SER 283 B PHE 285 B 3BH4 LOC Strand ALA 321 B PHE 324 B 3BH4 LOC Strand TYR 359 B PHE 363 B 3BH4 LOC Strand GLN 400 B TYR 403 B 3BH4 LOC Strand VAL 409 B ARG 414 B 3BH4 LOC Strand LEU 425 B THR 430 B 3BH4 LOC Strand GLY 435 B TYR 440 B 3BH4 LOC Strand GLU 448 B ASP 452 B 3BH4 LOC Strand VAL 461 B ILE 463 B 3BH4 LOC Strand TRP 468 B VAL 473 B 3BH4 LOC Strand VAL 478 B GLN 483 B 3BH4 |
Цепь А:
Таблица 3: оставлены только уникальные тяжи для PDB-аннотации.
SHEET 1 A 9 LEU A 6 GLN A 8 0 SHEET 2 A 9 ALA A 38 ILE A 41 1 O TRP A 40 N MET A 7 SHEET 3 A 9 GLN A 95 VAL A 100 1 O TYR A 97 N VAL A 39 SHEET 4 A 9 GLY A 228 ILE A 231 1 O ARG A 230 N VAL A 100 SHEET 5 A 9 PHE A 258 ALA A 261 1 O VAL A 260 N ILE A 231 SHEET 6 A 9 SER A 283 PHE A 285 1 O SER A 283 N ALA A 261 SHEET 7 A 9 ALA A 321 PHE A 324 1 O VAL A 322 N VAL A 284 SHEET 8 A 9 TYR A 359 PHE A 363 1 O TYR A 359 N ALA A 321 SHEET 1 B 2 LYS A 46 GLY A 47 0 SHEET 2 B 2 PRO A 57 ASP A 59 -1 O TYR A 58 N LYS A 46 SHEET 1 C 6 HIS A 104 LYS A 105 0 SHEET 2 C 6 ALA A 200 VAL A 202 -1 O ALA A 200 N LYS A 105 SHEET 3 C 6 PHE A 159 ASP A 165 -1 N ASP A 160 O ASP A 201 SHEET 4 C 6 ILE A 170 PHE A 176 -1 O PHE A 174 N ALA A 162 SHEET 5 C 6 ALA A 110 ASN A 120 -1 N VAL A 117 O LYS A 175 SHEET 6 C 6 ASN A 123 GLU A 127 -1 O GLN A 126 N ASN A 120 SHEET 6 D 6 TYR A 132 ASP A 139 -1 O ILE A 134 N VAL A 114 SHEET 1 E 6 GLN A 400 TYR A 403 0 SHEET 2 E 6 VAL A 409 ARG A 414 -1 O GLY A 411 N TYR A 403 SHEET 3 E 6 LEU A 425 THR A 430 -1 O ALA A 427 N TRP A 412 SHEET 4 E 6 VAL A 478 GLN A 483 -1 O TYR A 481 N ALA A 426 SHEET 5 E 6 THR A 449 ASP A 452 -1 N TYR A 451 O VAL A 482 SHEET 6 E 6 THR A 460 LYS A 462 -1 O VAL A 461 N TRP A 450 SHEET 1 F 2 GLY A 435 TYR A 440 0 SHEET 2 F 2 TRP A 468 VAL A 473 -1 O PHE A 471 N LYS A 437 SHEET 1 G 9 LEU B 6 GLN B 8 0 SHEET 2 G 9 ALA B 38 ILE B 41 1 O TRP B 40 N MET B 7 SHEET 3 G 9 GLN B 95 VAL B 100 1 O TYR B 97 N VAL B 39 SHEET 4 G 9 GLY B 228 ILE B 231 1 O ARG B 230 N VAL B 100 SHEET 5 G 9 PHE B 258 ALA B 261 1 O VAL B 260 N ILE B 231 SHEET 6 G 9 SER B 283 PHE B 285 1 O SER B 283 N THR B 259 SHEET 7 G 9 ALA B 321 PHE B 324 1 O VAL B 322 N VAL B 284 SHEET 8 G 9 TYR B 359 PHE B 363 1 O TYR B 359 N ALA B 321 SHEET 1 H 2 LYS B 46 GLY B 47 0 SHEET 2 H 2 PRO B 57 ASP B 59 -1 O TYR B 58 N LYS B 46 SHEET 1 I 6 HIS B 104 LYS B 105 0 SHEET 2 I 6 ALA B 200 VAL B 202 -1 O ALA B 200 N LYS B 105 SHEET 3 I 6 PHE B 159 ASP B 165 -1 N ASP B 160 O ASP B 201 SHEET 4 I 6 ILE B 170 PHE B 176 -1 O PHE B 174 N ALA B 162 SHEET 5 I 6 ALA B 110 ASN B 120 -1 N VAL B 117 O LYS B 175 SHEET 6 I 6 ASN B 123 GLU B 127 -1 O GLN B 126 N ASN B 120 SHEET 6 J 6 TYR B 132 ASP B 139 -1 O ILE B 134 N VAL B 114 SHEET 1 K 6 GLN B 400 TYR B 403 0 SHEET 2 K 6 VAL B 409 ARG B 414 -1 O GLY B 411 N TYR B 403 SHEET 3 K 6 LEU B 425 THR B 430 -1 O ALA B 427 N TRP B 412 SHEET 4 K 6 VAL B 478 GLN B 483 -1 O TYR B 481 N ALA B 426 SHEET 5 K 6 THR B 449 ASP B 452 -1 N TYR B 451 O VAL B 482 SHEET 6 K 6 VAL B 461 LYS B 462 -1 O VAL B 461 N TRP B 450 SHEET 1 L 2 GLY B 435 TYR B 440 0 SHEET 2 L 2 TRP B 468 VAL B 473 -1 O PHE B 471 N LYS B 437 |
LOC Strand LEU 6 A GLN 8 A 3BH4 LOC Strand ALA 38 A ILE 41 A 3BH4 LOC Strand LYS 46 A GLY 47 A 3BH4 LOC Strand PRO 57 A ASP 59 A 3BH4 LOC Strand GLN 95 A VAL 100 A 3BH4 LOC Strand HIS 104 A LYS 105 A 3BH4 LOC Strand ALA 110 A GLU 118 A 3BH4 LOC Strand TYR 132 A ASP 139 A 3BH4 LOC Strand PHE 159 A ASP 165 A 3BH4 LOC Strand ILE 170 A PHE 176 A 3BH4 LOC Strand ALA 200 A VAL 202 A 3BH4 LOC Strand GLY 228 A ILE 231 A 3BH4 LOC Strand PHE 258 A ALA 261 A 3BH4 LOC Strand SER 283 A PHE 285 A 3BH4 LOC Strand ALA 321 A PHE 324 A 3BH4 LOC Strand TYR 359 A PHE 363 A 3BH4 LOC Strand GLN 400 A TYR 403 A 3BH4 LOC Strand VAL 409 A ARG 414 A 3BH4 LOC Strand LEU 425 A THR 430 A 3BH4 LOC Strand GLY 435 A TYR 440 A 3BH4 LOC Strand GLU 448 A ASP 452 A 3BH4 LOC Strand THR 460 A ILE 463 A 3BH4 LOC Strand TRP 468 A VAL 473 A 3BH4 LOC Strand VAL 478 A GLN 483 A 3BH4 LOC Strand LEU 6 B GLN 8 B 3BH4 LOC Strand ALA 38 B ILE 41 B 3BH4 LOC Strand LYS 46 B GLY 47 B 3BH4 LOC Strand PRO 57 B ASP 59 B 3BH4 LOC Strand GLN 95 B VAL 100 B 3BH4 LOC Strand HIS 104 B LYS 105 B 3BH4 LOC Strand ALA 110 B VAL 119 B 3BH4 LOC Strand GLU 127 B ASP 139 B 3BH4 LOC Strand PHE 159 B ASP 165 B 3BH4 LOC Strand ILE 170 B PHE 176 B 3BH4 LOC Strand ALA 200 B VAL 202 B 3BH4 LOC Strand GLY 228 B ILE 231 B 3BH4 LOC Strand PHE 258 B ALA 261 B 3BH4 LOC Strand SER 283 B PHE 285 B 3BH4 LOC Strand ALA 321 B PHE 324 B 3BH4 LOC Strand TYR 359 B PHE 363 B 3BH4 LOC Strand GLN 400 B TYR 403 B 3BH4 LOC Strand VAL 409 B ARG 414 B 3BH4 LOC Strand LEU 425 B THR 430 B 3BH4 LOC Strand GLY 435 B TYR 440 B 3BH4 LOC Strand GLU 448 B ASP 452 B 3BH4 LOC Strand VAL 461 B ILE 463 B 3BH4 LOC Strand TRP 468 B VAL 473 B 3BH4 LOC Strand VAL 478 B GLN 483 B 3BH4 |
Разметка цепи B в PDB-файле аналогична цепи А. Stride имеет в цепи B три тяжа, отличающихся по составу остатков от тяжей в цепи А, - тяж:110-118 в цепи A соответсвует тяжу: 110-119 в цепи B, тяж 132-139 в цепи A соответствует тяжу:127-139 в цепи B, тяж:460-463 в цепи A соотвутствует тяжу:461-463 цепи B.