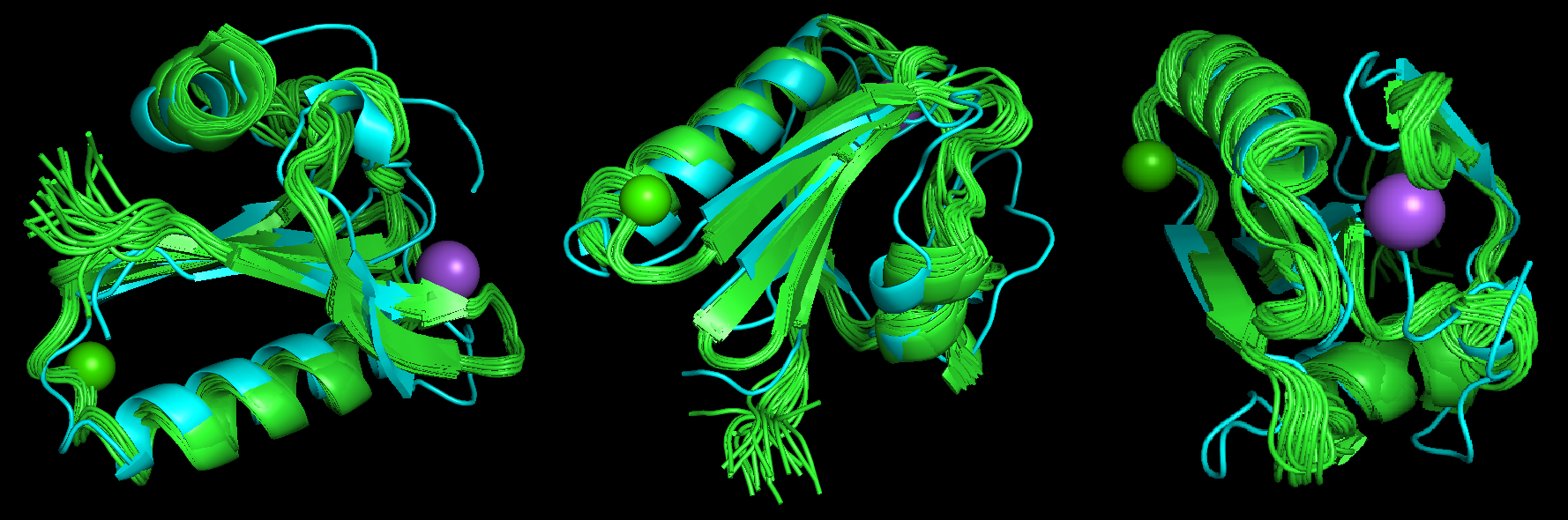
Для сравнения я выбрал белок северин, выделенный из Dictyostelium discoideum (какой-то клеточный слизевик). Это небольшой актин-связывающий белок.
1SVQ - структура, расшифрованная с помощью ЯМР (20 конформаций)
1SVY - структура, расшифрованная с помощью РСА (разрешение 1.75 ангстем)
С помощью следующих команд проверим, насколько совпадают структуры ЯМР и РСА:
load 1svq.pdb, nmr зеленый цвет
load 1svy.pdb, rsa голубой цвет
align rsa, nmr
split_states nmr
set cartoon_transparency, 0.6, nmr
remove resn hoh

Структура РСА содержит ионы металлов в качестве лигандов, которые я решил не удалять.
Видно, что элементы вторичной струкруры (альфа-спирали и бета-листы) совпадают, а находящиеся между ними петли и концы укладываются по разному. Можно сделать вывод о сходности структур и тсутствии ошибок при их расшифровке.
Критерий водородной связи - 3.5 ангстрем (или меньше) между донором и акцептором протона.
Визуализация контактов только между полярными атомами N и O:
load 1svy.pdb, 1svy
distance hbond, name N*, name O*, 3.5, mode=2
show sticks, 1svy
set cartoon_transparency, 0.6, 1svy
set stick_radius, 0.1
Так видно все водородные связи между атомами. Нужно отобрать и визуализировать следующие аминокислоты:
Пример кода для визуализации связи на поверхности белка:
select ak1, resn ala+lys and resi 215+211 выделенные аминокислотные остатки окрашены в красный
select akeeper, not ak1
set stick_radius, 0.03, akeeper
select alf, resi 208-224 окрасим всю альфа-спираль в белый цвет
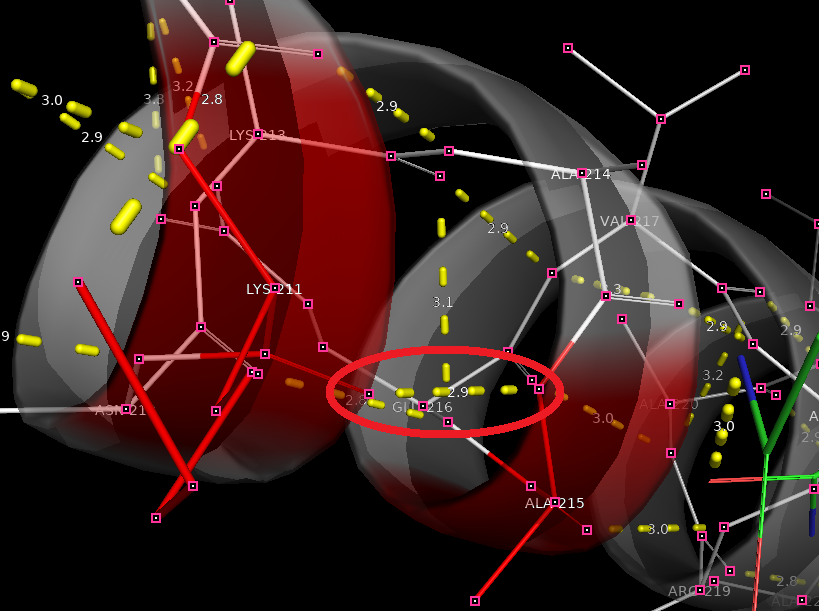
Находящаяся в альфа-спирали водородная связь между Lys211 и Ala215. Обведена красным цветом.
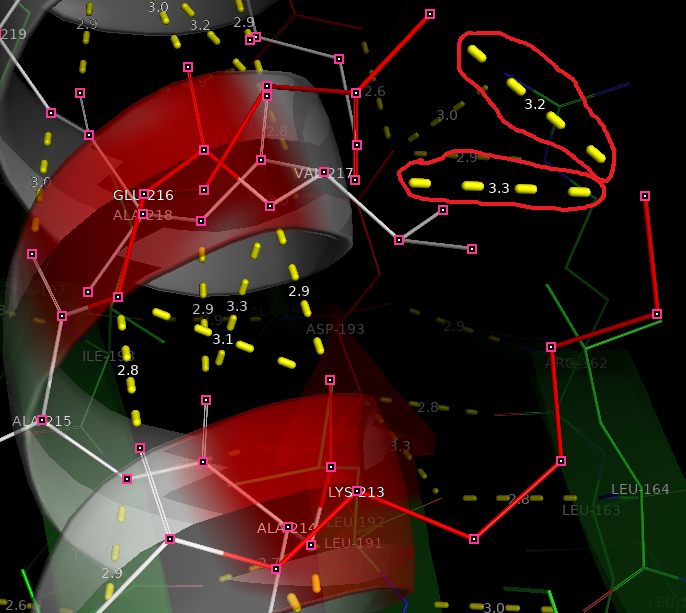
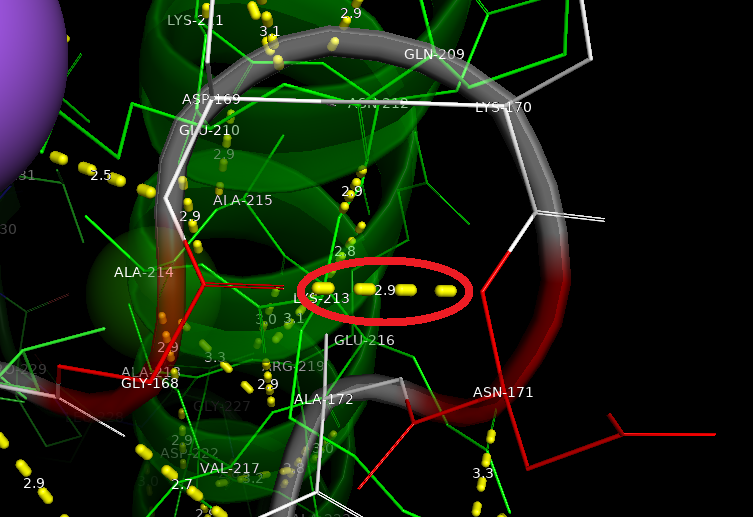
Боковые водородные связи в ядре (та же альфа-спираль) между Lys213 и Glu216. Боковая водородная связь в петле (белая) на поверхности глобулы между Gly168 и Asn171.
| Расположение водородной связи | Аминокислоты | Расстояние в РСА (Å) | Число моделей ЯМР с этой связью | Расстояние в ЯМР (Å) | ||
|---|---|---|---|---|---|---|
| Минимальное | Максимальное | Медианное | ||||
| Остовная альфа-спирали | Ala 215 и Lys 211 | 2.9 | 4/20 | 2.1 | 3.1 | 3.0 |
| Боковые группы в ядре | Glu 216 и Lys 213 | 3.2 и 3.3 | 19/20 | 2.8 и 2.9 | 3.4 и 3.5 | 3.1 и 3.2 |
| Петля на поверхности | Gly 168 и Asn 171 | 2.9 | 11/20 | 2.4 | 3.3 | 2.8 |
Водородная связь присутствует не во всех конформациях белка. Довольно странно то, что часто они не обнаруживаются в таком стабильном элементе, как альфа-спираль. Так же в гибкой петле они обнаруживаются довольно часто.
Наблюдаемое различие в пространственном расположении остатков - следствие неоднозначного восстановления укладки структуры методом ЯМР. Это объясняется тем, что белок в растворе подвижен и ЯМР фиксирует вариабельность его отдельных участков.
© Борисов Евгений 2018