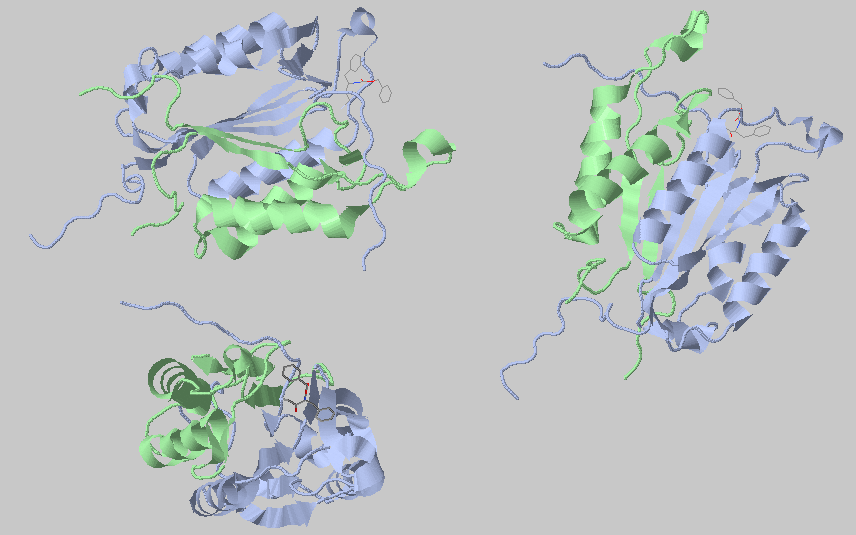
Для работы я выбрал каспазу-3 (PDB 2xyp). Анализ проводится при помощи сервера Clud.

Первый запуск - по умолчанию, параметр порогового расстояния составляет 5.4 Å
Белок состоит из двух цепей (либопытно, что они связаны в районе общей бета-структуры, я такого раньше не видел), которые выделены в гидрофодные ядра. Другие выделенные кластеры значительно меньше, я отобразил те из них, в которые входит больше 5 атомов. Некоторые из них не связаны со спиралями и бета-листами (красный, голубой, бардовый), поэтому могут считаться ошибкой.
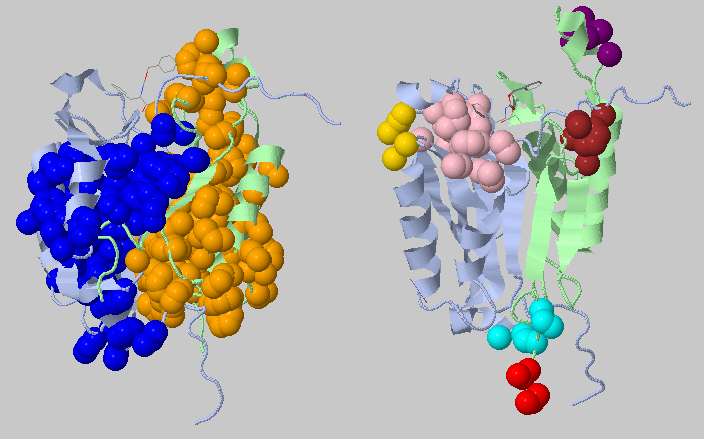
Второй запуск - параметр порогового расстояния составляет 4.4 Å
Картина изменилась, но многие ядна по прежнему кажутся мне ошибочными, так как расположены на тяжах и экспонировыны в окружающую среду.
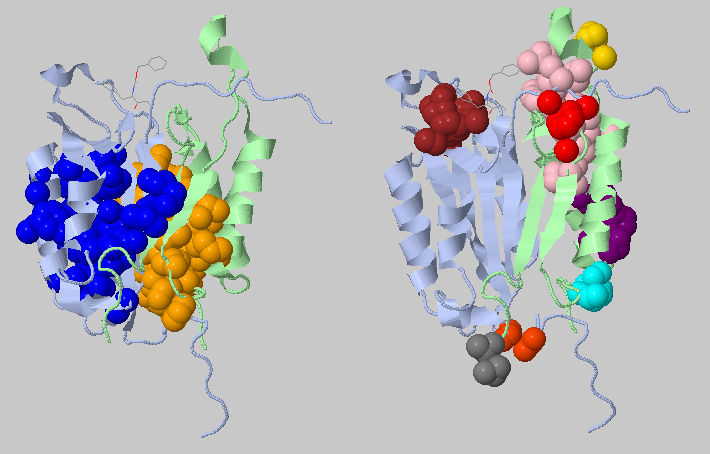
Третий запуск - параметр порогового расстояния составляет 4.0 Å
Стало совсем хорошо - исчезли крупные кластеры на всю цепь, ложные ядра так же не наблюдаются.
Попытки понизить или повысить пороговое расстояние только ухудшают получившуюся картину - ядер становится или слишком мало, или появляются неоправданно крупные ядра на половину белка.
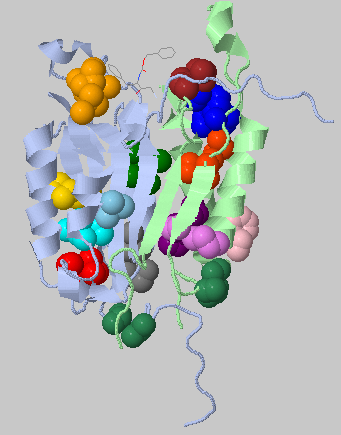
Каспаза-3 имеет сайт связывания с лигандом (PHENYLMETHYL N-[(2S)-4-CHLORO-3-OXO-1-PHENYL-BUTAN-2-YL]CARBAMATE), интересно посмотреть на него отдельно.
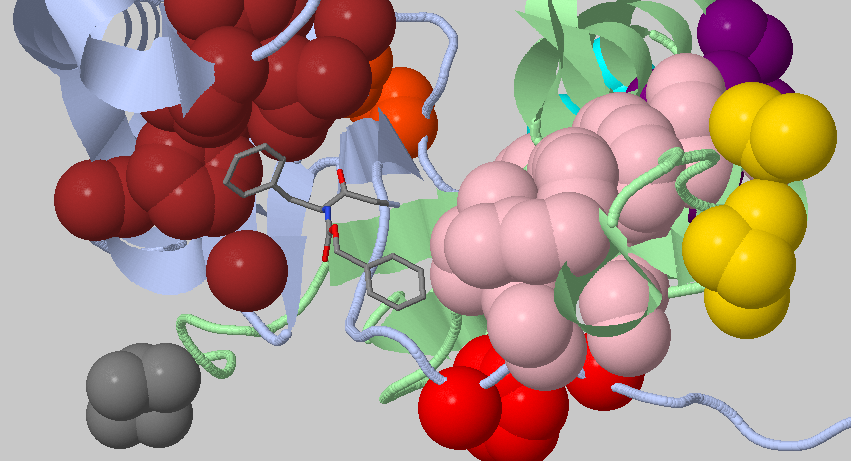
Хорошо видно, что этот лиганд окружен двумя гидрофобными кластерами (по одному на каждой цепи)
Для участия в апоптозе два гетеродимера ассоциируются с образованием тетрамера, имеющего два каталитических участка, которые, по-видимому, действуют независимо. Именно в таком активном центре и находится лиганд.
Для демонстрации гидрофобных кластеров между контактирующими белковыми цепями я выбрал инсулин (PDB 2omg).
Сам по себе инсулин - небольшой белок, но для выполнения своих функций его молекулы ассоциируются в гексамер вокруг иона цинка (который удерживается остатками гистидина). Мне было интересно посмотреть, есть ли между отдельными инсулинами какие-либо гидрофобные взаимодействия, иными словами, участвуют ли они с сборке и поддержании этого комплекса.
Для запуска программы я использовал параметр порогового расстояния составляет 4.0 Å.
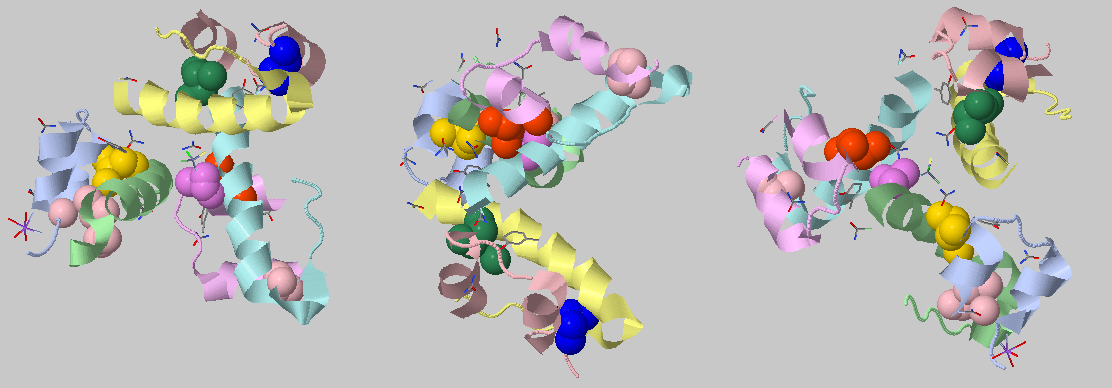
Программа нашла множество гидрофобных кластеров, хотя и небольших (не больше 9 атомов), но инсулин сам по себе не велик. Я отобразил те из них, которые находятся между цепями разных молекул. Можно сделать вывод, что гидрофобные взаимодействия играют определенную роль в поддержании стабильности этого комплекса.
Лирическое отступление для тех, кому интересно: гексомерный комплекс не имеет биологической активности и, вполне возможно, даже биологического смысла (вроде повышенной стабильности мономеров для транспортировки по кровотоку) в нем нет. На рецепторы влияют отдельные молекулы, а в форме комплекса инсулин присутствует под кожей после введения в организм в виде инъекции, постепенно распадаясь.
© Борисов Евгений 2018