Практикум 4
Сравнения водородных связей в структуре белка, полученной с помощью РСА и с помощью ЯМР.
Для сравнения был выбран человеческий гемоглобин.Идентификатор PDB РСА: 3MKF
Идентификатор PDB ЯМР: 2H35
Разрешение структуры РСА: 2 ангстрема
На рисунке 1 изображена остовная водородная связь в ядре белка между O-атомом 96 валина цепи A и N-атомом 99 лизина цепи А. Оба остатка находятся в альфа-спирали; на рисунке 2 - водородная связь в ядре белка между ND2-атомом боковой цепи 497 аспарагина цепи E и OD1-атомом боковой цепи 299 аспартата цепи C, аспарагин находится в альфа-спирали, а аспартат - в петле; на рисунке 3 - водородная связь на поверхности белка между OG-атомом 49 серина цепи A, находящегося в петле и OD2-атомом 47 аспартата, также находящегося в петле.
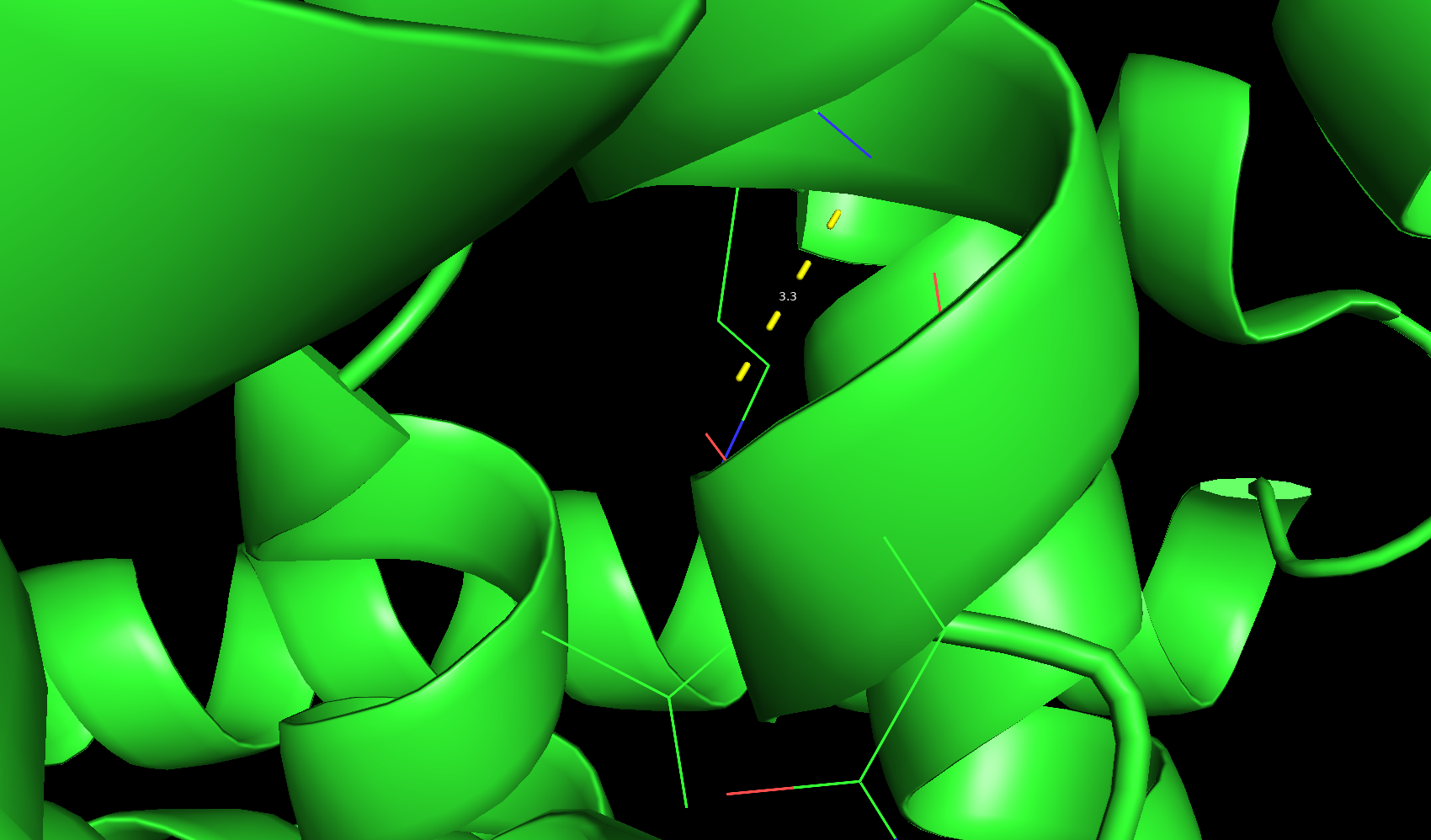
Рис. 1. Водородная связь между атомами остова в ядре белка по РСА.
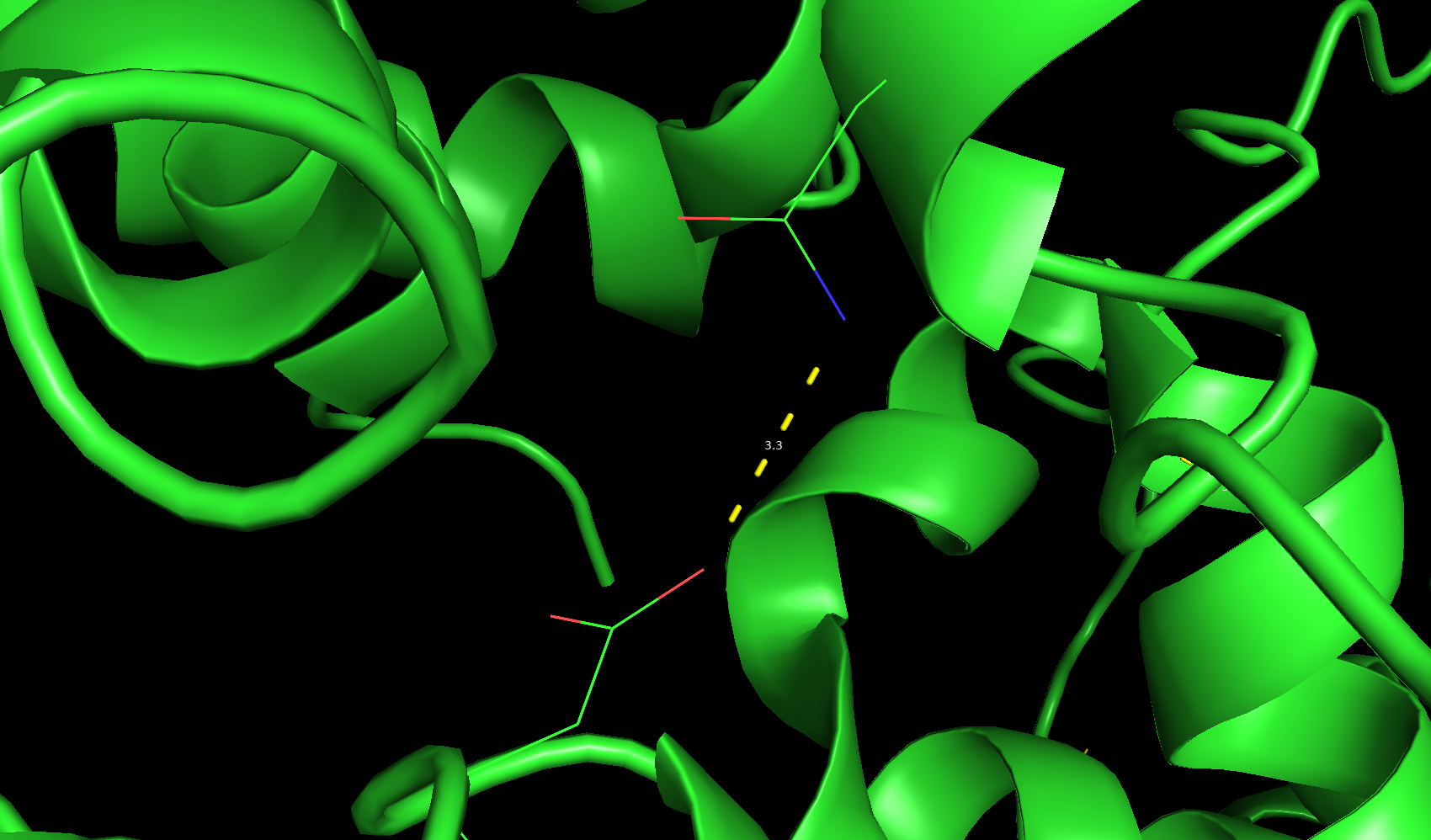
Рис. 2. Водородная связь между атомами боковых цепей в ядре белка по РСА.

Рис. 3. Водородная связь между атомами боковых цепей на поверхности белка по РСА.
Таблица 1.
| Тип водородной связи | Растояние в РСА, ангстрем | Число моделей ЯМР, в которых присутствует | Процент моделей ЯМР, в которых присутствует | Медиана расстояния между донором и акцептором в ЯМР, ангстрем | Максимальное расстояние между донором и акцептором в ЯМР, ангстрем | Минимальное расстояние между донором и акцептором в ЯМР, ангстрем |
| Остовная в альфа-спирали в центре белка | 3.3 | 0 | 0 | 3.72 | 3.94 | 3.56 |
| В ядре белка между боковыми цепями | 3.3 | 0 | 0 | 8.51 | 12.82 | 6.18 |
| В петле на поверхности белка | 3.1 | 0 | 0 | 6.37 | 8.19 | 4.58 |