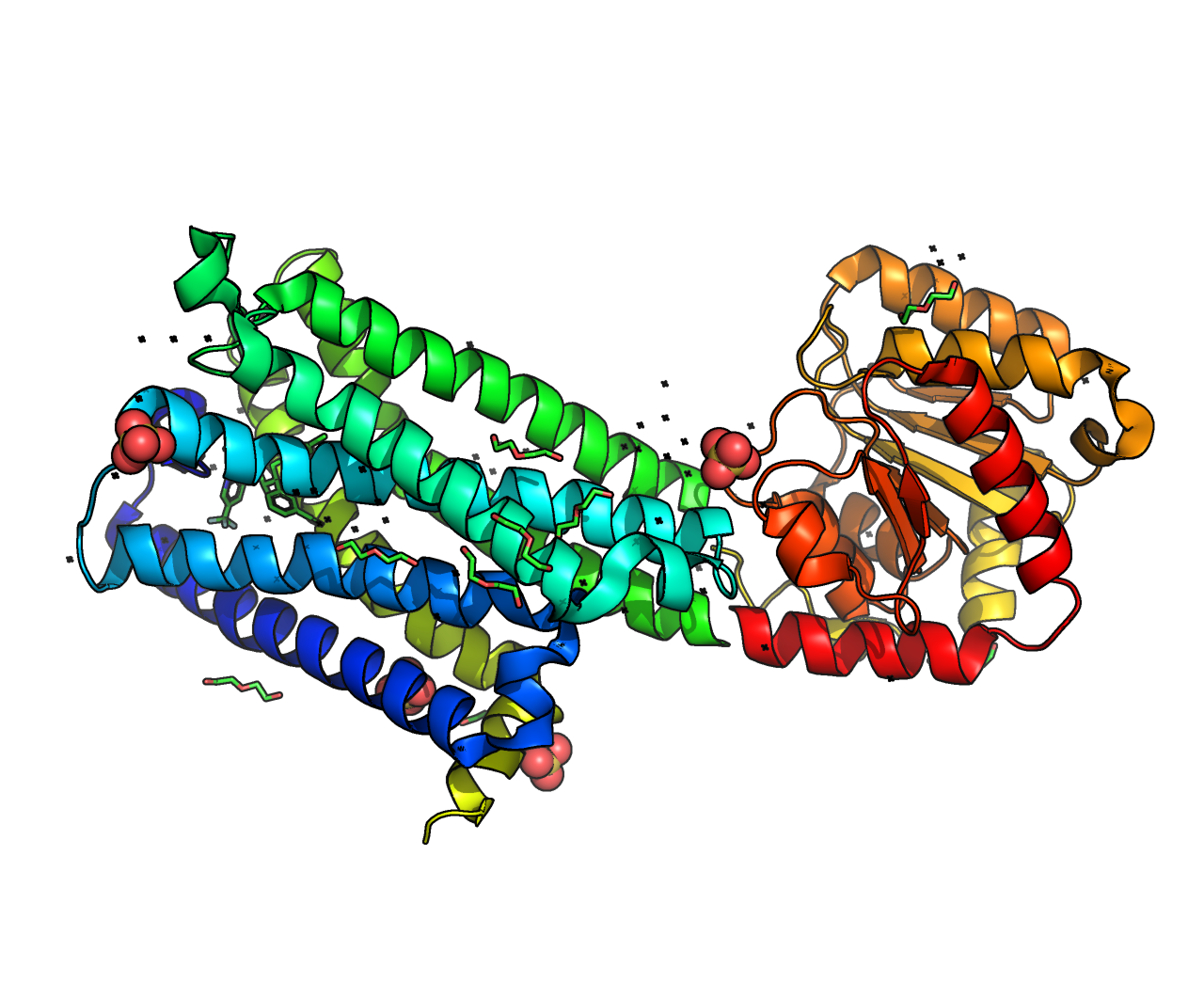
Каннабиноидный рецептор человека CB-1 в комплексе с антагонистом таранабантом
Идентификатор PDB – 5U09 (структура белка высокого разрешения, полученная методом рентгеноструктурного анализа), идентификатор UniProt P21554 (CNR1_HUMAN).
CB-1 является G-белок-сопряжённым рецептором, ответственным за восприятие сигналов от эндогенных каннабиноидов (анандамида, 2-арахидоноилглицерина). Также опосредует ответ на фитоканнабиноиды (тетрагидроканнабинол, каннабидиол), содержащиеся в растениях рода Cannabis, и на синтетические каннабиноиды (например, JWH-018). Рецептор локализуется в цитоплазматической мембране клеток и внешней мембране митохондрий центральной нервной системы, хотя был обнаружен и в других тканях (периферическая нервная система, лёгкие, печень и почки) [1,2]. В статье [3] предполагается, что CB-1 рецептор характерен только для Хордовых. Функция рецептора в организме заключается отчасти в защите от избыточного возбуждения нейронов, происходящего из-за гиперсекреции возбуждающих нейромедиаторов.
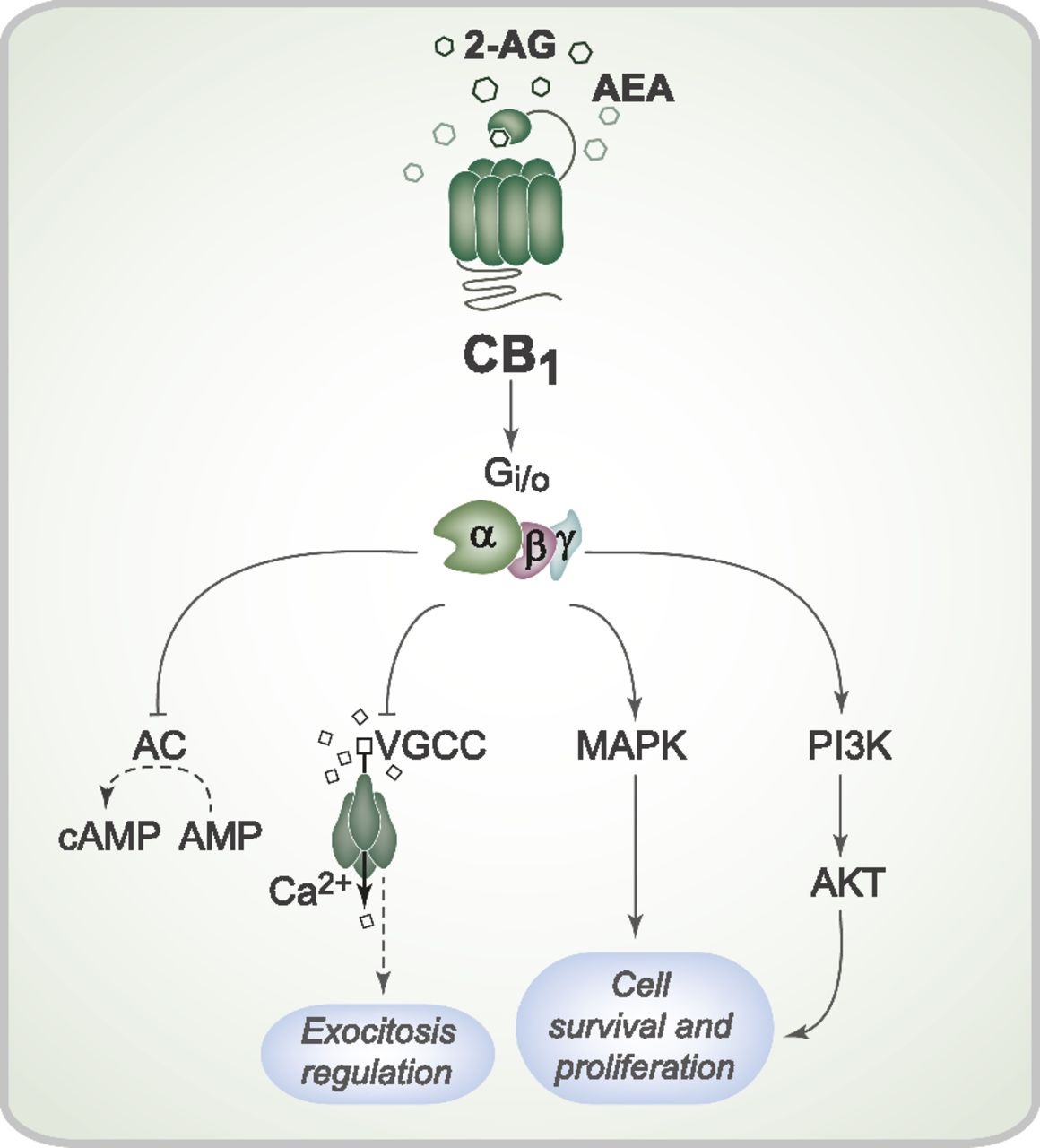
Как и все известные GPCR, рецептор CB-1 содержит семь трансмембранных альфа-спиралей. Он связан с Gi/o-белком. Таким образом, как видно из рисунка 2, он может опосредованно ингибировать аденилатциклазу, понижая концентрацию цАМФ в клетке; активировать MAP-киназный каскад и фосфатидилинозит-3-киназу, влияя на рост и пролиферацию клетки; также модулировать интенсивность экзоцитоза через воздействие на кальциевые каналы.
Лиганды
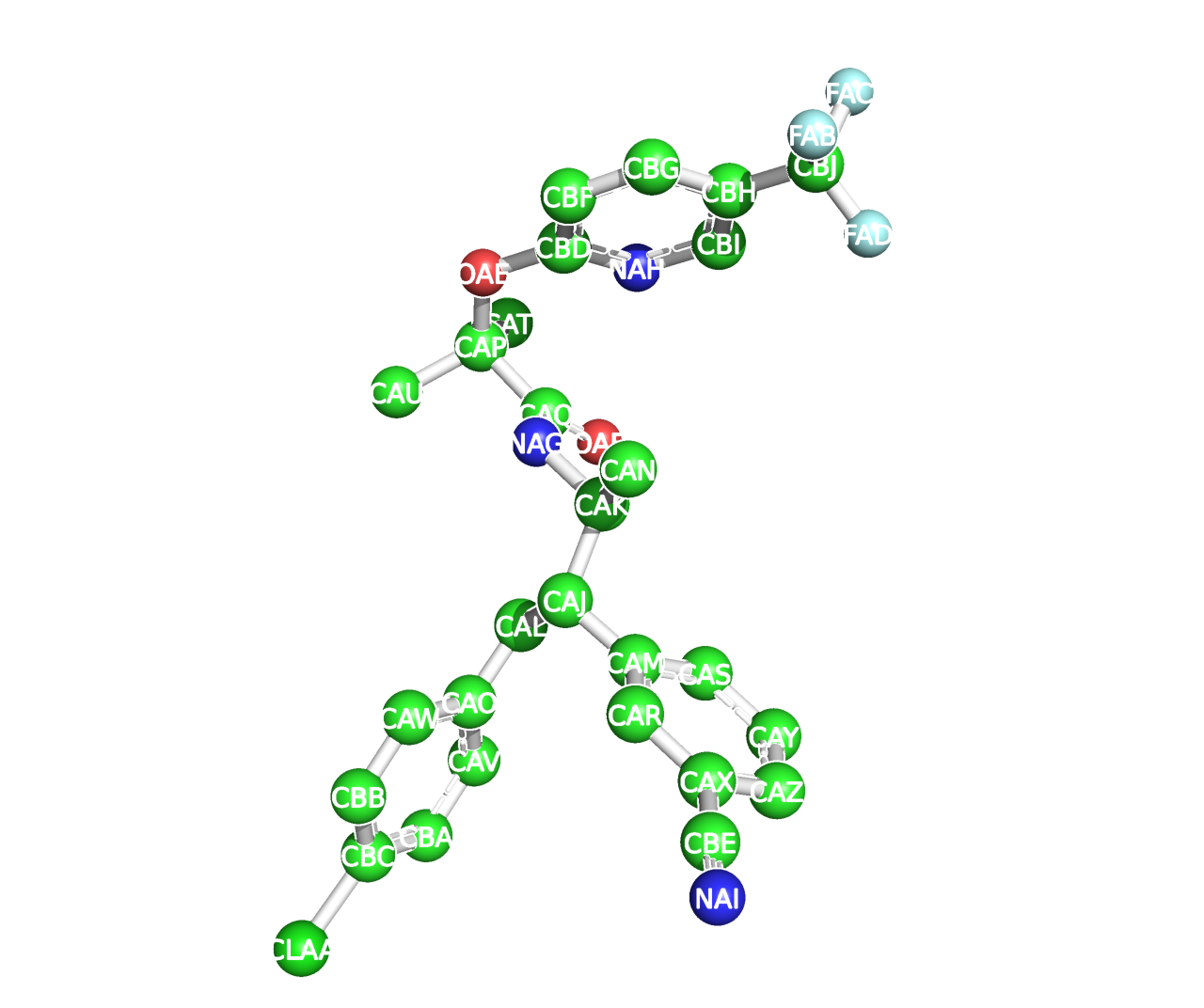
Таранабант – антагонист CB-1-рецептора, связывающийся в активном центре
Название по IUPAC: N-[(2S, 3S)-4-(4-хлорфенил)-3-(3-цианофенил)-2-бутанил]-2-метил-2-{[5-трифлюорометил-2-пиридинил]-окси}-пропанамид
Брутто-формула: C27H25ClF3N3O2
Молярная масса: 516 г/моль
PubChem ID: 11226090
Нужен для того, чтобы обозначить карман связывания субстрата, а также показать конформацию рецептора в связанном с субстратом виде.
-
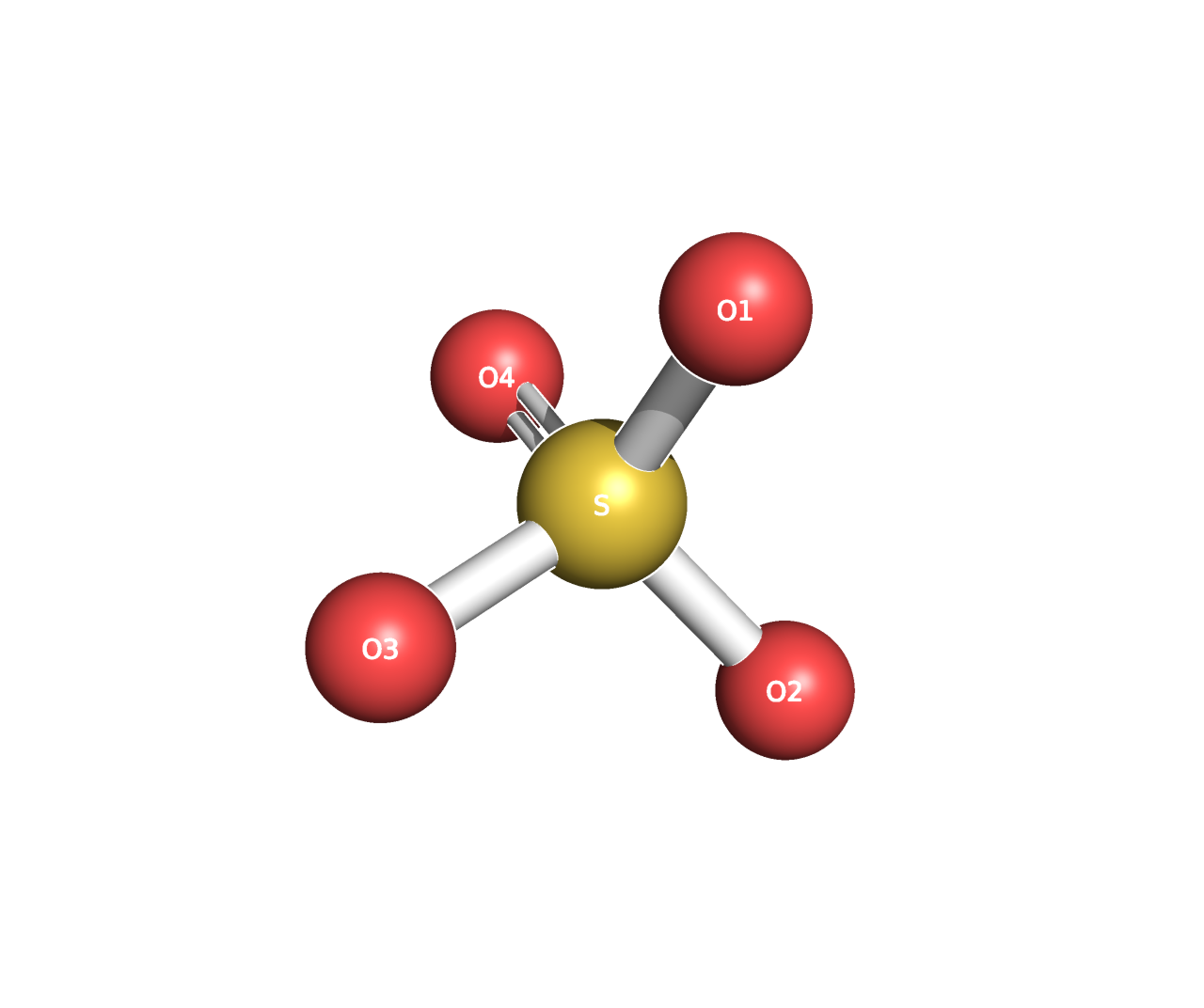
Сульфат-анион (4)
Брутто-формула: SO4 2-
Молярная масса: 96 г/моль
PubChem ID: 1117
В структуре белка в основном окружены положительно заряженными аминокислотами (Lys, Arg, His). Вероятно, участвуют в стабилизации этих участков. Причём участки, богатые положительно заряженными аминокислотами, опоясывают сверху и снизу гидрофобную (скорее всего, трансмембранную) часть. Возможно, in vivo эти участки взаимодействуют с фосфатными группами липидов мембраны, поэтому при кристаллизации белка отдельно от мембраны возникла необходимость скомпенсировать их заряд.[5]
-
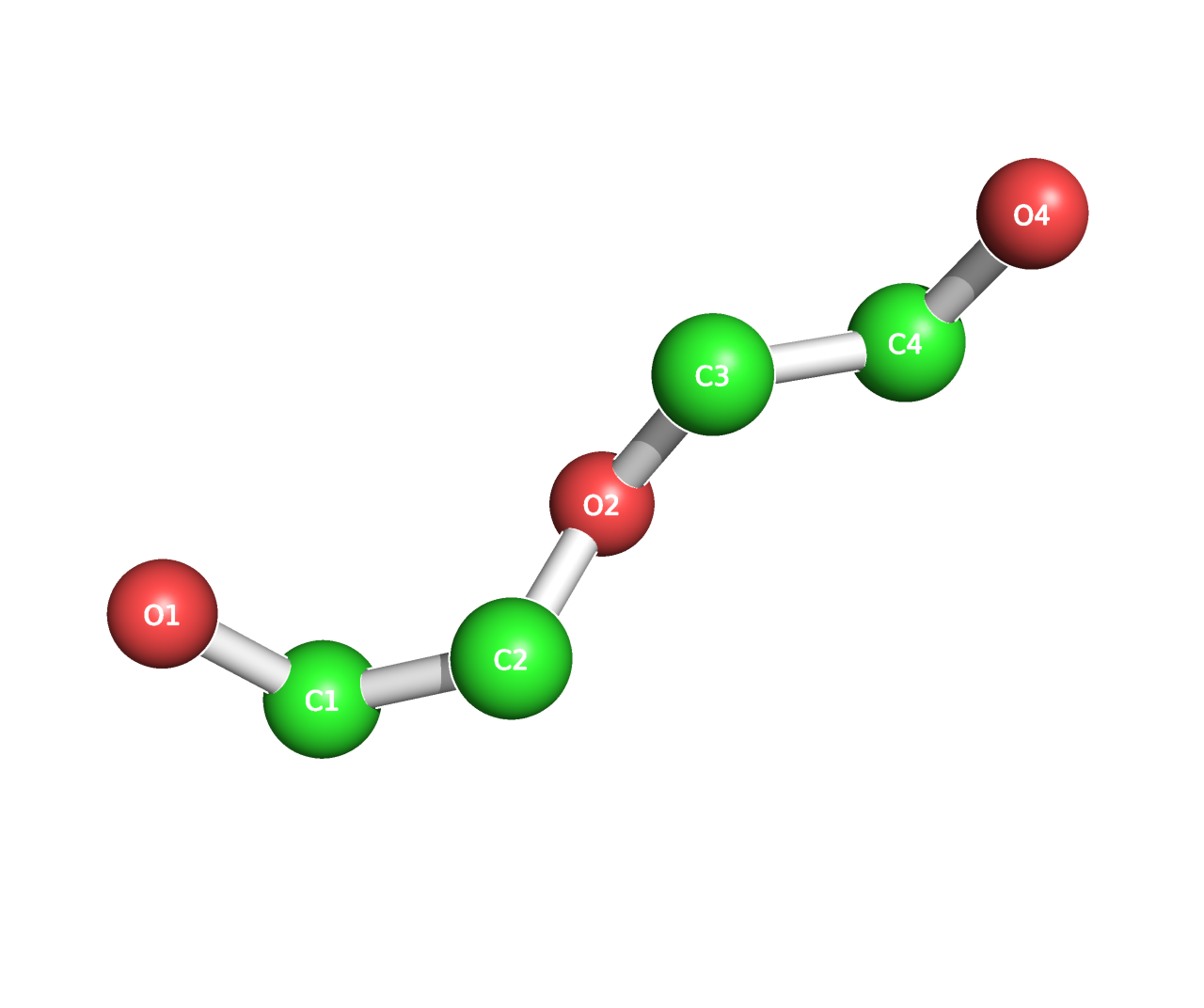
Диэтиленгликоль (9)
Название по IUPAC: 2-[2-гидроксиэтокси]этанол
Брутто-формула: C4O3H10
Молярная масса: 106 г/моль
PubChem ID: 8117
Диэтиленгликоль в основном встречается рядом с гидрофобными аминокислотами трансмембранного участка. Возможно, он использовался как более амфифильный растворитель, чем вода, в растворе с последней, чтобы очистить белок от связанных липидов мембраны. [6]
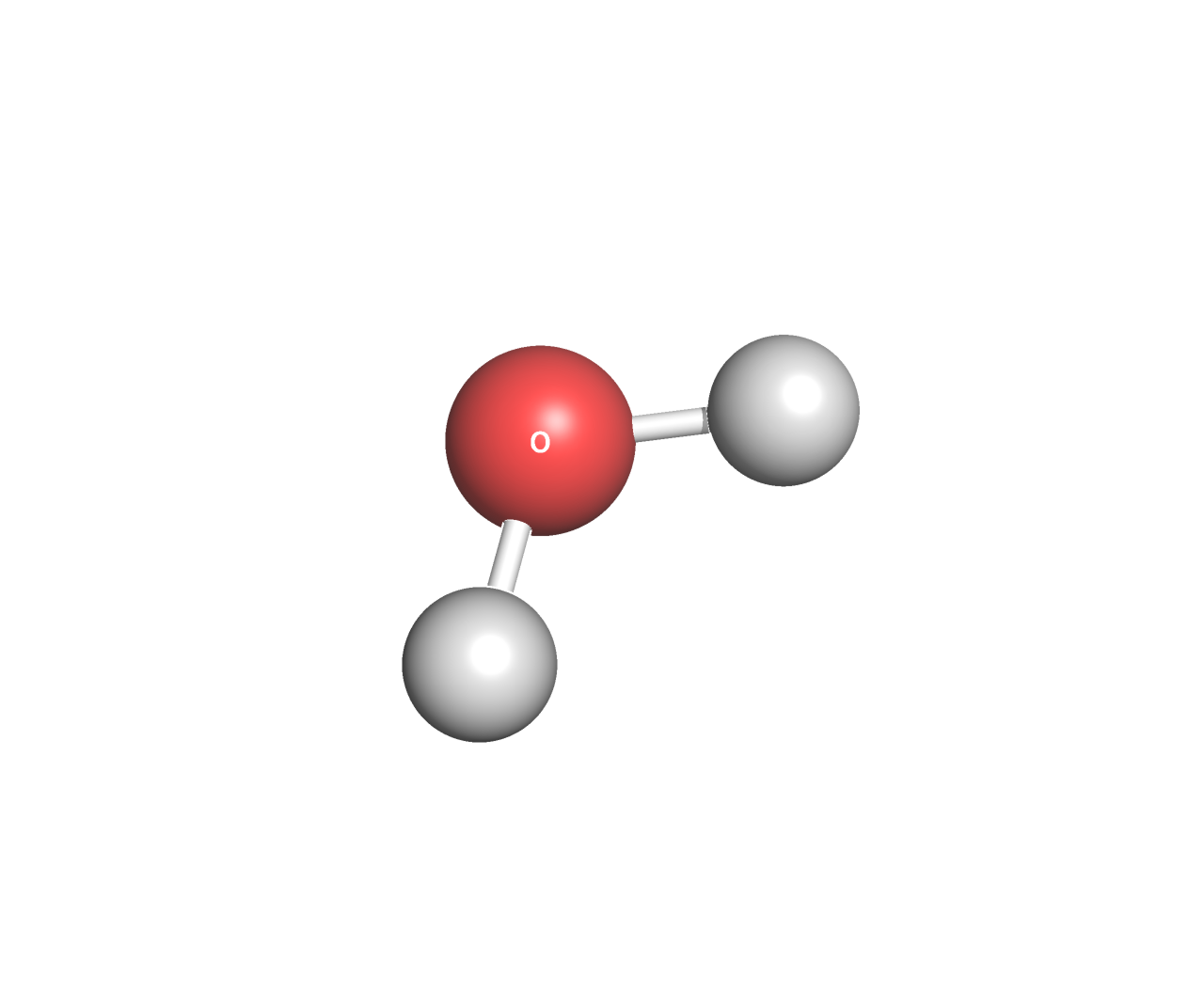
Вода
Брутто-формула: H2O
Молярная масса: 18 г/моль
PubChem ID: 962
Нужна для кристаллизации белка, в клетке образует гидратную оболочку экспонированных наружу и внутрь мембраны участков белка.
Контакты в белке
Водородная связь – взаимодействие между атомом водорода, ковалентно связанным с электроотрицательным атомом(в белках O, N, S), и другим электроотрицательным атомом, с обобществлением неподеленной электронной пары. Водородные связи в большом количестве присутствуют в белках, но наибольшее значение оказывают при формировании элементов вторичной структуры: альфа-спиралей и бета-листов.
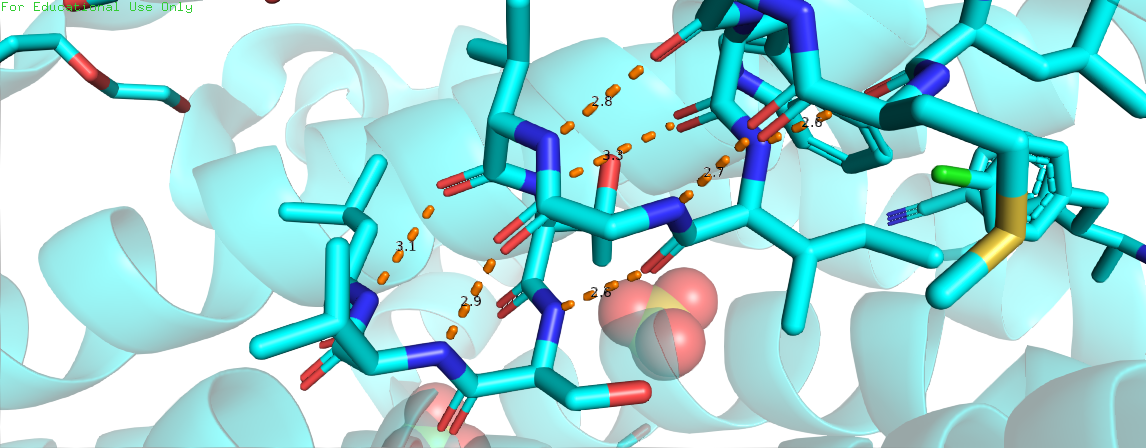
Скрипт с названием "hbonds" в апплете отображает 2 примера таких взаимодействий с измеренными параметрами водородной связи. Переключиться между ними можно с помощью кнопки "Resume". Для поиска водородных связей мы использовали команду cartoon благодаря которой нашли границы альфа-спирали и бета-листа, далее командой select выделили исследуемый участок и с помощью calculate hbonds отобразили водородные связи. Измерения проводились с помощью команды measure. Подробный скрипт можно увидеть по ссылке в апплете. По литературным данным[7], стандартное значение длины между кислородом и азотом в водородной связи альфа спирали - 2.99±0.14Å для параллельного бета-листа - 2.92±0.14Å, средние значения по результатам наших измерений лежат в этих диапозонах.
-
Ионные взаимодействия внутри белка формируются между противоположно заряженными аминокислотными остатками и участвуют в формировании и стабилизации третичной структуры белка. В подобное взаимодействие могут вступать аргинин, лизин, гистидин, заряженные положительно и аспартат, глутамат, заряженные отрицательно.
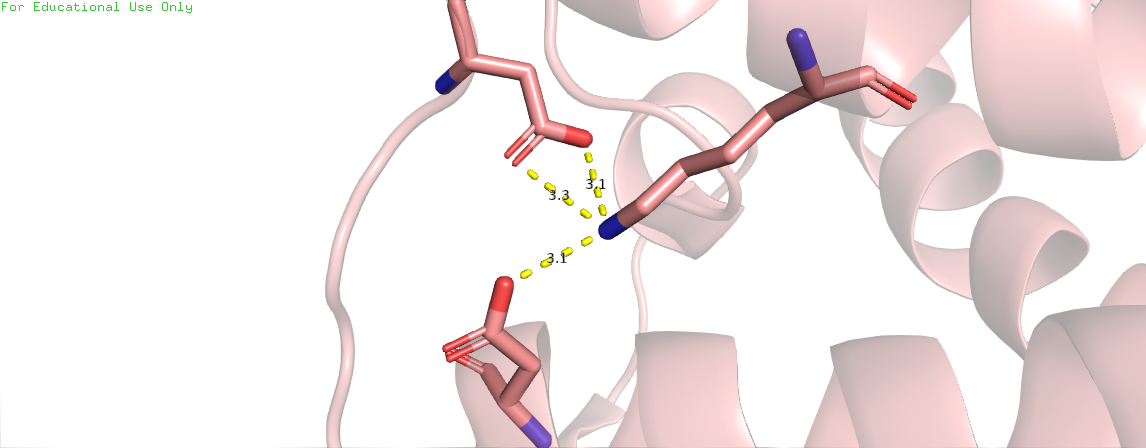
Скрипт с названием "Ionic interactions" на первой странице показывает все солевые мостики, найденные нами в исследуемом белке; на следующих трех страницах показаны изолированные примеры ионых связей. Переключиться между страницами можно с помощью кнопки "Resume". Для поиска солевых мостиков был написан скрипт, который основан на поиске атомов азота и кислорода указанных выше аминокислот , способных вступать в ионные взаимодействия на расстоянии 3.5 ангстрем (использована команда within).
-
Дисульфидные связи – ковалентное взаимодействие между двумя остатками цистеинов, способные формироваться спонтанно при непосредственной близости двух аминокислот и определенных условиях среды, либо с участием фермента дисульфидизомеразы, катализирующей данную реакцию. Дисульфидные мостики – важный участник стабилизации третичной структуры белка, т.к. являются наиболее прочными из всех стабилизирующих взаимодействий. Часто формируются между разными элементами вторичной структуры, тем самым сильно ограничивая возможности конформационных переходов и стабилизируя структуру.
Скрипт с названием "Disulfide bonds" на первой странице показывает положение обнаруженного дисульфидного мостика в белке, на второй - изолированную связь. Переключиться между страницами можно с помощью кнопки "Resume". Для поиска дисульфидных мостиков была использована команда restrict cys*, которая отобразила все цистеины белка. Анализируя расположение аминокислот и используя команду ssbonds on, был найден один дисульфидный мостик.
-
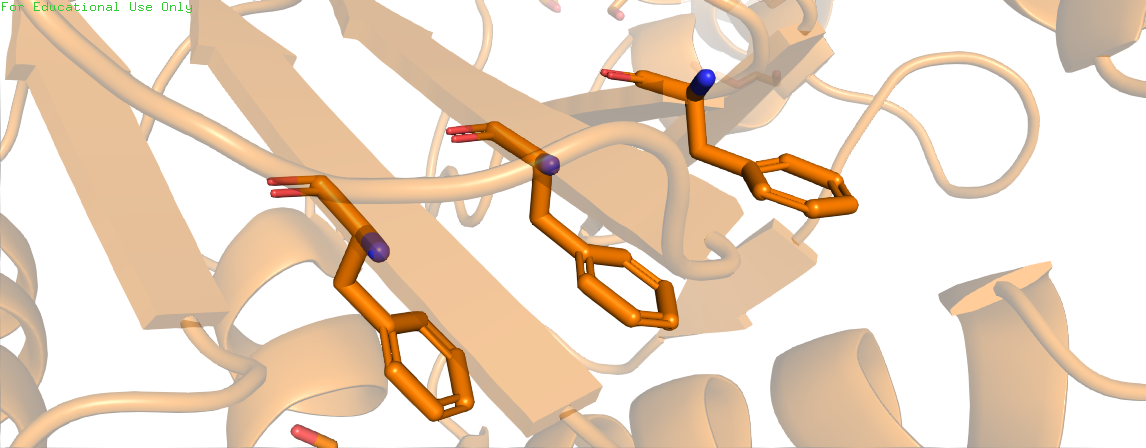
Ароматические взаимодействия(стекинг) - нековалентные взаимодействия между плоской ароматической системой и другой подобной системой (π-π-стэкинг) или же катионом (π-катионный-стэкинг). Данные связи участвуют в стабилизации третичной структуры белка.
Скрипт с названием "Stacking" на первой странице показывает положение примеров стэкинга в белке, на последующих – изолированные связи. Для поиска стэкинга была примена команда restrict tyr*, phe*, trp*, которая отобразила все ароматические аминокислоты белка. Анализируя взаимное расположение аминокислот были найдены примеры параллельного стекинга и Т-стекинга.
Гидрофобное ядро
Минимальное расстояние, на котором соседние атомы покрывают практически весь остаток фенилаланина составляет 4 ангстрема. Вероятно, это расстояние и является расстоянием между соседними не связанными ковалентно атомами в белке.
Для расчета того, получится ли поместить какой-либо атом между двумя атомами, необходимо рассчитать расстояние от краев этих атомов. Возьмем наименьший из возможных радиусов - кислорода (1,4 ангстрем). Тогда расстояние между двумя атомами кислорода составим 4-1,4*2=1,2 ангстрема. Соответственно, поместить еще один атом между двумя нековалентно связанными атомами в белке не выйдет. В таком случае, радиус атома должен был составлять 0,6 ангстрем.[8]
Взаимодействия с лигандом
Важные для связывания остатки:
- Ser123 – водородная связь с одним из фторов -CF3 группировки, Ser383 – водородная связь с кислородом кетогруппы
- Целый кластер гидрофобных аминокислот (Met103, Ile105, Phe108, Leu122, Ile 169, Phe 170, Val196, Phe268, Trp356, Phe379, Phe381) в кармане связывания, стабилизирующий комплекс белка с гидрофобными каннабиноидами
- Phe170 – можно предположить Т-стэкинг (кольца расположены перпендикулярно на расстоянии около 4,5А)
Личный вклад
Филипп Качкин - верстка сайта, редактирование скриптов для апплетов.
Владислав Мурзин - написание введения и работа над литературой, картинки из PyMol.
Беляев Геннадий - скрипты для апплетов лигандов и белковых взаимодействий, частичная работа над сайтом.
Нагимов Руслан - скрипты для апплетов взаимодействий с лигандом, гидрофобного ядра.
Ссылки на источники
- Страница рецептора на UniProt
- Страница рецептора на PDB
- Maurice R. Elphick (2012), The evolution and comparative neurobiology of endocannabinoid signalling, Philosophical Transactions of the Royal Society of London B
- mGlu5/CB1 Cell Signaling Crosstalk. Isabella G. Olmo, Talita H. Ferreira-Vieira and Fabiola M. Ribeiro Molecular Pharmacology November 1, 2016, 90 (5) 609-619; DOI: https://doi.org/10.1124/mol.116.104372
- Страницы лигандов в PubChem
- Участие диэтиленгликоля и сульфата в качестве компонентов растворителя подтверждается PDB-файлом белка (5U09): «CRYSTALLIZATION CONDITIONS: 31% PEG400, 100MM SODIUM CITRATE, PH5.5, 100MM MAGNESIUM SULFATE, LIPIDIC CUBIC PHASE, TEMPERATURE 293K» (remark 280)
- Baker, E. N. & Hubbard, R. E. (1984). Hydrogen bonding in globular proteins. Prog. Biophys. Mol. Biol., Vol. 44, pp. 97 179.
- Дж. Эмсли. Элементы. 1993г