Взаимодействия в белке VirB4
(ID protein: 4AG6)
Водородные связи
Водороные связи - основной тип взаимдойствий, подерживающий структуру белка. Они могут образовываться как внтури остова белка, так и между радикалами.
На рисунке 1 изображена водородная связь в остове бекла, между азотом одной пептидной связи и кислородом другой. Эта водородная связь поддерживает параллельный бета-листБ что видно по сдвгу кислорода изолейцина относительно кислорода аспартата вперед. В действительности же, две эти аминокислоты находятся на С-конце этого бета-листа (см. Рис1).
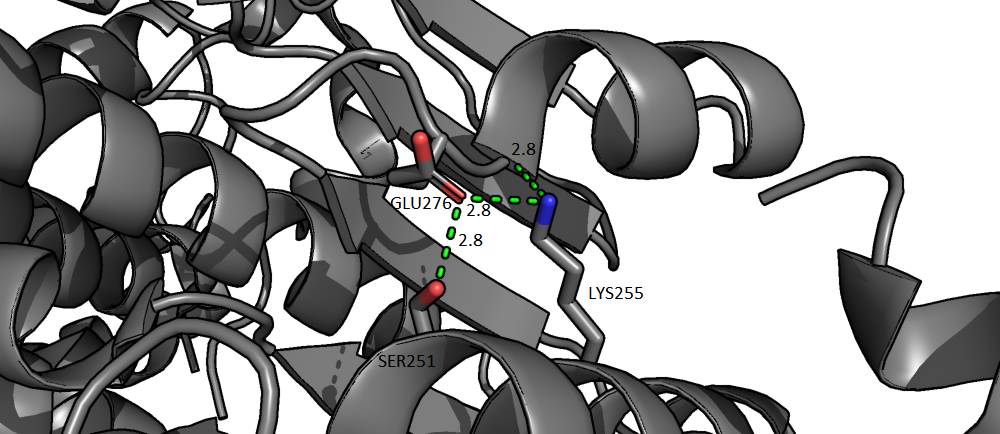
На рисунке 2 изображена более сложная структура (см. Рис2). Серин и лизин находятся в одной альфа-спирали друг над другом. И образуют водородные связи с глутаматом, серин с радикалом, а лизин и с радикалом, и с кислородом в карбоксильной группе глутамата. Эти водородные связи поддерживают расположение альфа-спиралей (поле глутамта начнается еще одна альфа-cпираль).
Дисульфидные мостики
Дисульфидные мостики - единственный вид взаимодействий, поддерживающий структуру белка, который является ковалентным взаимодействием.
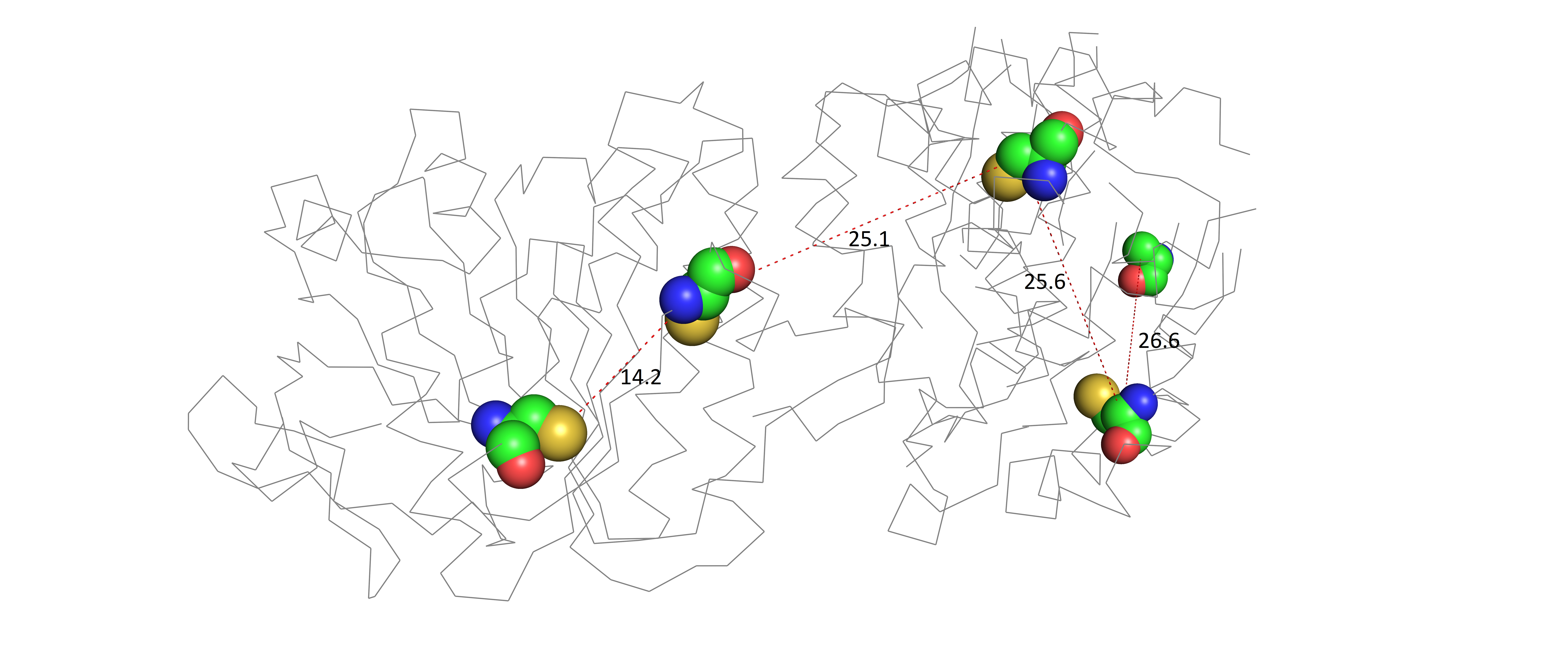
В VirB4 все цистеины расположены слишком далеко (см. Рис3), чтобы сформировать цистеиновые мостики.
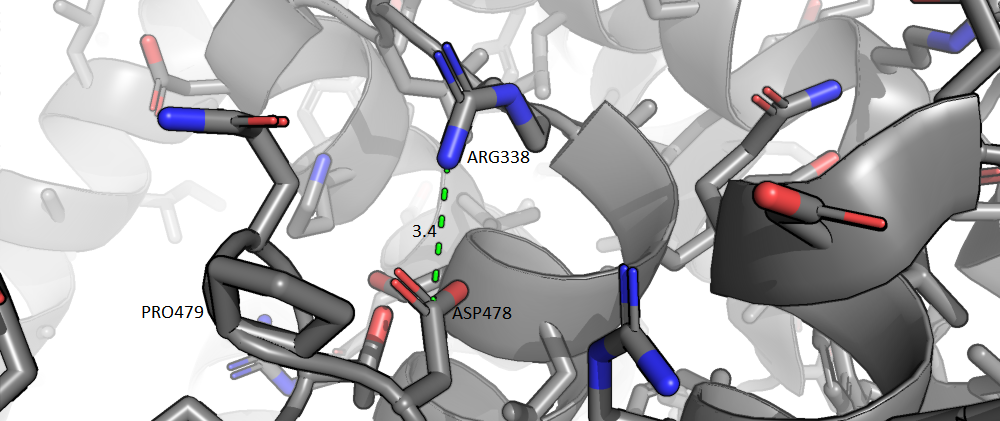
Солевые мостики
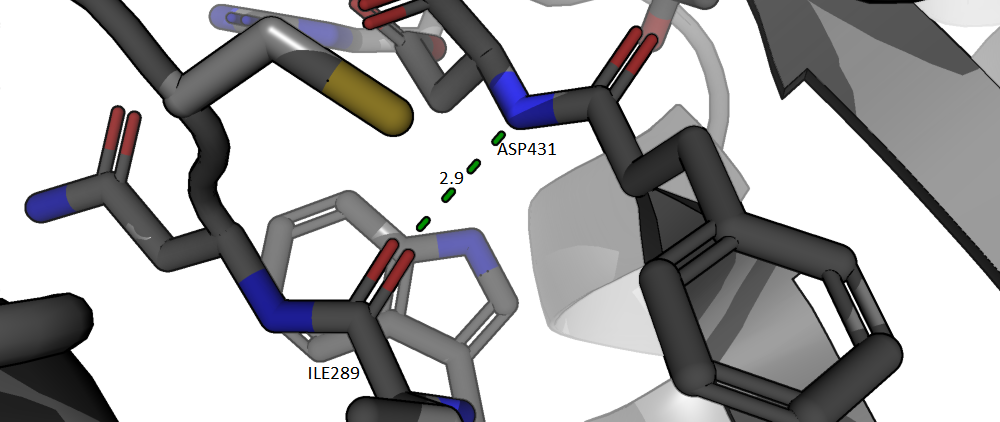
Солевые мостики - взаимодейтсвия между заряженными радикалами аминокислотных остатков. На рисунке 4 представлен такой солевой мостик между остатком аргинина и аспартата. Интересно, что сразу после аспартата следует пролин, и ход цепи меняет направление - бета-поворот, - а солевой мостик поддерживает его.
Стекинг
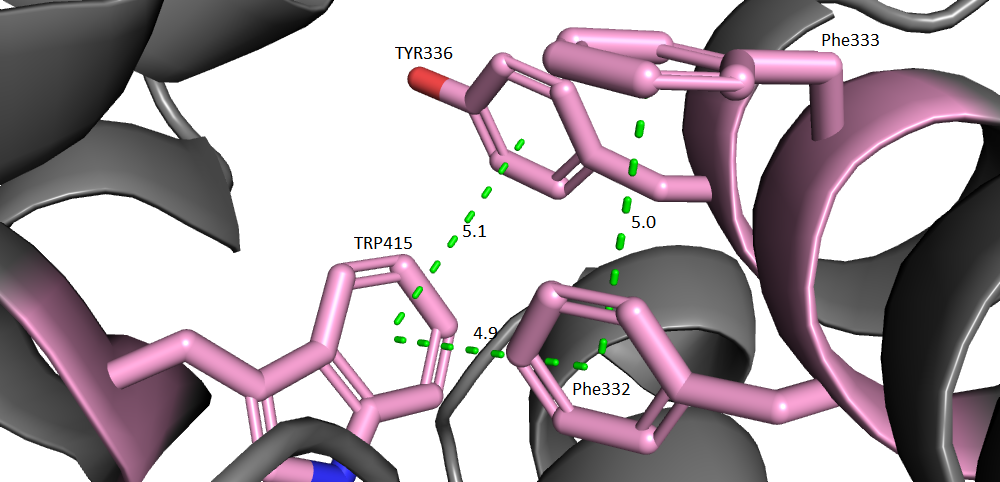
Тип взаимодействий, представляющий собой взаимодействие пи-электронов ароматических колец, а в белках это аминокислотные остатки тирозина, триптофана и фенилаланина. Существует несколько типов стекинга: параллельные (кольца раположены параллельно), Т-стекинг (кольца расположены перпендикулярно), катионный стекинг (стекинг между катионом и кольцом). На рисунке 5 изображен Т-стекинг: последовательное взаимодействие фенилаланина, соседнего фенилаланина, триптофана и тирозина.
В этом участке два фенилаланина (идут подряд) и тирозин принадлежат одной альфа-цепи, а триптофан другой. Этот стекинг поддерживает взаимное расположение альфа-спиралей