ОСОБЕННОСТИ МЕМБРАННЫХ БЕЛКОВ |
Назад |
| PDB код | Тип | Мембрана | Толщина гидрофобной части, A | Медиана числа остатков в одном трансмембранном участке |
| 1OKC | Альфа-спирали | Внут.митохондриальная | 29.5 ± 1.7 | 23 |
| 4fqe | Бета-бочка | Внешняя мембрана грам-отрицательных бактерий | 22.2 ± 1.5 | 7 |
| 7ahl | Бета-бочка | Секретируется (Staphylococcus aureus) | 23.5 ± 0.9 | 7 |
| 2lme | Бета-бочка | Внешняя мембрана грам-отрицательных бактерий | 23.4 ± 2.2 | 7 |
| 3ukm | Альфа-спирали | Клеточная мембрана эукариот | 31.8 ± 1.0 | 23 |
| 4f4l | Альфа-спирали | Внутренняя мембрана грам-отрицательных бактерий | 28.2 ± 1.3 | 20 |
Табл.1 — информация о трансмембранных белках, полученная из БД OPM
#1
Для работы использовался белок PDB:4KJR — Ca2+/H+ antiporter YfkE (см.фиг.1). Это белок плазматической грамм-положительной бактериии Bacillus Subtilis. Для поиска его гомологов использовался PSI-BLAST со следующими установками: e-value=0.00001, количество находок 1000, исключён поиск по бактериям рода Subtilis, два повторения. Для выравнивания были выбраны 15 потенциальных гомологов из разных родов.
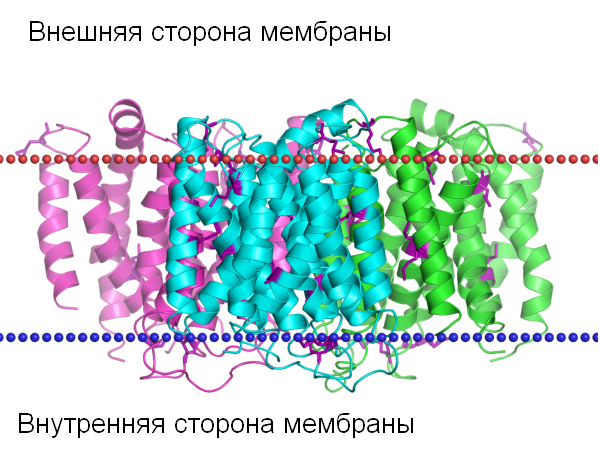
Фиг.1 — структура гомотримера антипортера, встроенного в мембрану.
#2
В TCBD есть отдельная запись для белка PDB:4KJR: 2.A.19.2.7 (член семейства Ca2+-катионных антипортеров). В случае данного белка, общая схема осуществляемого им транспорта выглядит так:
Ca2+ (in) + nH+(out) <=> Ca2+ (out) + nH+(in)
| PDB ID (AC) | TCBD ID | Организм | Тип мембраны | Угол наклона спиралей к нормали | Количество трансмембранных спиралей |
| 4KJR(O34840) | 2.A.19.2.7 | Bacillus Subtilis | Плазматическая мембрана | 0 ± 0° | 33 |
Табл.2 — Описание структуры трансмембранного белка Ca2+/H+ antiporter YfkE
TCBD ID:
2.A.19.2.7 — Ca2+/H+ antiporter YfkE
2.A.19 — Ca2+:Cation Antiporter (CaCA) Family (Cation Diffusion Facilitator (CDF) Superfamily)
2.A — Porters (uniporters, symporters, antiporters)
2 — Electrochemical Potential-driven Transporters
#3
Гомологи белка O34840 были выровнены. Хотя этот белок и трансмембранный, в нём много гидрофильных остатков (см.фиг.2,3).
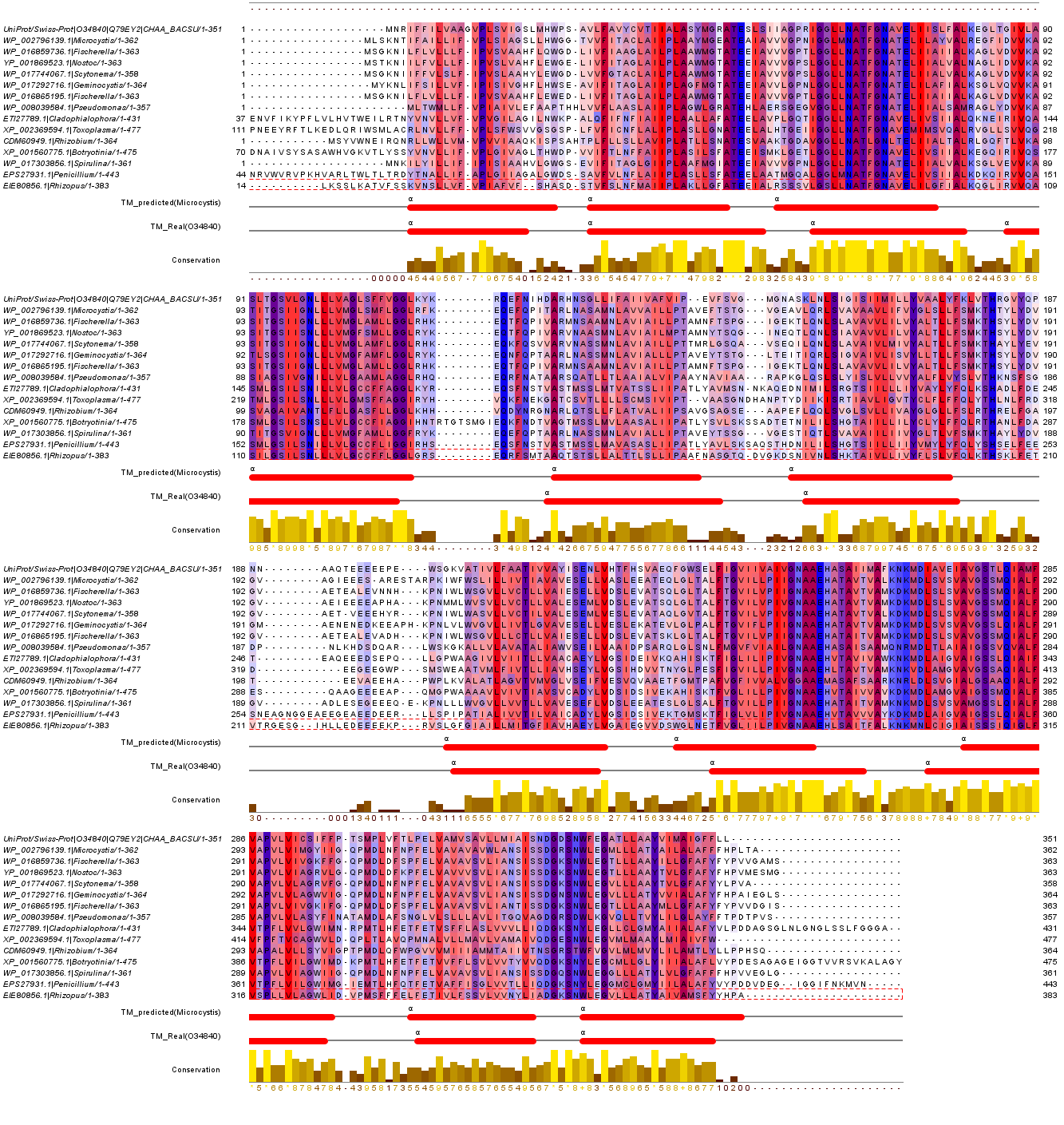
Фиг.2 — выравнивание гомологов (эукариотических и прокариотических) (Ca/H+)-антипортера YfkE. В оттенки красного покрашены гидрофобные остатки. Внизу помимо консервативности позиции показаны красным трансмембранные участки альфа-спиралей белка (ТМ).

Фиг.3 — структура мономера (Ca/H+)-антипортера YfkE, раскрашенная по выравниванию на фиг.2
У этого гомологичного ряда много консервативных позиций как гидрофобных, так и гидрофильных. В основном консервативные участки характерны для трансмембранных спиралей (см.фиг.4), но и между ними есть консервативные позиции. Некоторые полярные аминокислоты в выбранных белках крайне консервативны (см.фиг.5).

Фиг.4 — консервативные позиции в гомологах (Ca/H+)-антипортера YfkE. Большинство консервативных остатков расположено в трансмембранных спиралях.

Фиг.5 — особо консервативные полярные аминокислоты.
Если посмотреть на расположение заряженных аминокислот в выбранных гомологах, то можно заметить, что между 6 и 7 спиралями имеется участок, богатый отрицательно заряженными аминокислотами. Он и прочие полярные аминокислоты необходимы для образования пор и для стабилизации структуры белка.

Фиг.6 — консервативные позиции в гомологах (Ca/H+)-антипортера YfkE. Большинство консервативных остатков расположено в трансмембранных спиралях.
Если у белка WP_002796139.1 (Microcystis aeruginosa) через сервис ТMНММ предсказать его втоичную структуру, то расположение альфа-спиралей в целом совпадёт с таковым у белка O34840 (см.фиг.2, 7). Такой результат можно считать признаком гомологии между этими белками.
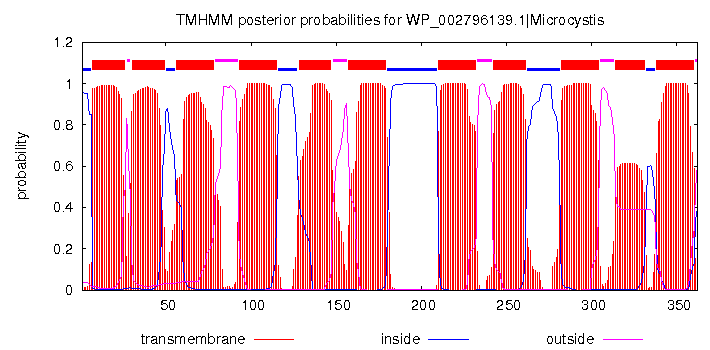
фиг.7 — выдача TMHMM: вероятность нахождения остатков внутри или по разные стороны мембраны.
Проект Jalview: blast.jar