D3 |
Назад |
#Найдите гидрофобные кластеры в структуре 1DGK
С помощью сервиса Clud в структуре гексокиназы 1DGK были найдены гидрофобные кластеры. При предустановленном пороге дистанции (в пределах которой атомы объединяются в один кластер) 5.4А было найдено два суперкластера, в которые входят практически целиком N- и С- половины белка (см.рис.1). Помимо них было обнаружено 25 меньших кластеров размером 3-10 атомов как на поверхности, так и внутри белка.
При проверке пяти самых крупных из них (9-10 атомов) оказалось, что они не участвуют в белок-белковых контактах в кристалле (исп.скрипт). Уменьшение порога на дистанцию привело к заметным изменениям: крупные, объединяющие практически всю молекулу кластеры распадаются на более мелкие. При этом становятся видны отдельные домены и карманы, в которые помещаются лиганды.
В целом высокая гидрофобность гексокиназы объясняется тем, что гидрофобное взаимодействие необходимо этому ферменту для локализации на митохондриальных мембранах (ссылка).
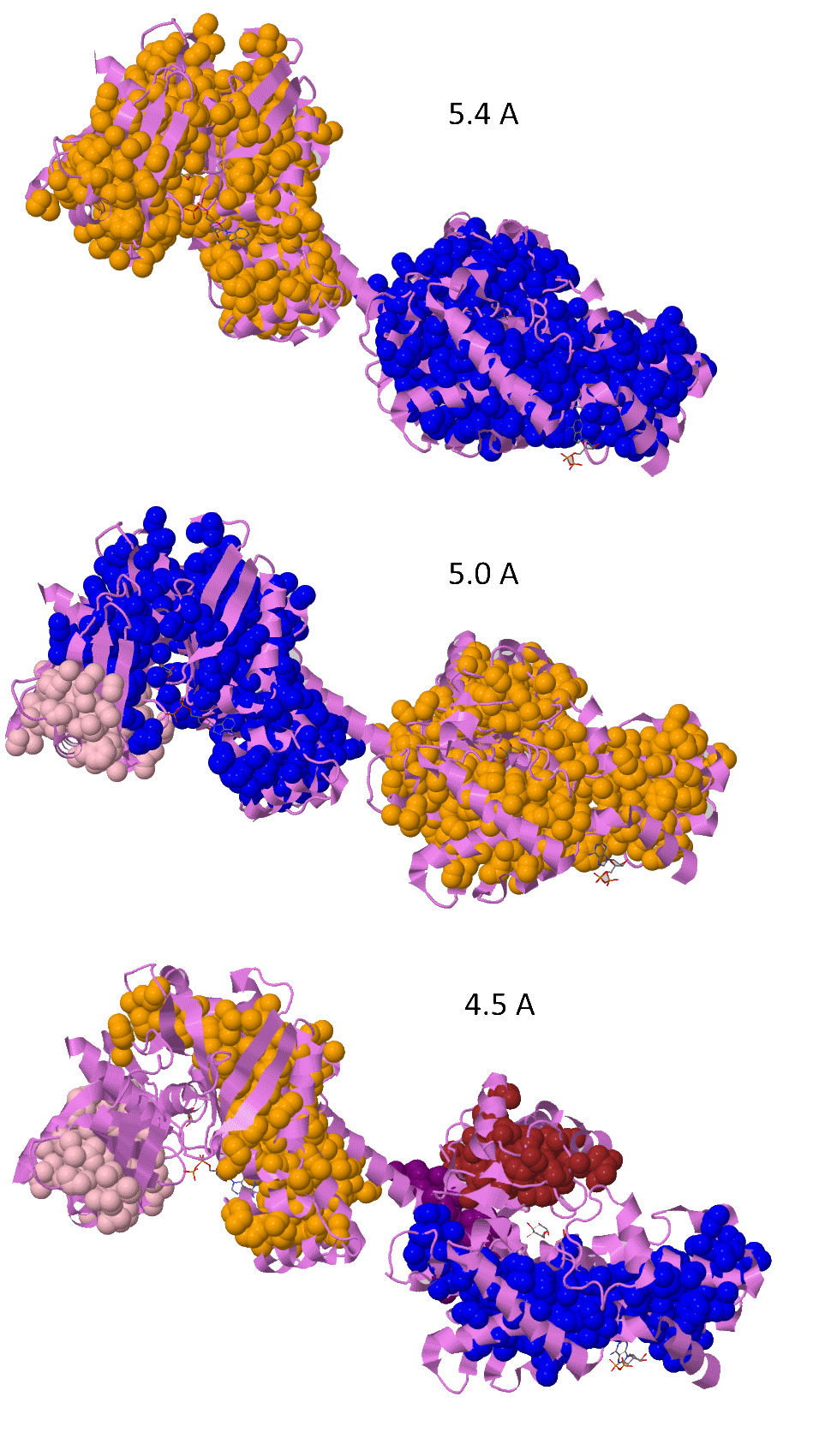
Рис.1 — крупные гидрофобные кластеры в структуре 1DGK. Уменьшение пороговой дистанции приводит к распаду крупных кластеров на более мелкие; при пороге 4.5 А различимы карманы для связывания лиганда и отдельные домены.
#Найдите гидрофобные кластеры на интерфейсе белок-НК
Я выбрал для работы комплекс белка и ДНК 3A5U. Видно, что внутри бета-бочонков — гидрофобный кластер, безусловно важный для поддержания структуры белка. Многие другие кластеры поменьше выходят на поверхность белка и включают в себя атомы ДНК гидрофобные взаимодействия таким образом могут in vivo обеспечивать взаимодействие НК-Белок.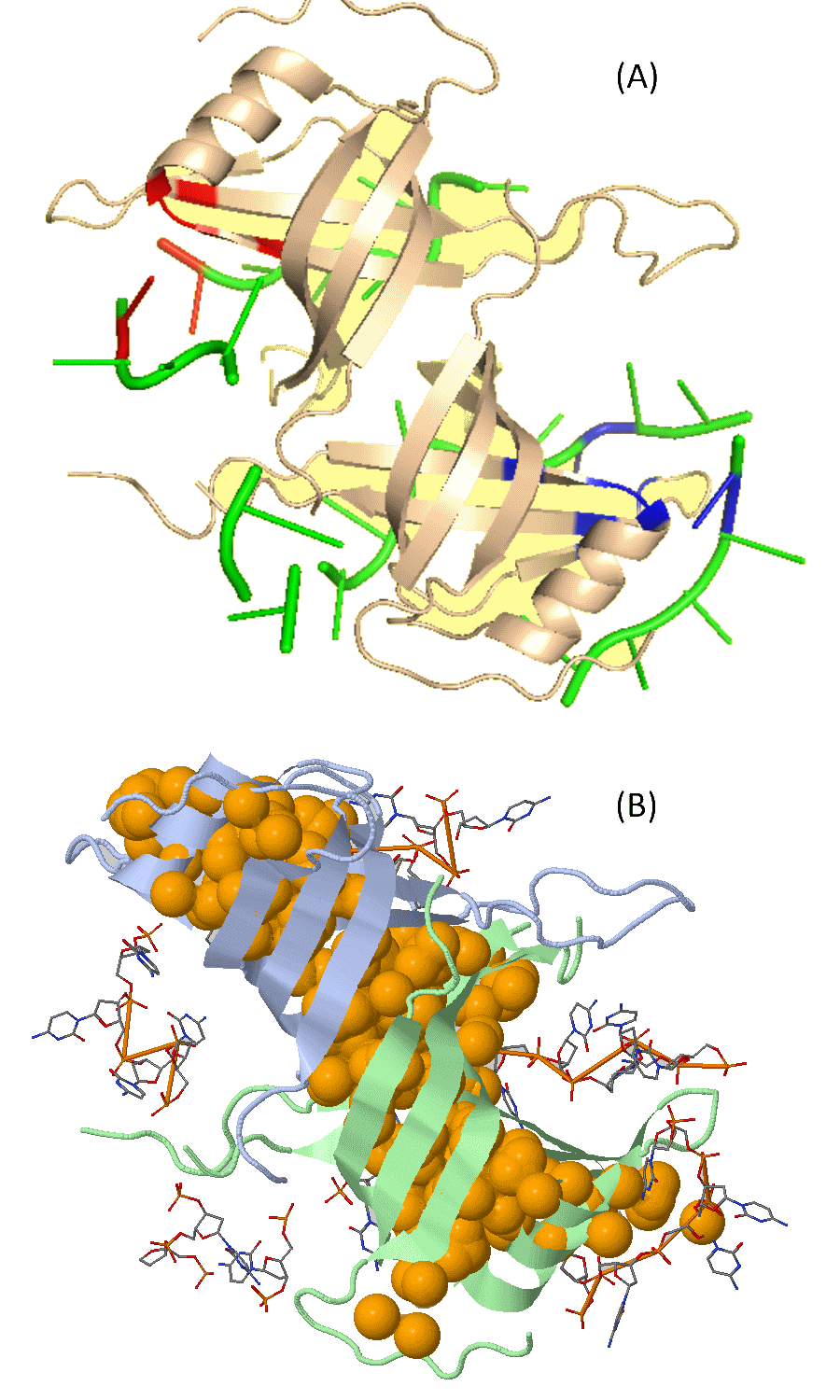
Рис.2 — (А) гидрофобные кластеры в структуре 3AU5 включают как атомы белка, так и ДНК; такие гидрофобные взаимодействия могут обеспечивать связывание ДНК белком in vivo. (B) Внутри бета-бочонков 3AU5 находится гидрофобный стержень, помогающий белку поддерживать структуру.
(см.Псевдоскрипт)