Ядерно-магнитный резонанс |
Назад |
При первом открытии pdb-файлов видно, что эти две структуры заметно различаются (см.рис.1). Качество пространственных выравниваний подтверждает это: RMSD при выравнивании через PDBeFold — 4.8, а при использовании
align 1c15, 1cy5 в pymol — 3.0RMSD показывает, на сколько Ангстрем при лучшем совмещении различаются позиции С-альфа атомов в двух моделях.
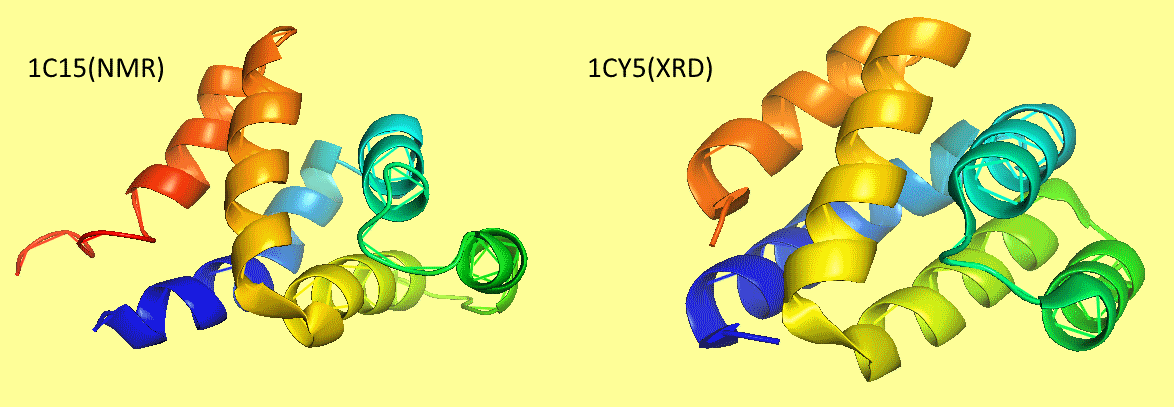
Рис.1 — без всяких выравниваний и совмещений видно, что структуры одного белка, полученные через NMR и XRD заметно рознятся.
Может, такие большие различия получились из-за высокого В-фактора в РСА-модели, или из-за того, что в растворе белок принимает много разных конформаций, что и повлияло на усреднённую ЯМР-модель? Нет, на рис.2 показано, что и В-фактор почти везде одинаково низкий, и совмещённые ЯМР-структур лежат вполне плотно, за исключением хвостов.
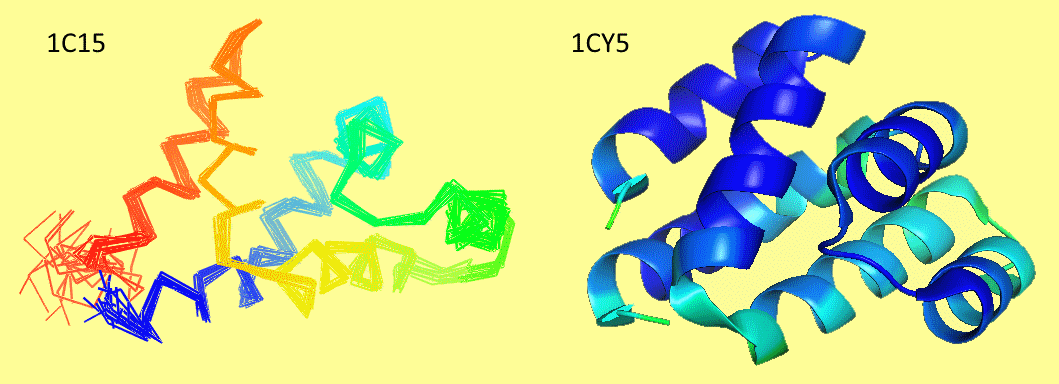
Рис.2 — совмещённые состояния, использованные в создании усреднённой ЯМР-модели, и покрашенная в соотвтствии с В-фактором РСА-модель.
Теперь попробуем найти в ЯМР-структурах связи, которые мы наблюдаем в РСА (рис.3). В ЯМР-моделях из рассмотренных связей есть только водородная связь между азотом и кислородом в остове альфа-спирали: близко расположенные радикалы в РСА-эксперименте оказались далеко в ЯМР-эксперименте.
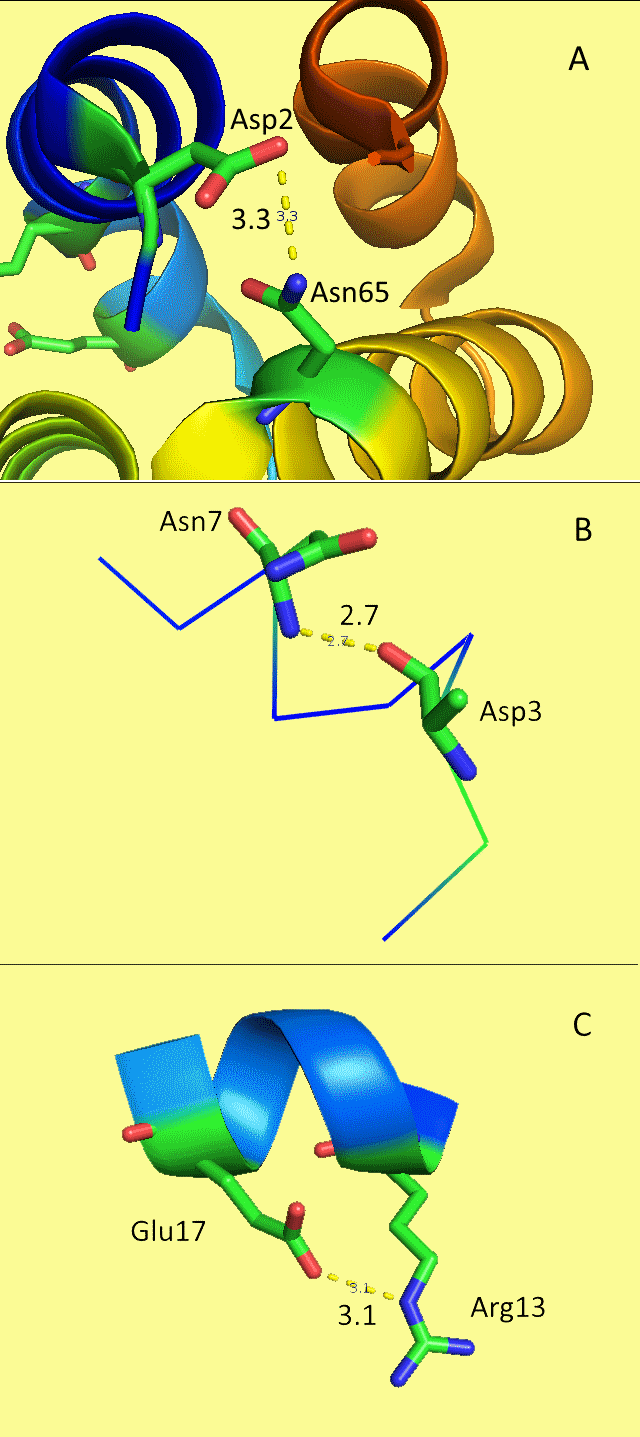 |
| Длина связи, Å | А | В | С |
| РСА | 3.3 | 2.7 | 3.1 |
| Мах | 10.8 | 3.6 | 8.1 |
| Min | 6.4 | 2.8 | 4.9 |
| Med | 8.8 | 3.2 | 6.6 |
| StDev | 1.4 | 0.2 | 0.9 |
Табл.1 — сравнение расстояний в рис.2 с аналогичными расстояниями в ЯМР-эксперименте. Видно, что сохраняется только расстояние между кислородом и азотом, образующими в альфа- спирали водородную связь. Данные о расстояниях получены при помощи скрипта.
Выводом из сказанного может быть только то, что данные ЯМР и РСА-экспериментов очень разные. При этом нельзя сказать, что какой-то из методов дал лучшие результаты: в ЯМР-экспериментах качество не оценивается, когда для РСА разработано множество параметров качества. К тому же в РСА работа ведётся с кристаллическим белком, а в ЯМР — с белком в растворе. Структура же белка in vivo, скорее всего, отличается как от РСА, так и от ЯМР-моделей.