Общая характеристика структуры 2CHP
Изображение вторичной структуры 2CHP показано на рис.1. Белок не содержит бета-листов, но содержит 20 альфа-спиралей.
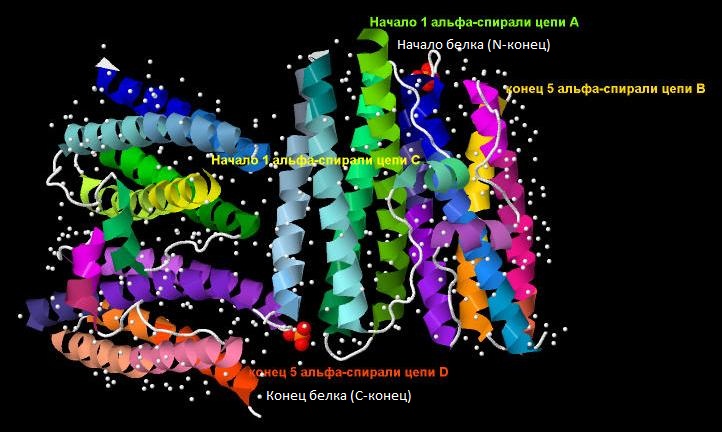 |
Рис1. Вторичная структура белка 2СHP. Переход цветов: зеленый - голубой - синий - фиолетовый - розовый - желтый - оранжевый
на цепях А и B показывает каким образом идет цепь белка от N-конца к C-концу. Для цепей С и D характерен аналогичный переход цветов.
Подписаны: начало 1 альфа-спирали цепи А, начало 1 альфа-спирали цепи С,
конец 5 альфа-спирали цепи В и конец 5 альфа-спирали цепи D. Белым цветом в виде шаровидных структур показаны молекулы воды. |
Молекулы, отличные от белка и воды представлены на рис.2. Это 2 фосфат-иона.
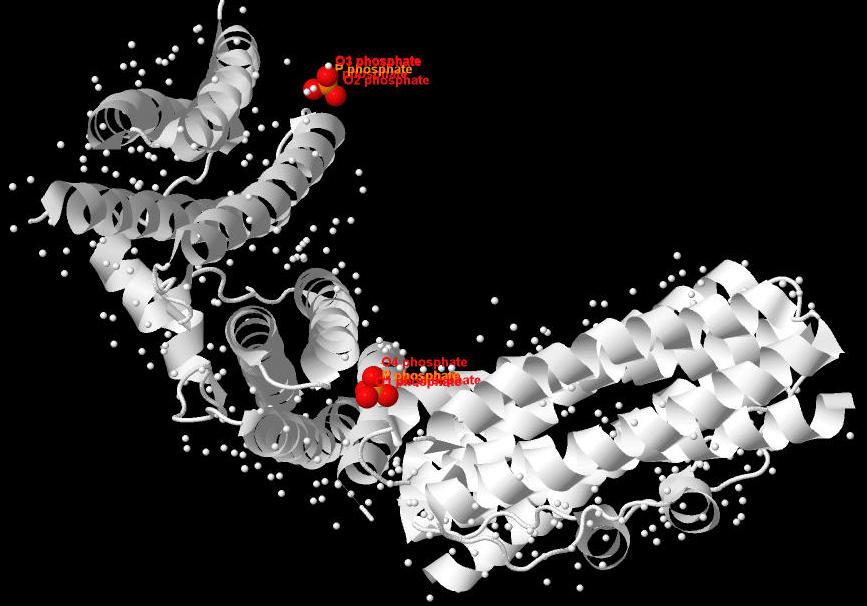 |
Рис.2 Структура CHP2 с выделенными красным цветом лигандами - фосфат-ионами. Белым цветом выделен белок. |
- Название на русском: металлозависимый ДНК-связывающийся регулятор ответа на стресс
- Название на английском: metalloregulation DNA-binding stress protein
- Количество разных цепей в PDB-файле: 4 (A, B, C, D)
- Молекулы, отличные от белка и воды: 2 остатка фосфорной кислоты (фосфат-ионы - PO43-). Их координаты можно найти в PDB-файле.
- Uniprot_AC: P37960
Анализ структуры альфа-спиралей и бета-листов в цепи A белка с кодом PDB 1JQA
В таблицах 1 и 2 представлены данные для 6 альфа-спирали белка с кодом PDB 1JQA. Альфа спираль начинается с серина и заканчивается глутаматом.
Шаг спирали вычислялся так: находилась длина спирали и делилась на количество витков в ней (21.68/4=5.42 Ангстрема). Для сравнения были найдены
условные расстояния между серединами витков спирали и найдено среднее арифметическое.(5.55 Ангстрем). Стоит отметить, что это значение близко
к
шагу идеальной альфа-спирали - 5.4 Ангстрема.
На виток спирали приходится, в среднем, 4 аминокислоты, что также близко по значению 3.7 для
идеальной спирали.
Для бета-листов расположение соседних тяжей может быть параллельным или антипараллельным, в зависимости от направления пептидных цепей.
Антипараллельное расположение более предпочтительно, поскольку в этом случае межцепочечные водородные связи ориентированы параллельно друг другу
и перпендикулярны оси симметрии бета-листа. В данном случае, тяжи расположены параллельно друг другу, что не является удачным,
однако они образуют винтовую неплоскую поверхность, что, возможно, облегчает их положение в пространстве.
Таблица 1. Значения параметров для альфа-спирали
| Параметры |
Шаг спирали |
Число остатков спирали на один виток |
С какими по номеру остатками образует водородные связи остаток с номером n, если он находится в середине спирали |
| Значение параметра |
Шаг спирали - в среднем равен 5.5 Ангстрем. (Это показано на рис.5 и рис.5.1) |
Число остатков спирали на один виток - 3.75. (Подробнее показано на рис.6) |
Остаток с номером n образует водородные связи с остатками, имеющими номер, кратный 4. (Это изображено на рис.7) |
Таблица 2. Значения параметров для бета-листа
| Параметр |
Наличие в листе параллельных и антипараллельных бета-тяжей
| Образует ли лист плоскую или вогнутую/выпуклую поверхность?
|
| Значение параметра |
В представленном на рис.3 и рис.3.1 есть только параллельные тяжи. Об этом говорит направление стрелок
(конец стрелки показывает альф-атом углерода конца бета-тяжа.)
| Лист образует выпукло-вогнутую винтовую поверхность.Это продемонстрировано на рис.3.1 и рис.3
|
 |
Рис.3 Бета-лист А из 6 бета-тяжей. Синим цветом выделены альфа-атомы углерода в этих тяжах, а
также синим цветом подписаны номера аминокислотных остатков и сами аминокислотные остатки. |
 |
Рис.3.1 Бета-лист А из 6 бета-тяжей. Синим цветом выделены альфа-атомы углерода в эт
также синим цветом подписаны номера аминокислотных остатков и сами аминокислотные остатки. Cерым цветом выделена остальная часть белка.
На этом изображении можно заметить, что бета-тяжи образую винтовую поверхность. |
 |
Рис.4 Структура 1JQA с выделенной 6 альфа-спиралью цепи А. Она показана на рисунке желтым цветом,
синим цветом подписаны аминокислотные остатки, которые стоят в начале и конце спирали. Серым цветом показан остальной белок.
|
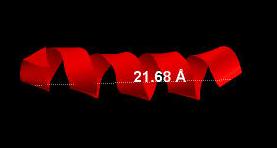 |
Рис.5 6 альфа-спираль в цепи А белка 1JQA. Показана длина спирали.
|
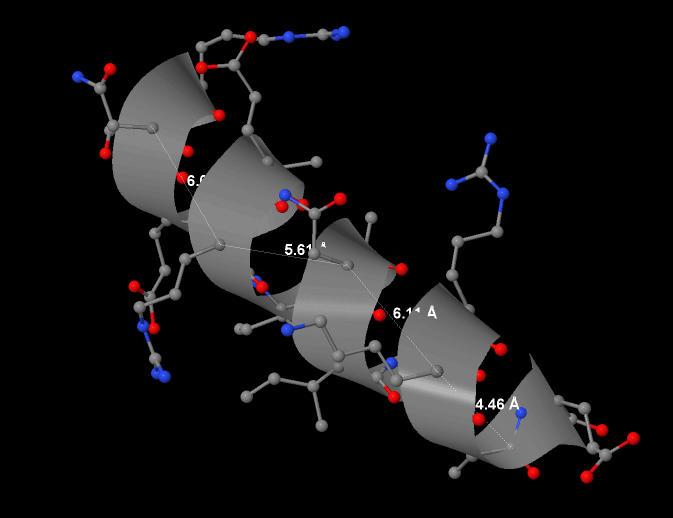 |
Рис.5.1 6 альфа-спираль в цепи А белка 1JQA. Показан шаг спирали.
|
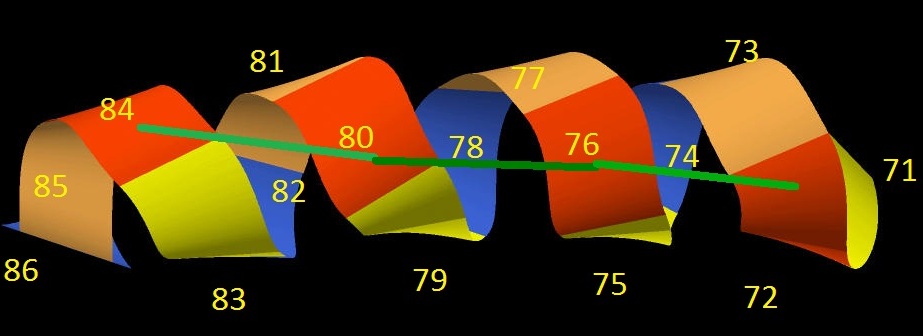 |
Рис.6 6 альфа-спираль в цепи А белка 1JQA. Различными цветами показаны каждые 4 аминокислотных остатка. Подписаны номера аминокислотных остатков.
Т.е. мы можем сказать, что в среднем 3.75 аминокислотных остатка приходится на один виток спирали, т.к. всего 15 аминоксислотных остатков приходится на 4 полных витка спирали. (16/4=4)
|
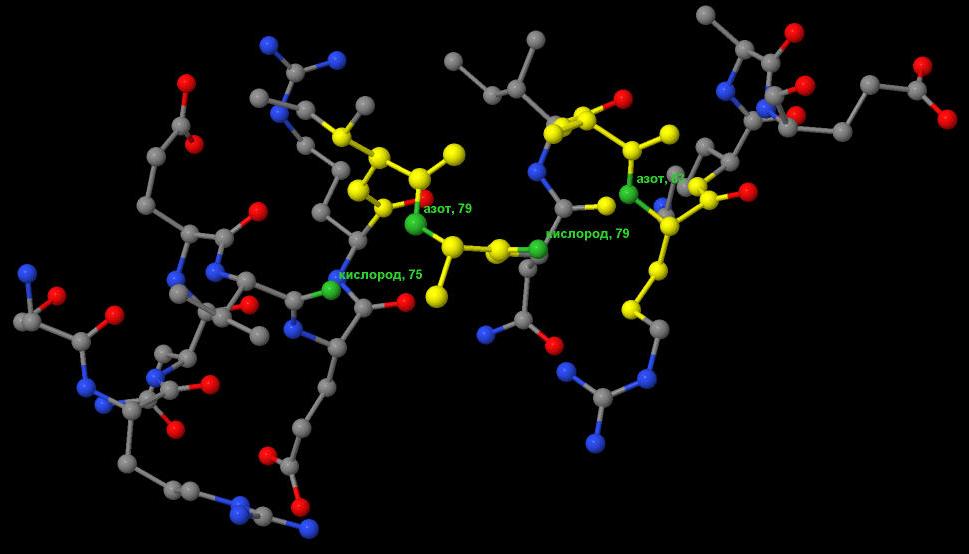 |
Рис.7 6 альфа-спираль в цепи А белка 1JQA. На этом изображении зеленым цветом выделены и
подписаны атомы азота и кислорода, между которыми образуется водородная связь, а также номер аминокислотного остатка, к которому они принадлежат.
|
Внутримолекулярные взаимодействия боковых групп белка в цепи A структуры 2CHP
- Дисульфидные мостики - ковалентная связь между двумя атомами серы, входящими в состав серусодержащей аминокислоты цистеина.
В молекуле белка CHP2 нет цистеиновых остатков, а значит в ней нет дисульфидных мостиков. Для поиска использовалась команда select Cys.
- Солевые мостики - связь между молекулами заряженных кислот. Отрицательно заряженые аминокислоты: глуматат, аспартат.
Положительно заряженные аминокислоты: аргинин, лизин, гистидин. Солевой мостик образуется между карбоксильной группой в радикале отрицательно
заряженных аминокислот и аминогруппой в радикале у положительно заряженных аминокислот. В цепи А данного белка обнаружено 3 солевых мостика между
аспартатом и лизином, между аспартатом и аргинином и между лизином и глутаматом (рис.9). Солевой мостик между глутаматом и лизином показан на рис.8.
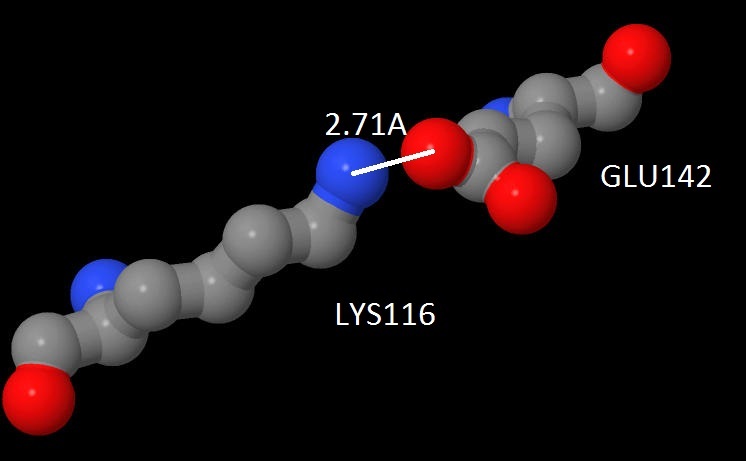 |
Рис.8 Солевой мостик в цепи А белка 2CHP. Синим цветом выделены атомы азота, красным - кислорода, серым углерода.
Между кислородом карбокисльной группы глутамата и концевой аминогруппой лизина показано расстояние.
|
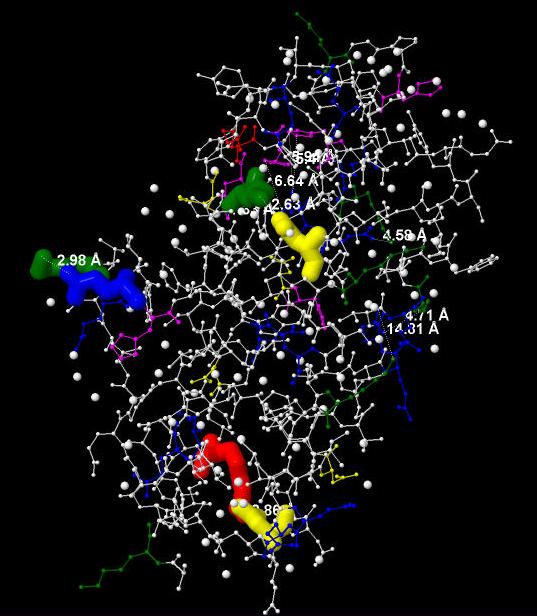 |
Рис.9 Цепь А с показанными на нем солевыми мостиками. Красным цветом показан аргинин, желтым - аспартат,
зеленым - лизин, синим - глутамат.
|
© Fedorova Alla, 2012










