| Главная | Семестры | Проекты | Заметки | О себе | Полезные ссылки |
Роль JAK1 в регуляции клеточных процессов
| Запрос | Запрос как его понял PubMed из Search details | Всего находок | Всего в открытом доступе | Всего обзоров |
| JAK1[Title] | JAK1[Title] | 180 | 91 | 3 |
| Tyrosine-protein kinase JAK1 | "janus kinase 1"[MeSH Terms] OR "janus kinase 1"[All Fields] OR ("tyrosine"[All Fields] AND "protein"[All Fields] AND "kinase"[All Fields] AND "jak1"[All Fields]) OR "tyrosine protein kinase jak1"[All Fields] | 1358 | 736 | 152 |
| (Tyrosine kinase of the non-receptor type) AND JAK1[Title] | (("protein-tyrosine kinases"[MeSH Terms] OR ("protein-tyrosine"[All Fields] AND "kinases"[All Fields]) OR "protein-tyrosine kinases"[All Fields] OR ("tyrosine"[All Fields] AND "kinase"[All Fields]) OR "tyrosine kinase"[All Fields]) AND non-receptor[All Fields] AND type[All Fields]) AND JAK1[Title] | 5 | 4 | 0 |
| (JAk1[Title]) AND (interferon-alpha/beta and -gamma signal transduction pathways[Title/Abstract]) | 8232552[uid] | 1 | 0 | 0 |
| (tyrosine phosphorylation) AND JAK1[Title] | (("tyrosine"[MeSH Terms] OR "tyrosine"[All Fields]) AND ("phosphorylation"[MeSH Terms] OR "phosphorylation"[All Fields])) AND JAK1[Title] | 72 | 40 | 1 |
| (tyrosine phosphorylation[Title]) AND JAK1[Title] | tyrosine phosphorylation[Title] AND JAK1[Title] | 9 | 5 | 0 |
Самый удачный запрос, на мой взгляд - tyrosine phosphorylation[Title] AND JAK1[Title].
Ссылка на коллекцию статей: Коллекция
Краткое описание статьи из PubMed.
Two Novel Protein-Tyrosine Kinases, Each with a Second Phosphotransferase-Related Catalytic Domain, Define a New Class of Protein Kinase
Два новых белка семейства тирозин-киназ, каждый из которых имеет второй фосфотрансферазный-связывающий каталитический домен. Определение нового класса белков киназ.
Белки-тирозин киназы (PTKs), благодаря своей структуре, хорошо подходят для роли в внутриклеточной передаче сигнала. Члены семьи PTKs тесно связаны между собой, т.к. имеют "каталитический" домен (активный центр). Два новых белка из этого семейства были обнаружены из комплементарной ДНК клеточной линии FDC-P1. Схожесть этих последовательностей в сочетании с наличием в каждой из них редких особенных частей привела к предположению , что эти две молекулы являются различными подсемействами PTKs. Они были названы Jak1 и Jak2.
Материалы и методы.
Скрининг библиотеки комплементарных ДНК с помощью ПЦР. В частности рассматривались библиотеки о мышиных NFS TPA-активированных клетках селезенки, о 3T3 фибробластах швейцарских альбиносов, клетках костного мозга мышей, эмбриональных клетках печени человека.
Секвенирование ДНК.Две стратегии были использованы для секвенирования JAK1 и JAK2. В случае с человеческой JAK1 был использован Erase-a-base kit from Promega *(специальный комплект для выполнения вложенных делеций для создания библиотеки фрагментов ДНК) для создания делеций большого фрагмента EcoRI. Все данные о последовательности мышиного JAK2 и остатков человеческого JAK1 были обнаружены с помощью использования олигонуклеотидных праймеров** основанных на предыдущих определенных последовательностях. В каждом случае информация о последовательности была изучена с помощью использования метода Сэнгера с дидезоксинуклеозидтрифосфатами.***
Northern (RNA) analysis - стандартный метод для обнаружения и количественного определения мРНК.
Белковый анализ. Анализ протеинкиназы. Первым этапом является экстракция мышиных фибробластов (для поддержания постоянства среды были использованы буферы - Triton X-100 or Nonidet P-40 (1.0%)). Клетки были извелечены в присутствии и ли отсутствии ингибиторов фосфатазы, таких как EDTA, NaF, Na2VO4. После имуннопреципитации (метод осаждения белка антигена с помощью антитела, которое специфически связывается с ним.)***** анализ был проведен с использованием различных концентраций АТФ. Инкубация была выполнена в течение 15 минут во льду. Также были безуспешно использован [_y-32P] GTP в качестве донора фосфата вместо [_y-32P] ATP.
Компьютерный анализ последовательности. Сравнение аминокислотных последовательностей производилось с помощью программы выравнивания.
JAK1 - широко экспрессируемый фосфопротеин, связанный с мембраной, с PTKs доменом. Характерной чертой членов PTKs является то, что они способны проводить само-фосфорилирование в пробирке. Несмотря на сходство последовательностей белков PTKs и JAK1, ученые не смогли продемонстрировать каталитическую активность тирозин-киназы в имуннопреципитате, взятой из человека и мыши. Причиной отсутствия активности может стать стерический эффект антител в активном сайте энзима. Функцией JAK1 является фосфорилирование белков, которое играет ключевую роль в регуляции внутриклеточных процессов. Это неудивительно, что у протеин-киназы развивалась определенная каталитическая активность. JAK2 имеет 2 каталитических фосфотрансферазных домена. В отношении эволюционного развития семейства белков, таких как семья JAK из РТК возможно два сценария, одним из которых является то,что обе киназы возникли в результате дублирования каталитического домена общих предков с последующей реконструкции одной из этих областей.
В связи с тем, что в статье оказалось мало информации про регуляторную функцию, я взяла еще одну статью.
A major role for the protein tyrosine kinase JAK1 in the JAK/STAT signal transduction pathway in response to interleukin-6
Главная роль JAK1 в пути сигнальной передачи в ответ на interleukin-6
IL-6 рецептор, связываясь, вызывает гомодимеризацию gp130, в то время как LIF, OSM and CNTF индуцируют gpl30 гетеродимеризацию со второй бета цепью LIFRP. В ответ на присоединение лиганда, эти рецепторы активируют количество сигнальных путей, включая те, которые используют JAKs и STATs. IL-6 gp130 субъединица рецептора активирует JAK1, JAK2 и Tyk2 иначе по сравнению с субъединицами рецептора других цитокинов, т.к. те, в свою очередь, могут быть охарактеризованы взаимодействием только с одним членом семьи.
Семейство белков JAKs связывается с IL-6 gp130 субъединицей рецептора, которая, как известно, фосфорилируется в ответ на IL-6. В соответствии с этим эта субъединица быстро фосфорилируется в ответ на IL-6 в диком типе клеток 2fTGH.
Такое фосфорилирование значительно снижается в присутствии JAKI (клетки U4A), но остается незатронутым в присутствии JAK2 или Tyk2. Это происходит потому, что JAK1 играет главную роль посредника в фосфорилировании субъединицы gp130 рецептора IL-6.
Тирозин киназы JAK1, JAK2 и Tyk2 являются конструктивно связанными с gp130 IL-6 субъединицей рецептора и активируют димеризацию рецептора в ответ на IL-6. Отсутствие одной из киназ не препятствует активации других. Активация, тем не менее, не вовлечена в трех-киназный каскад. Из всех них только присутствие JAK1 имеет значительное ингибиторное (тормозящее) влияние на фосфорилирование gp130, активацию STATs 1 и 3, индукцию IRFl мРНК в этих клетках. Киназа-отрицательная мутация JAKI не может восстанавливать ответ. Поэтому требуется активировать JAKI не только физическим присутствием JAK1. В каждом из возможных мутантов, тем не менее, 2 из 3х киназ активированы и взаимозаменяемость функций у димерных рецепторов не может быть исключена. Таким образом остается проверить, достаточно ли устойчив JAKI, чтобы давать достаточный ответ. Действительно, можно представить ряд моделей такой ситуации. Одна из таких моделей состоит в том, что JAK1 связывается с gp130 и вызывает дальнейшие события, но она требует JAK2 или Tyk2 для эффективной активации лиганд-индуцированной димеризации рецепторного комплекса. Априори JAK2 и Tyk2 могут связываться с такими же или особыми областьям рецептора JAKI или даже с самим белком.
Материалы и методы.
Клеточная культура и трансфекция ДНК
(процесс введения нуклеиновой кислоты в клетки человека и животных невирусным методом)
Все клетки были выращены в среде, разработанной Harry Eagle и модифицированной Dulbecco, с добавлением 10% инактивированной сыворотки печени теленка и 5мМ раствора L-глатамина, и производные мутантных клеточных линий поддерживались в гидромицине (250мкг/мл)
Антитела
Кроличья моноклональная (моноспецифичная) сыворотка была использована против JH2 домена JAK1, JHI домена JAK2 и аминокислот с номерами остатков 289-450 Tyk2. Термин 'моноклональная колония' означает, что она выработана идентичными имунными клетками, которые являются клонами единственной родительской клетки.
Иммунопреципитация
(техника выделения белка антигена, основанная на том, что антитело селективно связывается с выделяемым белком)
Анализ киназы в пробирке
Промывание полученных киназ в лизирующем буферном растворе, в 50 mM NaCl, 5 mM MgCl2, 5 mM MnCl2, 0.1 mM Na3VO4, 10 mM HEPES.
Метод сдвига электрофоретической подвижности
(общая техника электрофореза для изучения взаимодействий ДНК-белок или РНК-белок.)
Анализ защиты от РНКазы.
(специфический, чувствительный метод для качественного определения содержания определенной мРНК.)
Было установлено, что JAK/STAT путь является существенным для IL-6 ответа индукции IRFI (интерферон регуляторный фактор) mRNA. Кроме того, основная роль JAK1 состоит в фосфорилировании gpl30 в ответ на IL-6, что подтверждает то, что JAKs могут играть более значимую роль в IL-6 ответе.
Источники информации:
*Promega-s-Erase-a-base-System
**Праймер (англ. primer) - это короткий фрагмент нуклеиновой кислоты (олигонуклеотид), комплементарный ДНК- или РНК-мишени, служит затравкой для синтеза комплементарной цепи с помощью ДНК-полимеразы, а также при репликации ДНК.
***Обычно до начала секвенирования производят амплификацию участка ДНК, последовательность которого требуется определить, при помощи ПЦР. Секвенирование полного генома обычно осуществляют при помощи технологий Next-generation sequencing.
****Northern-analysis
*****Immunoprecipitation
Активация и регуляция JAK-STAT сигнального пути.
Была использована статья из PubMed: Mast cell homeostasis and the JAK-STAT pathway
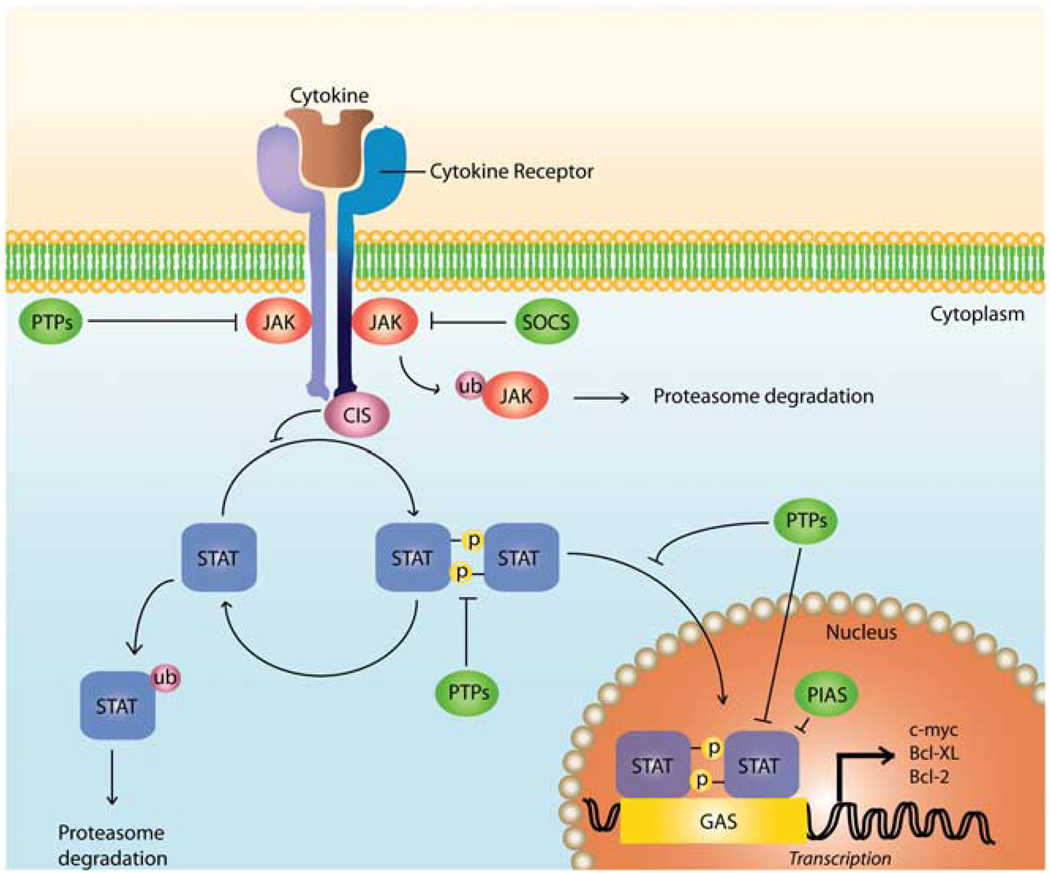
Рис.1. Сигнальный каскад JAK-STAT.
Цитокин связывается со специфичными поверхностными рецепторами, которые вызывают димеризацию рецептора и в результате активацию JAK c последующим фосфорилированием определенных остатков тирозина на расположенном в цитоплазмической области рецепторе цитокина. Фосфорилированные остатки тирозина служат как связочные сайты для STATs. Единожды в STATs фосфорилируются определенные остатки тирозина с помощью JAKs, которые позволяют белкам димеризоваться. STAT гомодимеры или гетеродимеры переходят (транслоцируются) в ядро, в котором они узнают специфичные последовательности такие, как гамма-активирующие последовательности. Единственные среди транскрипциональных ко-активаторов и энхансеров, STATs активирует транскрипцию генов-мишеней. Многие правила контроля существуют в JAK-STAT пути, такие как белковые ингибиторы активированной STATs и фосфорилированных остатков тирозина. PIAS белки могут мешать связыванию STAT с ДНК или может действовать как транскрипциональные корепрессоры с помощью их взаимодействия с гистонами диацетилазами. STAT связывается с убиквитином и деградирует (протеолитическая деградация).(Рис.1)
Конкретизируем данную информация для JAK1, используя информацию из других источников: Inhibition of host JAK1 by virus и Blocking of the alpha interferon-induced Jak-Stat signaling pathway by Japanese encephalitis virus infection.
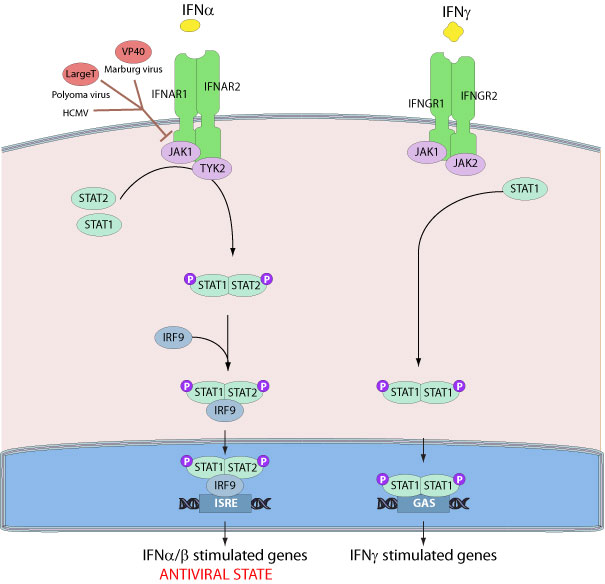
Рис.2. Интерферон альфа/гамма сигнальный путь.
JAK1 участвует в интерферон-альфа/бета и -гамма сигнальном пути.(Рис.2) JAK1 и TYK2 участвуют в интерферон-альфа/бета сигнальном пути, а JAK1 и JAK2 играют роль в интерферон-гамма пути. Цитокин IFN-alpha связывается с рецептором, состоящим из IFNAR1 и IFNAR2. Происходит активация JAK1 и TYK2 с последующим фосфорилированием определенных остатков тирозина на расположенном в цитоплазмической области рецепторе цитокина IFN-alpha. Затем в STAT1 и STAT2 фосфорилируются определенные остатки тирозина, что приводит к образованию гетеродимера, который связывается с IRF-9 , формируя мультимерный транскрипциональный фактор ISGF3. ISGF3 связывается с IFN-стимулирующим ответным элементом (ISRE) IFN-стимулирующих генов (ISGs) в ядре и активирует их транскрипцию. IFNs может производить синтез более чем 300 клеточных белков, включающих ферменты, сигнальные белки, хемокины, белки-антигены, транскрипционные факторы, heat shock белки и белки апоптоза. Из них лучше всего характеризующий антивирусную функцию IFN характеризует двух-цепочный РНК-активирующий белок киназа (PKR).
В случае гамма-сигнального пути цитокином является IFN-гамма, рецептор, с которым он связывается, состоит из 2 цепей - IFNGR1 и IFNGR2. Далее происходит активация JAK1 и JAK2 . Еще 2 отличия - образование в результате фосфорилирования гомодимера STAT1 и стимулирующего ответного комплекса в ядре - GAS.
Альфа/бета интерфероны (IFN) непосредственно выделяются большинством клеток в ответ на вирусные инфекции и играют ключевую роль в первой линии защиты у млекопитающих. Поэтому чтобы начать репликацию, вирусы создают всевозможные стратегии, чтобы обойти ответ IFN.
Таким образом, этот сигнальный путь активируется в ответ на вторжение вирусов.
Из статьи Defective interleukin-12/interferon-gamma pathway in patients with hyperimmunoglobulinemia E syndrome:
Нарушение пути интерлейкин-12/интерферон-гамма у пациентов с синдромом гипериммуноглобулинемии Е.
У пациентов с синдромом гипериммуноглобулинемии Е[1], как сообщается, были выявлены нарушения продукции интерферона-гамма. Поскольку IFN-гамма является главным активатором полиморфоядерных лейкоцитов (PMNs), это мого привести к нарушению PMN хемотаксиса и заметному повышению lgE уровня, из-за единственного действия IL-4. IL-12, важный энхансер IFN-гамма образования, также подавляет производство lgE.
[1] Заболевание характеризуется развитием холодных (из-за отсутствия нормальной воспалительной реакции) абсцессов кожи и подкожной клетчатки, лимфоузлов, повторными гнойными отитами с холодным течением. Часто у больных наблюдается хроническая экзема. Названные симптомы развиваются из-за нарушения хемотаксиса нейтрофилов, повышенного высвобождения под влиянием гиперпродукции IgЕ из тучных клеток гистамина, который блокирует развитие воспаления и хемотаксис нейтрофилов.