| Главная | Семестры | Проекты | Заметки | О себе | Полезные ссылки |
Задание 1. Сравнительная характеристика ортологов белка mrga_bacsu
| Заголовок | ||||
| Метка поля | Содержание | |||
| Для своего белка | Для ортолога 1[1] | Для ортолога 2[2] | ||
| Идентификатор записи | ID | MRGA_BACSU (SwissProt) | A7Z8L5_BACA2(TrEMBL) | Q65F57_BACLD(TrEMBL) |
| Код доступа первый ("Accession number") | AC | P37960 | A7Z8L5 | Q65F57 |
| Код(ы) доступа остальные) | AC | Secondary accession number(s): Q62QM2 | ||
| Дата создания документа | DT | October 1, 1994 (integrated into UniProtKB/Swiss-Prot) | October 23, 2007 | October 25, 2004 |
| Дата последнего исправления аннотации | DT | January 9, 2013(entry version 91) | January 9, 2013 | February 6, 2013 |
| Название (краткое описание) белка | DE | Metalloregulation DNA-binding stress protein | MrgA | Metalloregulation DNA-binding stress protein; Metalloregulation DNA-binding stress protein MrgA; |
| Название организма | OS | Bacillus subtilis (strain 168) | Bacillus amyloliquefaciens (strain FZB42) | Bacillus licheniformis (strain DSM 13 / ATCC 14580) |
| Таксономия | OC | Bacteria; Firmicutes; Bacilli; Bacillales; Bacillaceae; Bacillus | Bacteria; Firmicutes; Bacilli; Bacillales; Bacillaceae; Bacillus | Bacteria; Firmicutes; Bacilli; Bacillales; Bacillaceae; Bacillus |
| Название гена и синонимы | GN | Name=mrgA; OrderedLocusNames=BSU32990 | Name=mrgA; EMBL ABS75341. Ordered Locus Names=RBAM_030100 | Name=mrgA; EMBL AAU42307. Ordered Locus Names=BL00751, BLi03480 |
| Номер публикции | RN | [1] | [1] | [1] |
| Автор(-ы) публикации | RA | Chen L., James L.P., Helmann J.D | Chen X.H., Koumoutsi A., Scholz R., Eisenreich A., Schneider K., Heinemeyer I., Morgenstern B., Voss B., Hess W.R., Reva O., Junge H., Voigt B., Jungblut P.R., Vater J., Suessmuth R., Liesegang H., Strittmatter A., Gottschalk G., Borriss R. | Rey M.W., Ramaiya P., Nelson B.A., Brody-Karpin S.D., Zaretsky E.J., Tang M., Lopez de Leon A., Xiang H., Gusti V., Clausen I.G., Olsen P.B., Rasmussen M.D., Andersen J.T., Joergensen P.L., Larsen T.S., Sorokin A., Bolotin A., Lapidus A. |
| Название публикации | RT | "Metalloregulation in Bacillus subtilis: isolation and characterization of two genes differentially repressed by metalions." | "Comparative analysis of the complete genome sequence of the plant growth-promoting bacterium Bacillus amyloliquefaciens FZB42. | "Complete genome sequence of the industrial bacterium Bacillus licheniformis and comparisons with closely related Bacillus species." |
| Журнал | RL | J. Bacteriol.(1993) [MEDLINE]=93374837;[PubMed=8396117] 175:5428-5437 |
Nat. Biotechnol.(2007) [PubMed=17704766] 25:1007-1014 |
Genome Biol.(2004) [PubMed: 15461803] 5:R77.1-R77.12 |
| Чем обосновано существование белка | PE | Evidence at protein level (известно много данных о белке) | Inferred from homology ( | Inferred from homology |
| Ссылка (-и) на базу 3D структур PDB | DR | PDB; 2CHP; X-ray; 2.00 A; A/B/C/D=1-153. | Отсутствует | Отсутствует |
| Ответы на некоторые вопросы о белках | |||
| Какой функции этого белка посвящена одна из статей, упомянутых в записи? [3] | Постоянное поддержание уровня ионов железа в клетке, регуляция экспрессии гена в ответ на изменение количества ионов металла: сенсорная функция - определение содержания ионов метала и эфективная функция - служит связующим звеном в процесах транскрипции и трансляции. | Функции совпадают с mrga_bacsu | Функции совпадают с mrga_bacsu |
| Последовательности большинства белков начинаются с метионина. Почему? После биосинтеза в процессе созревания белка метионин может быть удален. Указан ли метионин в начальной позиции заданного белка? А удаляется ли он потом? | Кодон AUG кодирует метионин, но одновременно служит стартовым кодоном - с первого AUG-кодона мРНК как правило начинается трансляция. В начальной позиции метионин указан. Но удаляется ли он потом или нет - информации не найдено. | В начальной позиции метионин указан | В начальной позиции метионин указан |
| Какие ионы связываются с белком? | Ион железа: Fe(III) | Fe(III) | Fe(III) |
| Какие аминокислотные остатки Вы бы стали модифицировать, чтобы изменить характер связывания металла с белком? | Полагают, что металлы связываются с белками главным образом через остатки гистидина, содержащего имидазольное кольцо, и цистеина, имеющего боковую сульфгидрильную группу.[5] Проверим, есть ли такие аминокислотные остатки в белке с помощью программы JMol, получаем, что белок не содержит цистеин вообще, но содержит гистидин. Согласно статье, посвященной другому виду рода Bacillus - Bacillus anthracis со сходной функцией - связывания ионов железа: [6]можно попробовать предположить, какие аминокислотные остатки могут связывать металл. Получим это с помощью программы JMol: Рисунок 1Расстояние между атомами азота позволяет предположить ковалентные взаимодействия с ионами металла. Таким образом, можно модифицировать остатки His35 и His47, чтобы изменить характер связывания металла с белком. | Структура PDB не найдена, однако мы можем предположить сходность свойств, проанализировав аминокислотную последовательность. Возпользуемся командой stretcher пакета EMBOSS: stretcher a.fasta m.fasta result1.stretcher -auto, где a.fasta - файл с последовательностью белка A7Z8L5_BACA2 , m.fasta - файл с последовательностью белка MRGA_BACSU, а файл result1.stretcher - полученное парное выравнивание. Проанализировав его, получим, что последовательности похожи, положение гистидинов - сходно, т.е. мы можем предположить, что связывание ионов металла происходит аналогичным образом, а значит изменять нужно аналогичные остатки гистидина. | Структура PDB не найдена. Сравним аминокислотные последовательности с помощью команды stretcher q.fasta m.fasta result2.stretcher -auto. Результатом будет файл: result2.stretcher Заметим аналогичную ситуацию, что и с белком A7Z8L5_BACA2 |
| Получите последовательность 2-й альфа-спирали, используя команду seqret пакета EMBOSS. | С помощью команды seqret sw:mrga_bacsu second_helix.fasta -sbegin 43 -send 70 Файл:Последовательность 2-й альфа спирали |
Т.к. нет данных по структуре белка, мы можем только предположить по сравнению аминокислотных последовательностей, что альфа-спирали идентичны. Воспользуемся командой: seqret trembl:A7Z8L5_BACA2 second1_helix.fasta -sbegin 43 -send 70. Полученный файл: second1_helix.fasta | Т.к. нет данных по структуре белка, мы можем только предположить по сравнению аминокислотных последовательностей, что альфа-спирали идентичны. Воспользуемся командой: seqret trembl:Q65F57_BACLD second2_helix.fasta -sbegin 43 -send 70. Полученный файл: second2_helix.fasta |
| Какие участки белка (напишите номера аминокислотных остатков) участвуют в связывании лиганда? Какого? | 42 и 45 аминокислотный остаток. Лиганд - фосфат ион.[7] | Просматривая выравненные последовтельности, обнаружим, что 42 и 45 остатки совпадают. Мы можем предположить наличие лиганда фосфат-иона, который связывается с именно этими остатками. | Просматривая выравненные последовательности, обнаружим, что остатки с номером 45 - совпадают, а остатки с номером 42 не совпадают, из чего мы может сделать вывод, что либо связывание лиганда не происходит, либо происходит с помощью других аминокислотных остатков. |
У белков несколько различается аминокислотная последовательность. Поэтому мы не можем однозначно определить такие моменты, как связывание белка с лигандом, т.к. для одного белка соответствующие аминокислотные остатки не совпадают. Про ортологов известно меньше информации. (нет структуры в pdb, из-за этого положение вторичных структур можно определить лишь по аналогии, кроме того, они описаны в UniProtKB/TrEMBL, значит информация может быть неточной)
Задание 2. Число предполагаемых ортологов белка в базах данных Swissprot и TrEMBL.
Запросы выдают результаты, которые пересекаются в одном белке - Q65F57_BACLD.
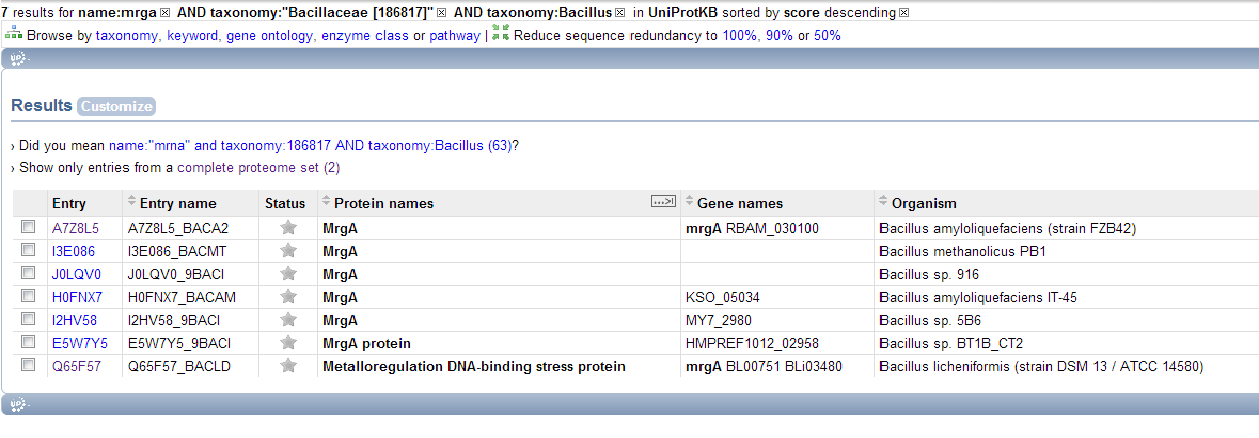
1)name:"mrga" and taxonomy:186817 AND taxonomy:Bacillus
2)name:"Metalloregulation DNA-binding stress protein" taxonomy:186817 AND taxonomy:Bacillus
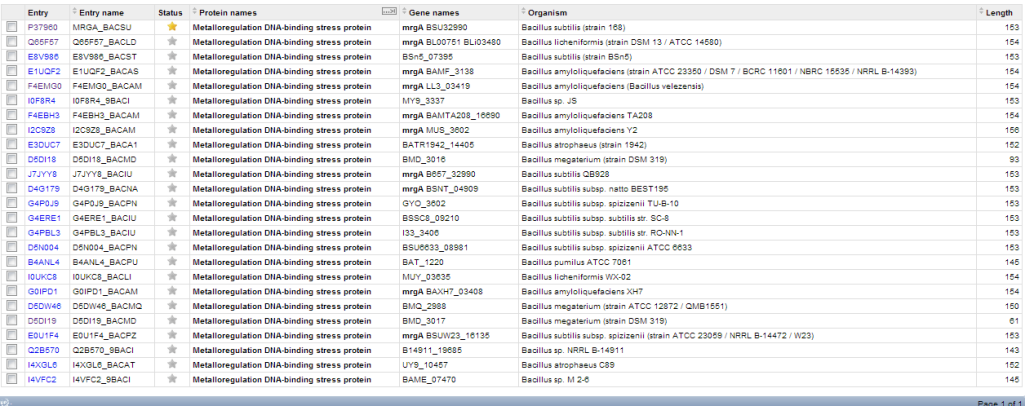
Суммарно выдан 31 белок. (по первому запросу - 7, по второму - 25, 1 - общий.)
Запросы выдает белки только с полностью известным протеомом:
1)name:mrga AND taxonomy:186817 AND taxonomy:bacillus AND keyword:181
Получено 2 белка. (A7Z8L5_BACA2 и Q65F57_BACLD)
2)name:"metalloregulation dna binding stress protein" AND taxonomy:186817 AND taxonomy:bacillus AND keyword:181
Получено 9 белков. (1 повторяется с предыдущим запросом). Итого с известным протеомом выдано 10 белков.
Запрос (name:"metalloregulation dna binding stress protein" AND taxonomy:186817 AND taxonomy:bacillus AND keyword:181) AND reviewed:yes выдает всего один белок, которые находится в UniProtKB/Swiss-Prot. (MRGA_BACSU)
Запрос (name:"metalloregulation dna binding stress protein" AND taxonomy:186817 AND taxonomy:bacillus AND keyword:181) AND reviewed:no выдает 8 белков, которые содержатся в UniProtKB/TrEMBL.
Все белки, выданные при запросе name:"mrga" and taxonomy:186817 AND taxonomy:Bacillus содержатся в UniProtKB/TrEMBL.
К сожалению, большинство белков не изучены полностью, т.к. содержатся в UniProtKB/TrEMBL, где полученная информация обрабатываетмя механически, с помощью компьютера, а значит может быть неточной или неверной. Всего 1 белок наиболее изучен - MRGA_BACSU. Что же значит complete proteom? При поиске белков возникает опция: "Показать только записи из полного набора протеома". Протеом - это все белки, которые экспрессируются в организме. [8]Complete proteom означает, что представлены белки тех организмов, чьи геномы полностью секвенированы (известны).
В результатах запроса представлены белки, которые имеют как название Metalloregulation DNA-binding stress protein, так и просто mrgA. Также различны названия генов, которые отвечают за белок.
Задание 3. Оперон, в который входит ген белка и описание его структуры.
Оперон - участок ДНК, транскрипция которого осуществляется на одну молекулу информационной РНК под контролем одного специального белка-регулятора. В состав оперона прокариот входят структурные гены и регуляторные элементы: промотор - участок связывания фермента, осуществляющего транскрипцию ДНК - РНК-полимеразы, является местом начала транскрипции; оператор - участок связывания регуляторного белка; терминатор - участок в конце оперона, сигнализирующий о прекращении транскрипции.
Оперон не найден в базе оперонов. Использовался поиск с такими данными, как название продукта (Metalloregulation DNA-binding stress protein), синоним гена (BSU32990), название организма (Bacillus Subtilis), название гена (mrga).
Ниже представлено графическое изображение генов в геноме Bacillus Subtilis, в частности расположение гена mrgA. Изображение получено с помощью базы геномов NCBI в режиме Graphics.[9] Слева расположен ген yusZ (short chain dehydrogenase), справа - ген htrB (HtrA-like serine protease).
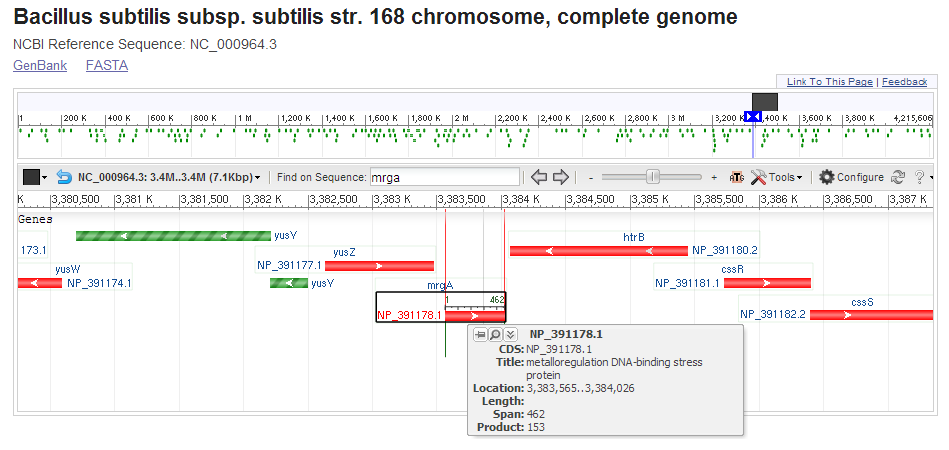 Графическое изображение генов в геноме Bacillus Subtilis. Показано расположение гена mrgA, экспрессирующего Metalloregulation DNA-binding stress protein.
Графическое изображение генов в геноме Bacillus Subtilis. Показано расположение гена mrgA, экспрессирующего Metalloregulation DNA-binding stress protein.*Ген найден таким образом: открываем Tools, выбираем Search, пишем в поле mrga.
[1]-Статья о A7Z8L5_BACA2 в UniProtKB/TrEMBL
[2]-Статья о Q65F57_BACLD в UniProtKB/TrEMBL
[3]-Статья в Pubmed: "Metalloregulation in Bacillus subtilis: isolation and characterization of two genes differentially repressed by metal ions. Page1"
[4]-Статья в PubMed: Metalloregulation in Bacillus subtilis: isolation and characterization of two genes differentially repressed by metal ions. Page 4"
[5]-Сайт Xumuk.ru
[6]-Structure of Two Iron-binding Proteins from Bacillus anthracis
[7]-Структура 2СHP в PDB
[8]-Uniprot/FAQ
[9]-База геномов NCBI
Ссылки на файлы с информацией о белках, полученные командой entret:
A7Z8L5_BACA2
Q65F57_BACLD
MRGA_BACSU