| Главная | Семестры | Проекты | Заметки | О себе | Полезные ссылки |
1. Описание структуры белка 1Y44.
- Кристаллографические характеристики
- Разрешение - 2.1 Ангстрема
- длины направляющих векторов кристалла: a=42.980 b=188.330 c=177.910
- углы между ними: α=90.00 β=90.00 γ=90.00
- кристаллографическая группа: C2221, группа с ромбической сингонией
- число молекул в ячейке: 16
С помощью команды symexp получим изображение с расположением белков в кристалле (рис.1). Розовым покрашена цепь а, фиолетовым - цепь b. Также показана ячейка (зеленым).
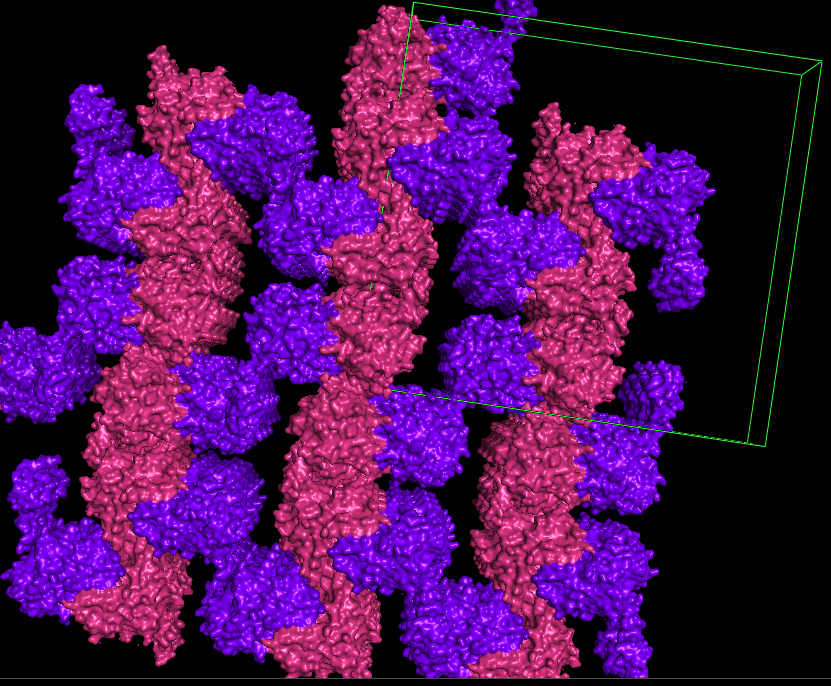
Рис. 1. Изображение части кристалла.
Далее рассмотрим взаимодействия исходной молекулы с ее соседями. С помощью команды distance найдем взаимодействия (водородные связи) на расстоянии менее чем 3.5 Ангстрема. На рис.2 показаны 4 молекулы белка, голубым - исходная, розовым - восстановленные соседи. Красным выделены взаимодействующие остатки. Таким образом, существует 2 типа контактов молекул друг с другом (остальные - симметричны). Рассмотрим их подробнее ниже.
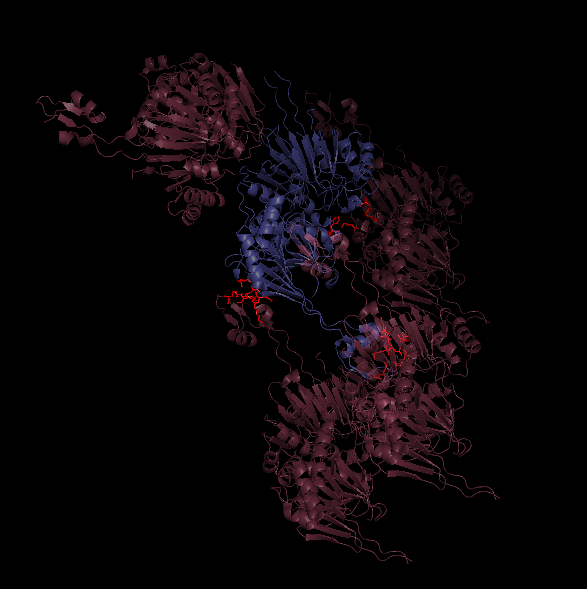
Рис. 2. Обзор возможных контактов 1Y44 с соседями.
Первый контакт изображен на рис. 3 (общий вид, взаимодействие остатков цепей b, они показаны зленым цветом для исходной молекулы и желтым для симметричной, остатки - синим) и рис.4 (подробнее, голубым цветом показаны остатки для исходной молекулы, для симметричной - красным).
Второй контакт изображен на рис.5 (общий вид, взаимодействие остатков цепи а и b) и рис.6 (подробнее, фиолетовым показан остаток цепи b, красным - цепи a.) Данные по взаимодействующим остаткам занесены в таблицу 1.
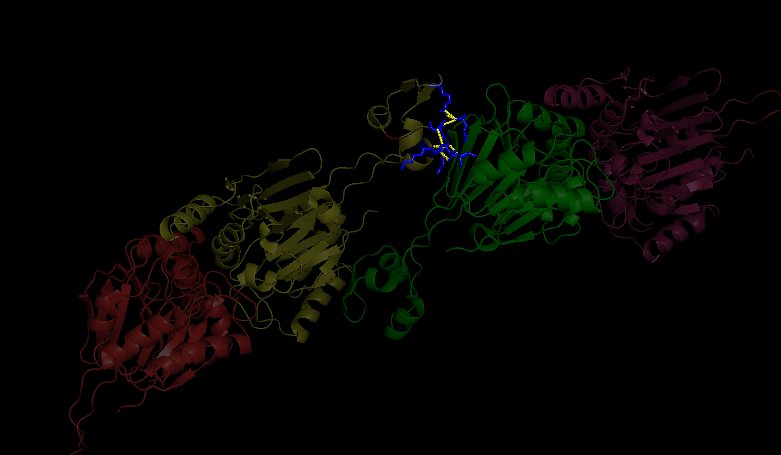 Рис.3. Общий вид контакта 1. |
 Рис. 4. Подробный вид контакта 1. |
 Рис. 5. Общий вид контакта 2. |
 Рис.6. Подробный вид контакта 2. |
| GLU165 | GLU220 |
| LYS217 | MSE166, ARG189 |
| LYS164 | GLU220 |
| ASN167 | GLU220 |
| LEU221 | GLU165 |
| PHE81 | LYS240 |
Рассмотрим гидрофобные взаимодействия. На рис. 7 показаны молекулы с выделенными гидрофобными остатками (основная - желтым цветом, соседи - голубым, гидрофобные остатки - красным). Можно заметить, что межмолекулярные гидрофобные контакты не развиты, в отличие от внутримолекулярных.
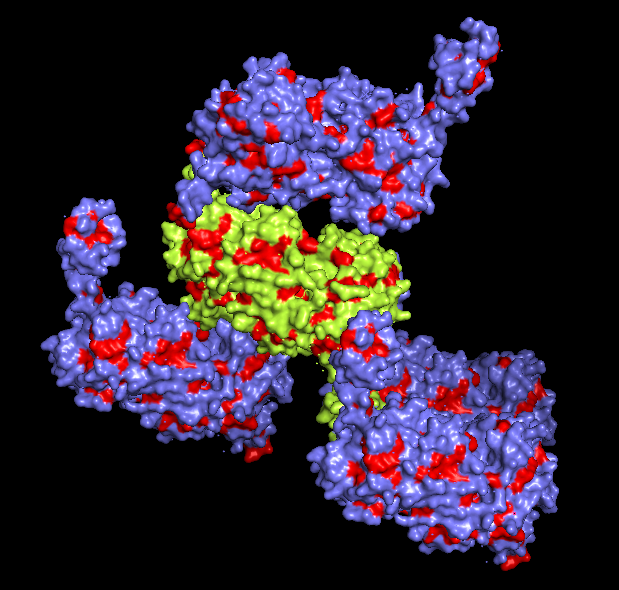
Рис. 7. Гидрофобные взаимодействия.
Выводы
Таким образом, можно сказать, что для более полноценного изучения структуры белка, необходимо изучать не одну единичную молекулу, а несколько взаимодействующих молекул в кристалле. Можно также предположить, что хоть и немногочисленные гидрофобные взаимодействия могут участвовать в олигомеризации белка. Были были также получены представления о водородных взаимодействиях между молекулами и свойство симметрии в кристалле.
2. Описание ДНК-белкового комплекса 3HDD.
3HDD представляет собой ДНК-белковый комплекс гомеодомена с разрешением 2.2 Ангстрема. На рис.8 приведена структура, где ДНК покрашена в синий и розовый цвета, а две белковые цепи (а и b) покрашены в красный. Удивительным является то, что одна из цепей (b) находится почти на краю ДНК. Для того, чтобы понять расположение ближайших соседей и проследить взаимодействия остатков аминокислот с ДНК, была использована команда symexp. На рис.9 показана выдача этой команды - синим выделена ДНК, красным - цепь а, розовым - цепь b. Также показана ячейка (зеленым).
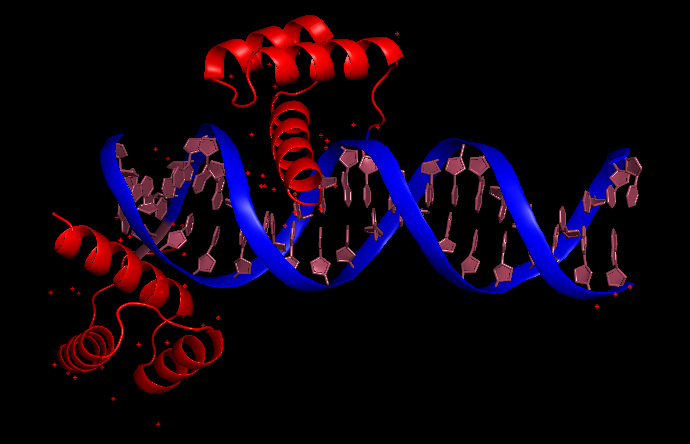
Рис.8 Структура 3HDD.
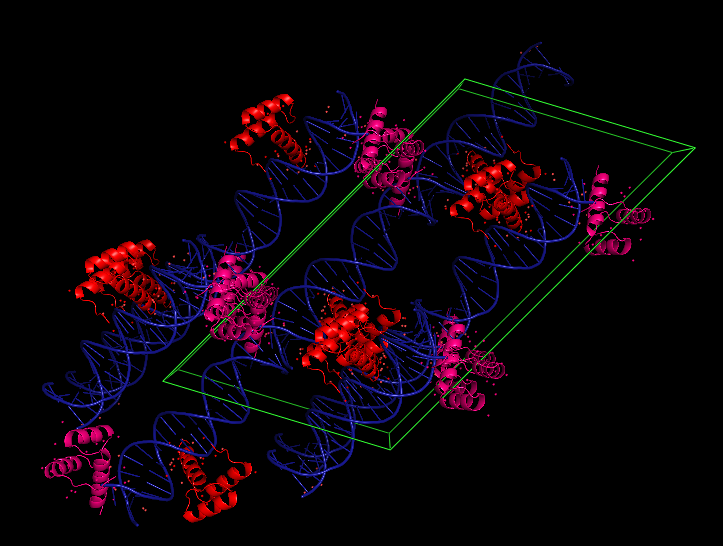
Рис.9 Восстановление молекул из соседних ячеек.
Попробуем выяснить с помощью каких остатков происходит взаимодействие. Поищем возможные водородные связи (на расстоянии до 3.5 Анстремов) от белковой цепи b до остатков ДНК при помощи команды distance. Таким образом, находим взаимодействующие остатки (приведены в табл.2). Общий вид приведен на рис.10, более подробные изображения на рис.11 и рис.12 (основания ДНК выделены розовым, остатки белка - зелным).
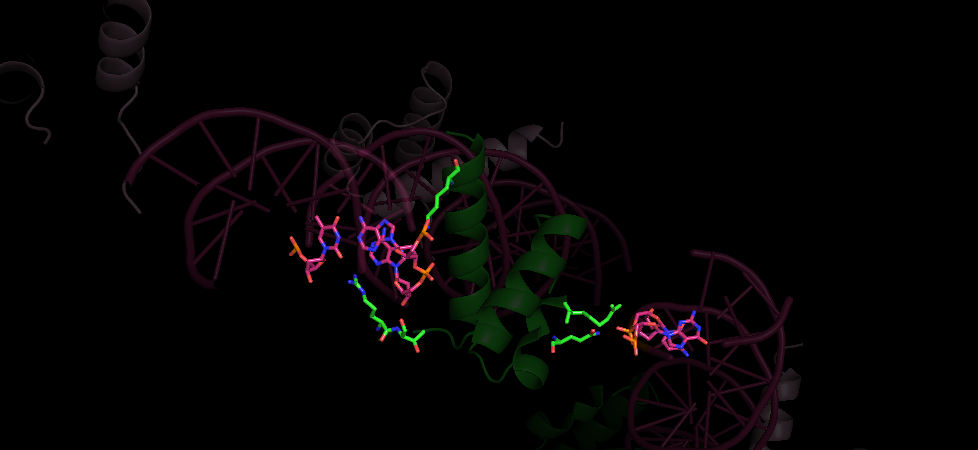
Рис.10 Общий вид расположения контактов.
 Рис.11 Подробное расположение контакта. |
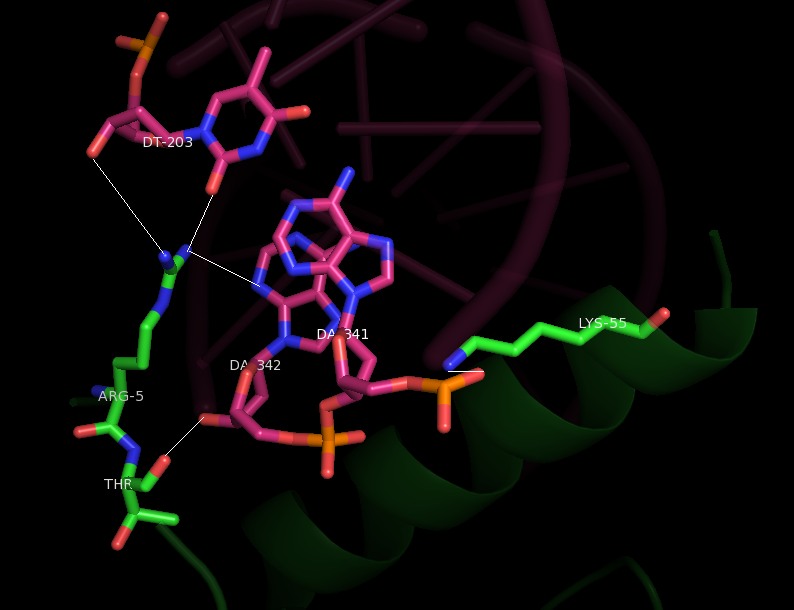 Рис.12 Подробное расположение контакта. |
| Остатки цепи В | Остатки цепи ДНК |
| GLN33 | DG205 |
| ARG29 | DC206, DG205 |
| ARG5 | DA342, DT203 |
| THR6 | DA342 |
| LYS55 | DA341 |
Таблица 2. Список взаимодействующих остатков белка и оснований ДНК.
Выводы
Таким образом, можно сказать, что подобные странности из разряда "цепь белка неестественным образом лежит на конце ДНК" нельзя объяснить только лишь изучением одной асимметрической единицы. Обязательно наобходимо восстанавливать симметрично лежащие комплексы из соседних ячеек кристалла. Только так можно объяснить столь странное положение цепи b.