| Главная | Семестры | Проекты | Заметки | О себе | Полезные ссылки |
1. Выбор белка для работы.
Для выполнения заданий был выбран белок – рибонуклеаза Z с pdb-идентификатором 1y44 и разрешением 2.1Å. Белок выбирался в соответствии с требованиями:
- Сервис EDS знает PDB-код.
- В PDB есть ссылочка на экспериментальные данные (structure factors).
- Наличие не менее 5 структурных гомологов с 50%< N_align<90% и RMSD>1. Например: 2cbn , 3zwf, 1zkp, 1ww1, 2e7y, 3py5, 3md7.
2. Построение изображения электронной плотности вокруг полипептидной цепи.
На представленных ниже рис. 1, 2, 3 с разной степенью подрезки представлено наложение электронной плотности на полипептидную цепь.
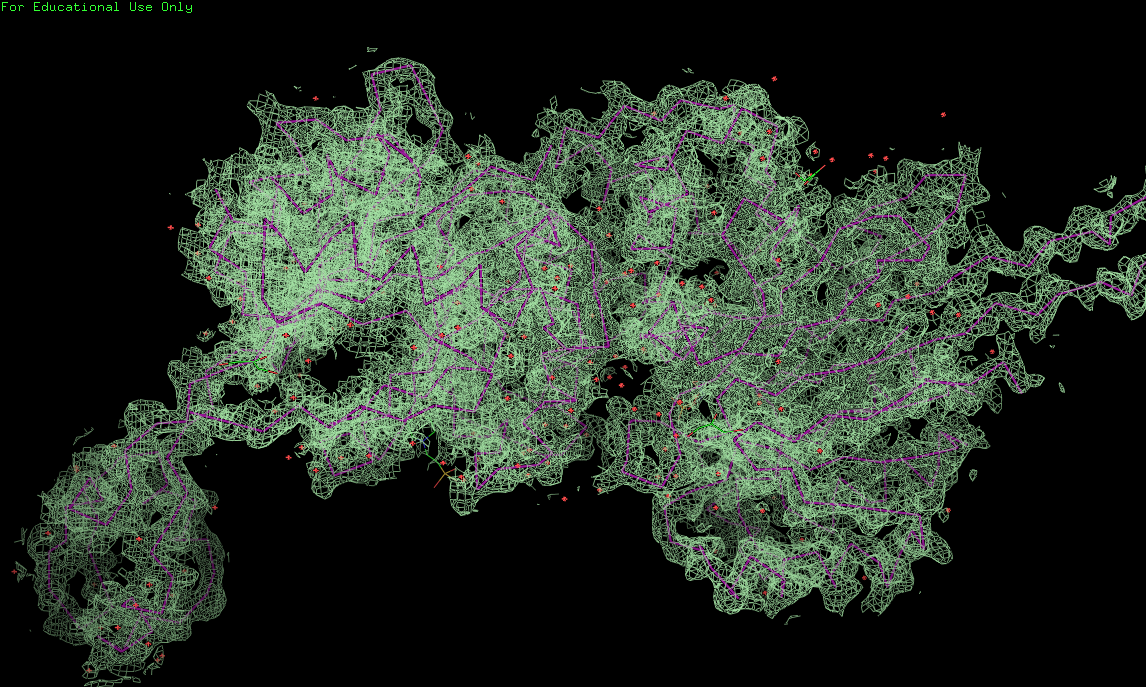
Рис.1. Электронная плотность с 1σ (carve=2Å)
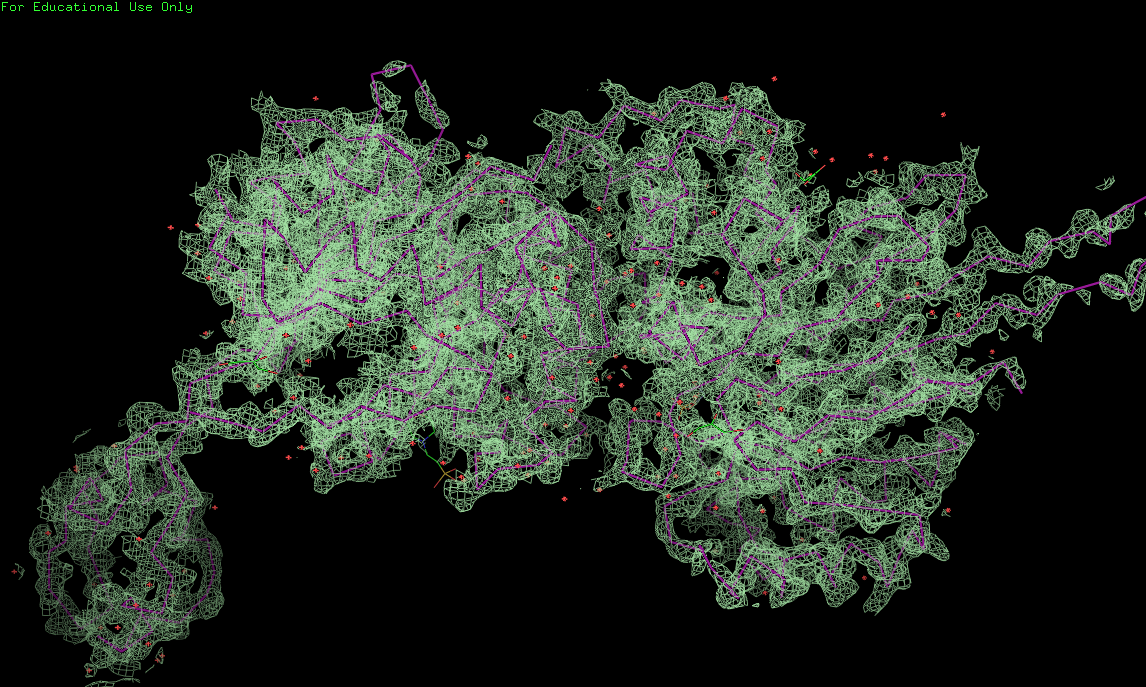
Рис.2. Электронная плотность с 1.5σ (carve=2Å)

Рис.3. Электронная плотность с 2σ (carve=3Å)
3. Построение изображений электронной плотности вокруг 3 аминокислотных остатков.
Ниже на рис. 4,5,6 изображено наложение электронной плотности на 3 последовательных остатка с разной степенью подрезки. Можно заметить, что далеко не все атомы имеют хорошее покрытие, это говорит о недостаточном разрешении структуры.
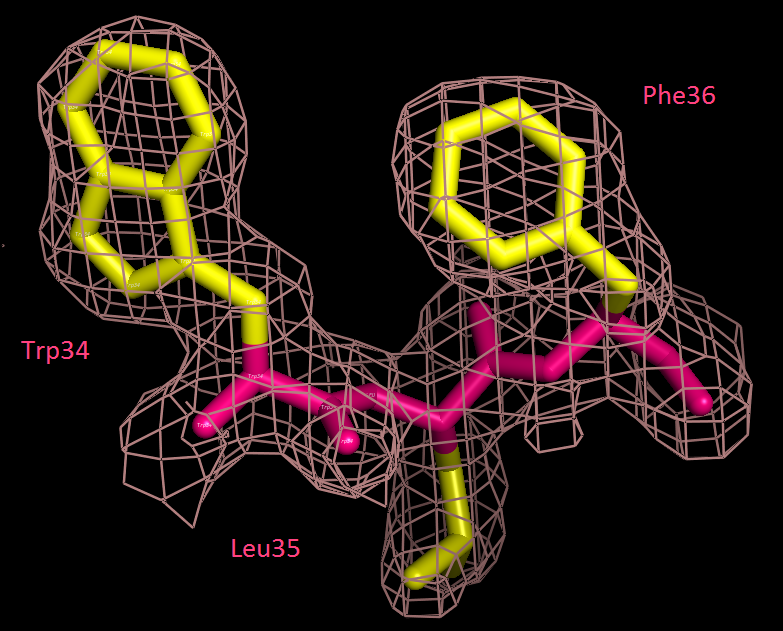 Рис. 4. Электронная плотность для участка TRP34-LUE35-PHE36, 1σ |
 Рис. 5. Электронная плотность для участка TRP34-LUE35-PHE36, 2σ |
 Рис. 6. Электронная плотность для участка TRP34-LUE35-PHE36, 2.5σ |
Выводы
1. При увеличении уровня подрезки мы наблюдаем уменьшение атомов полипептидной цепи, покрытых электронной плотностью. Появляются целые "петли" (участки на краях белка), свободные от электронной плотности. Однако в целом белок все же достаточно хорошо покрывается электронной плотностью. Итого, наш вердикт на этом этапе - разрешение у белка чуть выше среднего (все-таки 2.1Å).
2. Однако при детальном рассмотрении отдельных остатков при увеличения уровня подрезки мы не наблюдаем четкое соответствие электронной плотности ядрам атомов во всех случаях, что говорит нам о недостаточно хорошем разрешении структуры.