| Главная | Семестры | Проекты | Заметки | О себе | Полезные ссылки |
ВЫБОР СТРУКТУРЫ
Была выбрана структура рекомбинатного человеческого белка, связывающего жирные кислоты с идентификатором 1JJJ (получена с помощью ЯМР) и 1B56 (получена с помощью РСА). Разрешение для РСА-структуры неплохое - 2.05Å. Число моделей для ЯМР-структуры - 20.
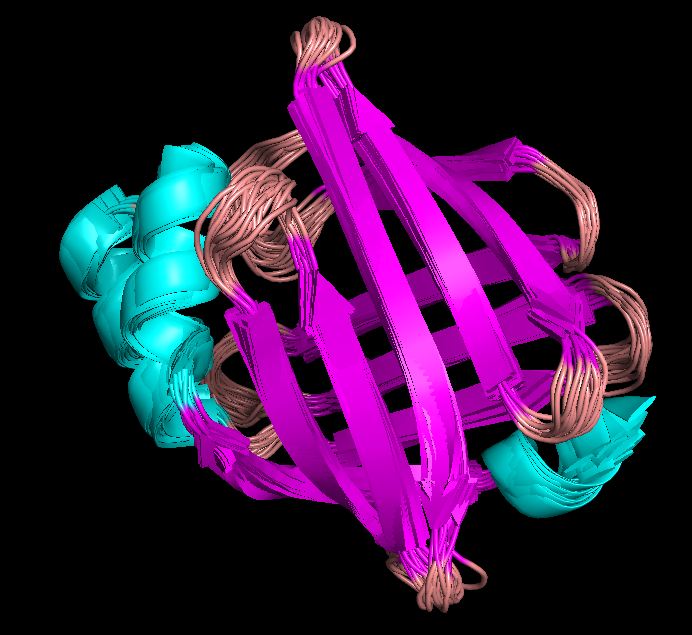 Рис.1. Структура 1JJJ, полученная с помощью ЯМР. Фиолетовым показаны β-листы, бирюзовым-α-спирали, розовым - петли. |
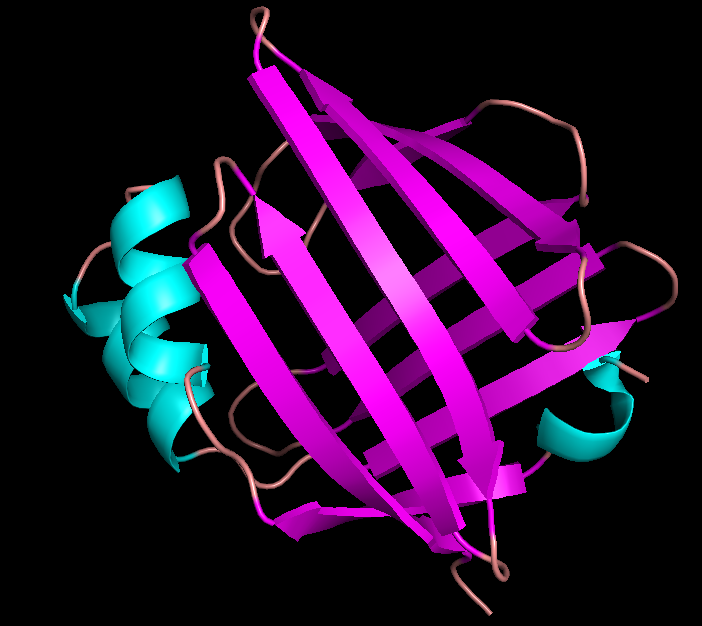 Рис.2. Структура 1B56, полученная с помощью РСА. Фиолетовым показаны β-листы, бирюзовым-α-спирали, розовым - петли. |
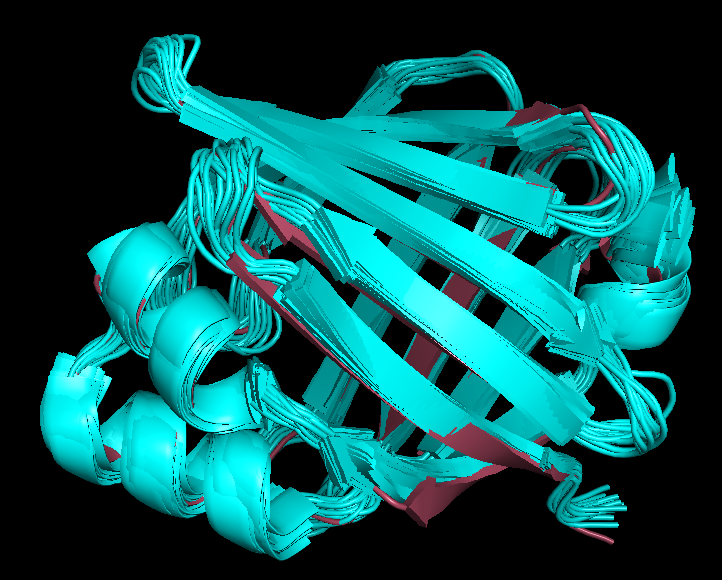 Рис.3. Наложение структур 1B56 и 1JJJ. Бирюзовым цветом показаны модели структуры 1JJJ, розовым - структура 1B56 |
АНАЛИЗ ВОДОРОДНЫХ СВЯЗЕЙ
1. Поиск водородных связей в ядре белка (в β-листах или α-спиралях)
Рассмотрим α-спираль. Известно, что в правой 413 α-спирали соединяется водородной связью каждый четвертый остаток (1->4,2->5...) Рассмотрим 2 таких остатка - Met35 и Ala31. На рис. 4 и 5 изображены водородные связи между ними, а именно N(H) пептидной группы Met и O пептидной группы Ala. Можно заметить, что для структуры, полученной ЯМР, эта водородная связь присутствует не во всех моделях (таблица 1).
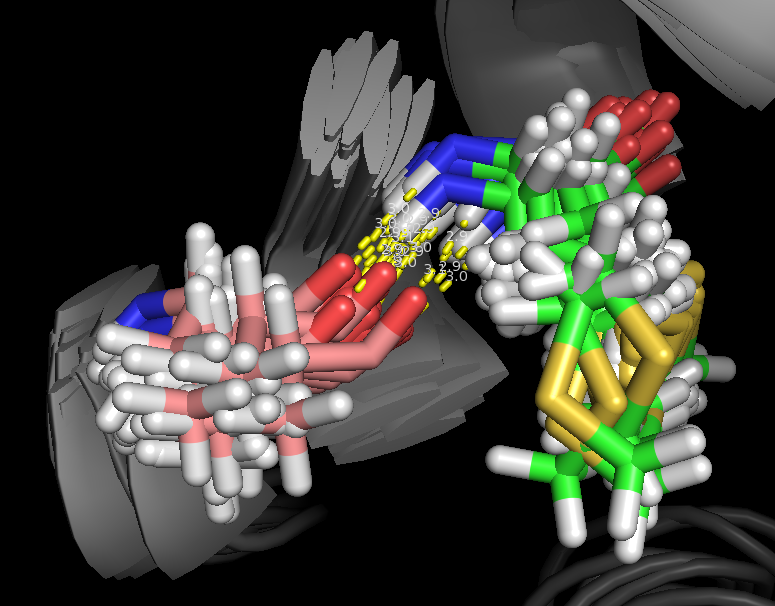
Рис.4. Водородные связи в α-спирали (структура 1JJJ)
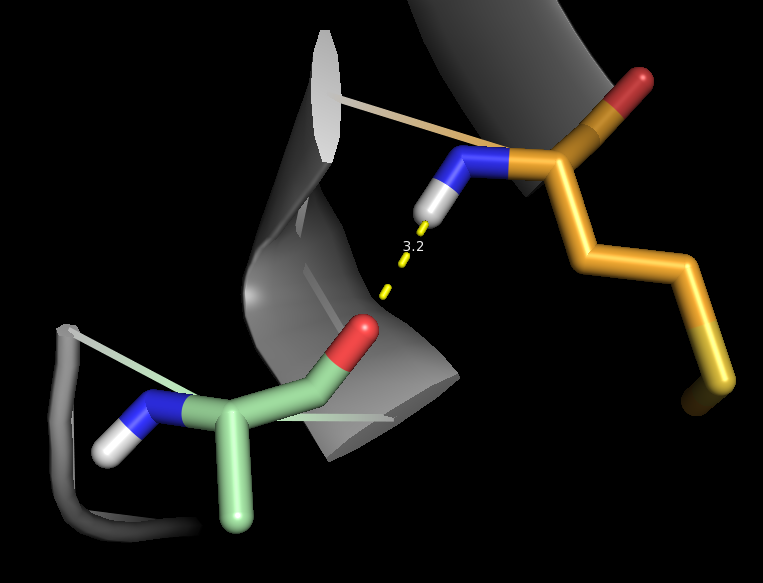
Рис.5. Водородная связь в α-спирали (структура 1B56)
2. Взаимодействие между двумя тяжами в β-листе
Для анализа рассмотрим остатки Glu119 и Thr108 в антипараллельных тяжах. Взаимодействующие атомы: N(Glu) и O(Thr). На рис.6, 7 изображены водородные связи между этими атомами. Опять-таки для структуры, полученной ЯМР, эта водородная связь присутствует не во всех моделях (таблица 1).
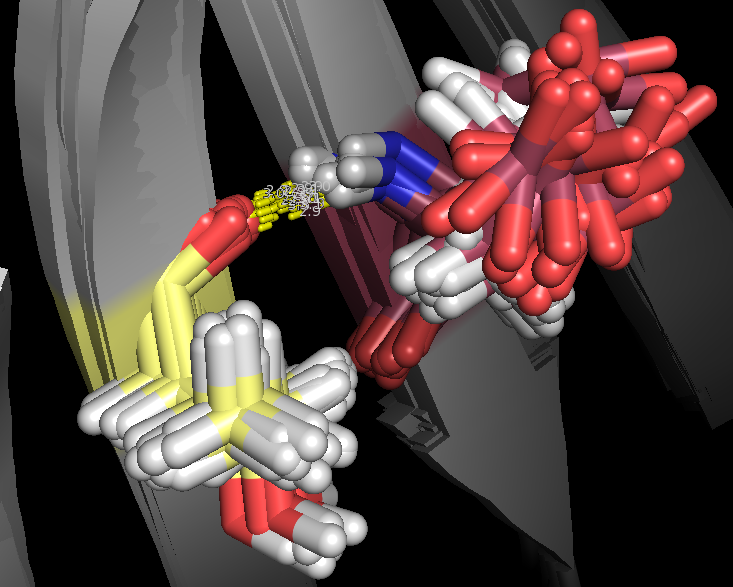
Рис.6. Водородные связи в β-листе(структура 1JJJ)
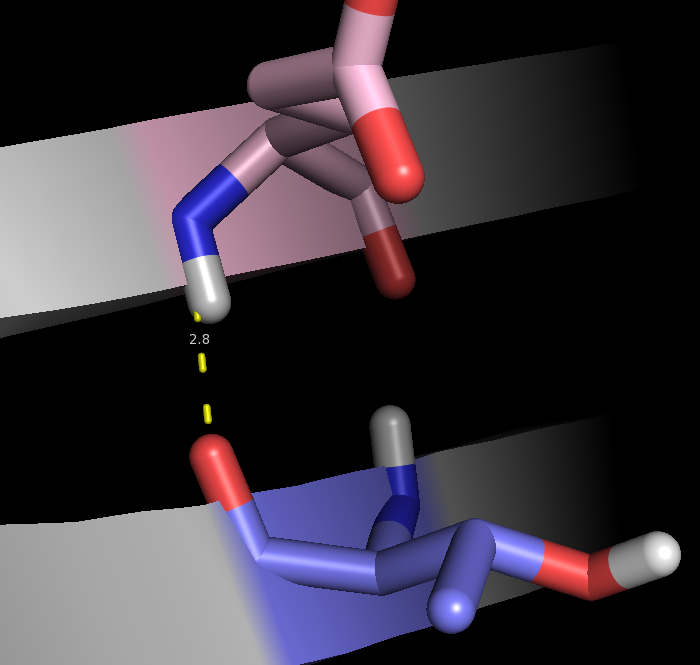
Рис.7. Водородная связь в β-листе(структура 1B56)
3.. Поиск водородных связей в петлях
Рассмотрим взаимодействия остатков Thr77 и Arg81 в петле. Взаимодействующие атомы: N(Thr), O(Arg). Водородные связи показаны на рис. 8 и 9. Для структуры, полученной ЯМР, эта водородная связь присутствует не во всех моделях (таблица 1).
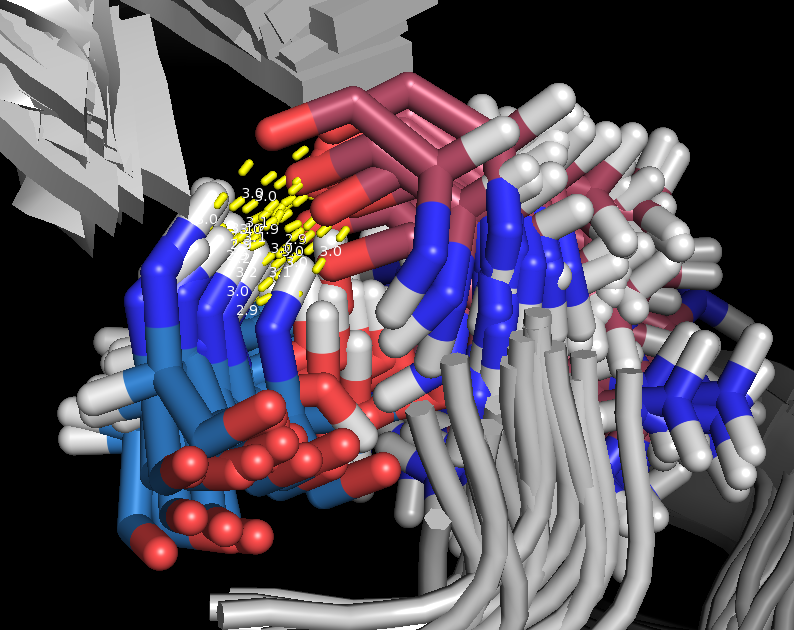
Рис.8. Водородные связи в петле (структура 1JJJ)
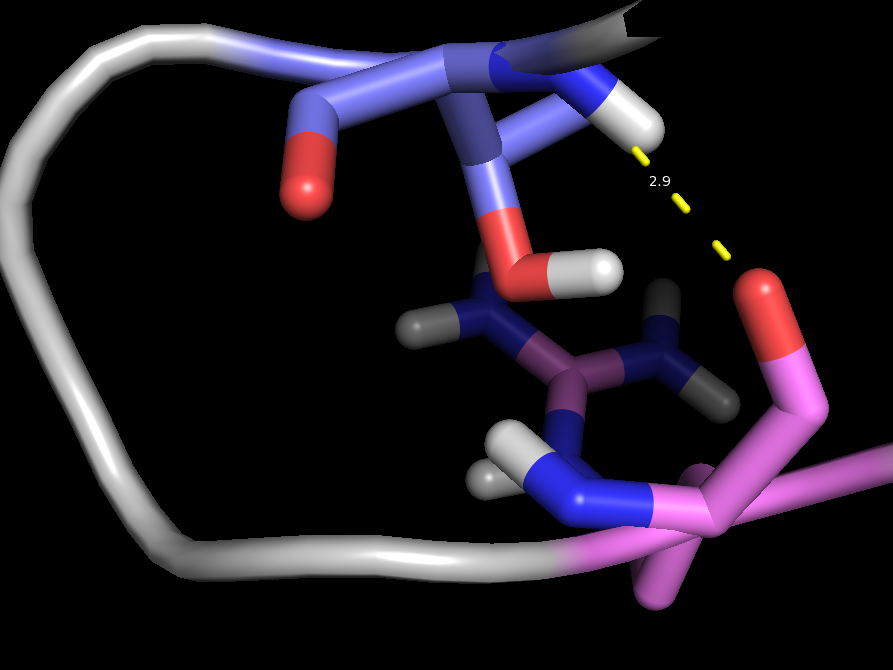
Рис.9. Водородная связь в петле (структура 1B56)
| Расположение водородной связи | Донор и акцептор электронов | Расстояние в Å для РСА-структуры | Число моделей в ЯМР-структуре, где связь присутствует | Процент моделей в ЯМР-структуре, где связь присутствует | Минимальное расстояние в ЯМР-структуре в Å | Максимельное расстояние в ЯМР-структуре в Å | Медианное расстояние в ЯМР-структуре в Å |
| Ядро белка, в α-спирали | NH(Met35)---O(Ala31) | 3.2 | 12 | 60 | 2.9 | 3.1 | 2.9 |
| Петли на поверхности глобулы | NH(Thr77)---O(Arg81) | 2.9 | 12 | 60 | 2.9 | 3.2 | 3 |
| Взаимодействие между двумя тяжами в β-листе | NH(Glu119)---O(Thr108) | 2.8 | 18 | 90 | 2.9 | 3.1 | 3 |