| Главная | Семестры | Проекты | Заметки | О себе | Полезные ссылки |
Нахождение гидрофобных кластеров
Выберем структуру 4EZN ( у нее 2 цепи: А и B, субстрат-связывающий домен DnaK из Pyrrhocoris apterus, экспресированный в Escherichia coli). Сначала поищем гидрофобные контакты в цепи А (таблица 1).
| Параметры кластера | Найденные кластеры (номера остатков) | Изображение | Комментарии |
| 5.4Å, минимальное число остатков в кластере: 3 | 141, 85 - два самых больших, остальные меньше: 21,19,12,7,6,6,6,5,5,3,3,3,3 |
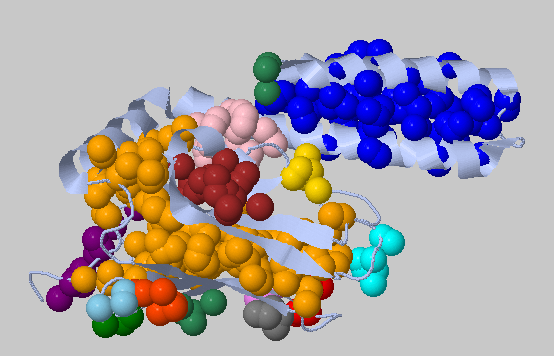 |
Было найдено аж 15 кластеров! 2 из них большие: синий и оранжевый, остальные небольшие. Синий кластер покрывает α-участок белка, оранжевый - участок из β-листов. В целом, весь белок покрыт гидрофобными кластерами, что может говорить о том, что структура поддерживается гидрофобными взаимодействиями. Попробуем ужесточить порог. |
| 4.5Å, минимальное число остатков в кластере: 10 | 124, 61 - два самых больших, остальные: 12,10 | 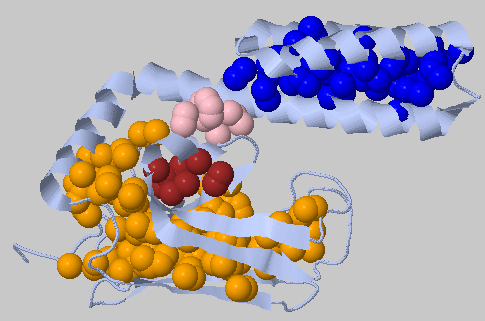 |
Некоторое "ужесточение параметров". По-прежнему найдены 2 больших кластера, относящихся к α-спиральной части белка (синий) и к β-части белка (оранжевый). Из кластеров поменьше остались всего 2, они поддерживают остальные части третичной структуры. |
| 4.0Å, минимальное число остатков в кластере: 10 | 14, 13 - два самых больших, остальные - 12,10 | 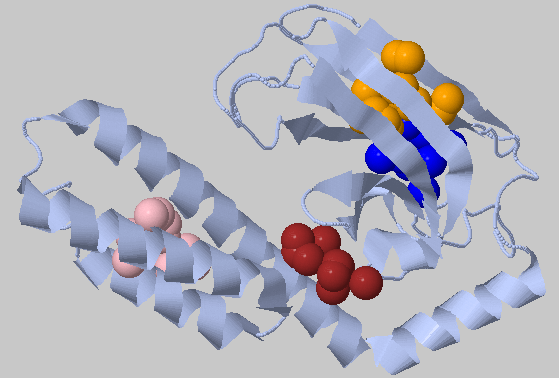 |
Снижение порога расстояния оставило 4 кластера, однако все они небольшие, почти не различаются размерами и распределены по структуре неравномерно. |
| 3.5Å, минимальное число остатков в кластере: 3 | 5 кластеров по 4 остатка | 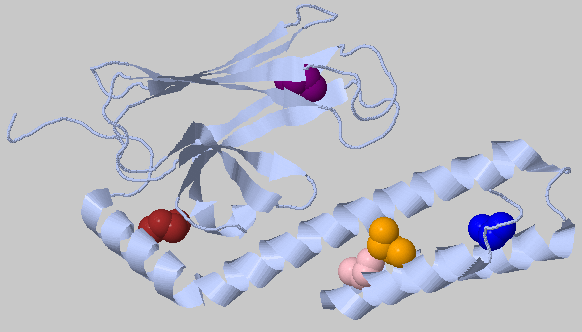 |
Были найдены 5 маленьких кластеров, разбросанных по всей структуре. |
Для анализа взамодействия между цепями был выбран белок из 1 семестра (2CHP, додекаэрический ферритин MrgA из Bacillus Subtilis). Он содержит 4 цепи (А,B,C,D). Рассмотрим взаимодействие между А и В (таблица 2).
| Параметры кластера | Найденные кластеры (номера остатков) | Изображение | Комментарии |
| 5.4Å, минимальное число остатков в кластере: 3 | 1 кластер из 82 остатков | 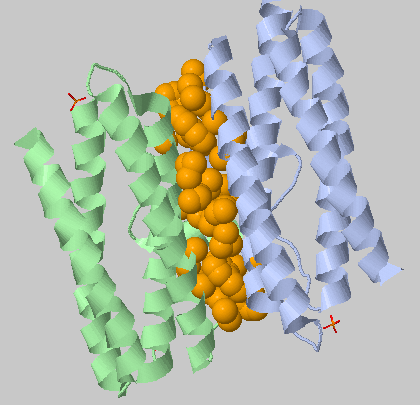 |
Один большой кластер найден на перифирии субъединиц А и В. |
| 4.5Å, минимальное число остатков в кластере: 10 | 3 кластера: 17,16,14 остатков | 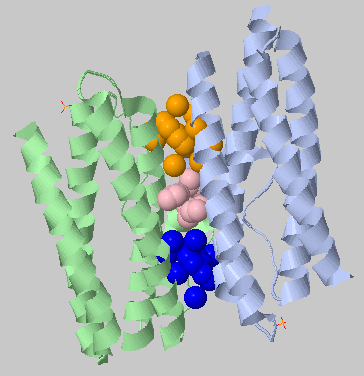 |
При ужесточении порога один большой межсубъединичный гидрофобный кластер разбился на 3 поменьше. |
| 4.0Å, минимальное число остатков в кластере: 6 | 2 кластера по 6 остатков | 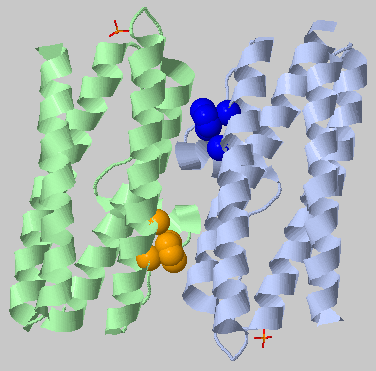 |
Остались только 2 гидрофобных кластера (исчез средний), они возникают за счет небольшой спирали, выходящей из основной массы α-спиралей структуры. Здесь минимальное число остатков было взято не 10, а 6 (при более 6 остатков при таком пороге не находятся кластеры вообще) |
| 3.5Å, минимальное число остатков в кластере: 3 | 2 кластера по 3 остатка | 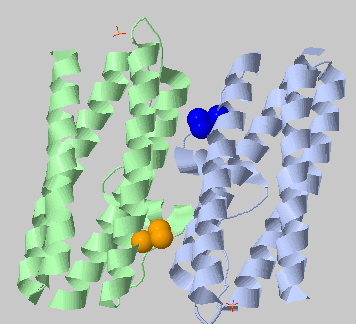 |
Остались 2 маленьких гидрофобных кластера (похожих на предыдущие два) |
ВЫВОДЫ
1. Для структуры 4EZN были найдены 2 крупных гидрофобных кластера, один из которых покрывал часть белка, состоящую из α-спиралей, а другой - часть из β-листов. Более мелкие кластеры покрывают остальные части структуры. Здесь можно сказать, что гидрофобные взаимодействия важны для поддержания внутренней структуры белка.
Функцией белка является связывание других белков (он относится к шаперонам, сама структура представляет белок-связывающий домен DnaK из семейства Hsp70). На рис. 1 представлена область связывания пептида с белок-связывающим доменом. Можно заметить, что пептид связывается с β-тяжами ближе к нерегулярным петлям, где гидрофобных взаимодействий меньше (глядя на рис. из таблицы 1).
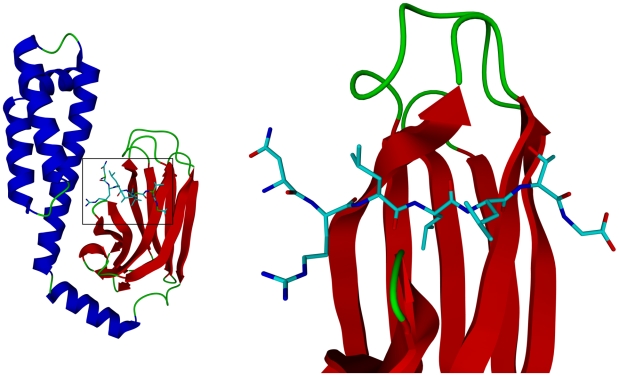
Рис.1. Связывание субстрата С-концевым белок-связывающим доменом DnaK[1]
2. Для второй структуры 2CHP был обнаружен обширный гидрофобный контакт между субъединицами. Это может говорить о том, гидрофобные взаимодействия очень важны для взаимодействия субъединиц между собой (а этот белок додекамер!).