Пространственная структура белка Jab1/Mpn Domain
Структура.
PDB ID: 1OI0
Данная структура является ферментом гидролазой. Этот белок принадлежит архее Archaeoglobus fulgidus и состоит из 4 отдельных идентичных аминокислотных цепей: субъединиц A, B, C, D. Их длины составляют 124 аминокислотных остатка. Данный фермент являются частью протеосомы и удаляет полиубиквитиновые цепи с белков перед их деградацией. Cтруктурно Jab1/Mpn Domain напоминает цитидин дезаминазу (которая является цинк-зависимым ферментом), что указывает на принадлежность к суперсемейству металлозависимых гидролаз. Цинк активирует воду для нуклеофильной атаки, аналогично механизму дезаминаз.[1]
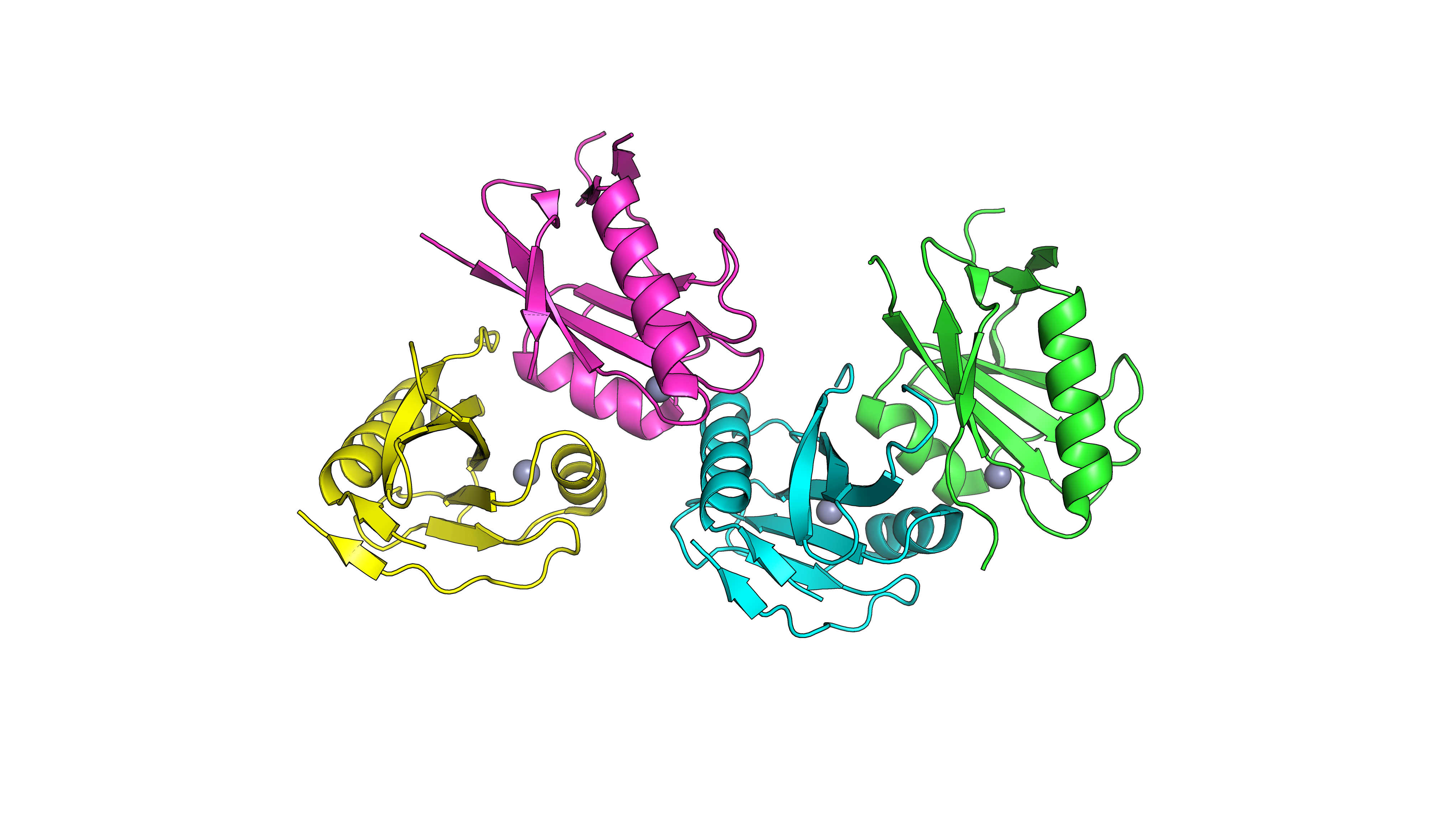
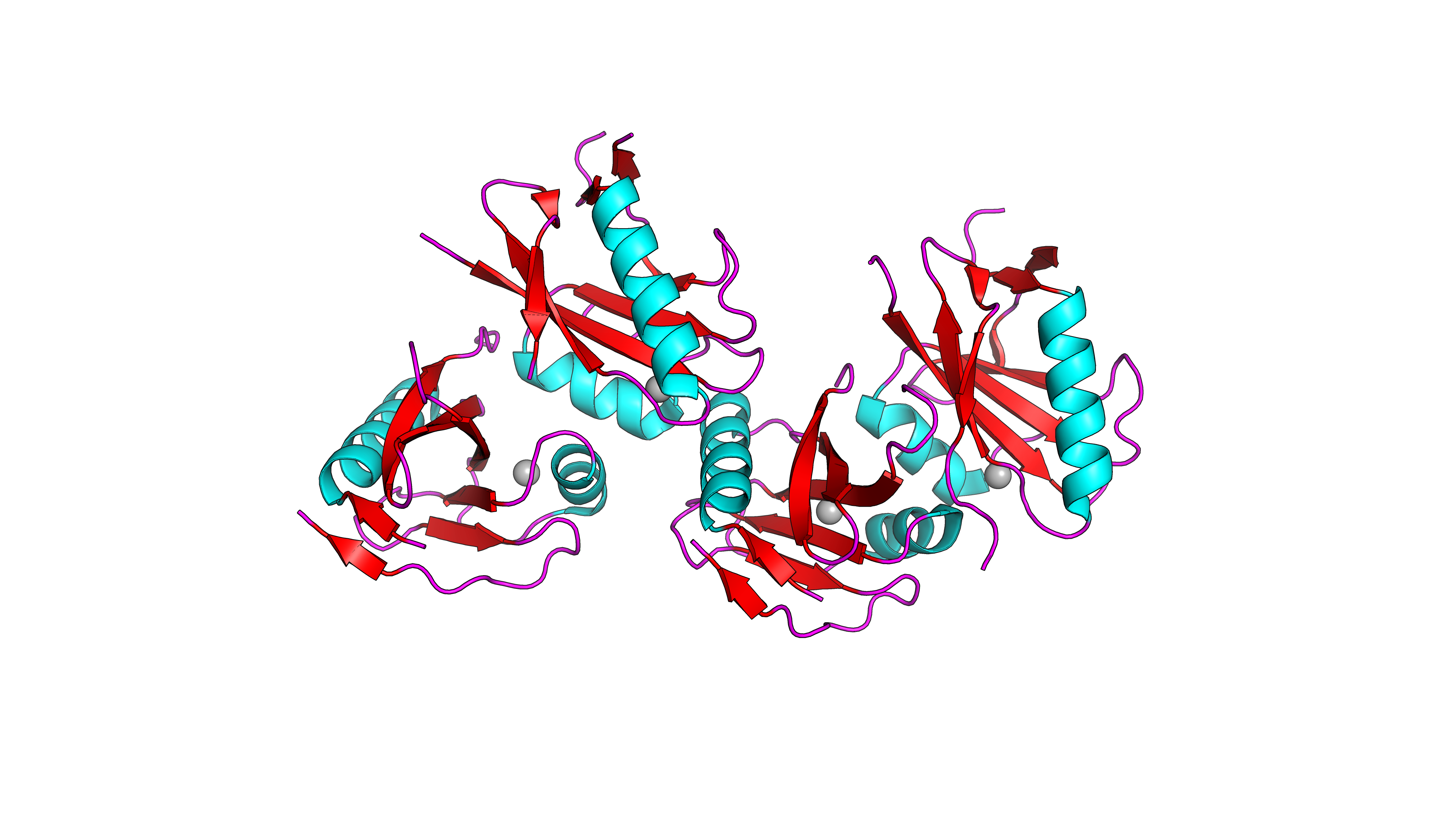
Отдельные цепи.
Как говорилось ранее, данная аминокислотная цепь
принадлежит архее Archaeoglobus fulgidus.
В системе Uniprot цепь имее следующий uniprot_id: O28085_ARCFU
Аминокислотные последовательности этого белка на PDB и Uniprot идентичны.
Нетрудно заметить, что в структуре данного белка встречаются как β-слои,
так и α-спирали, причем примерно в равном объеме.
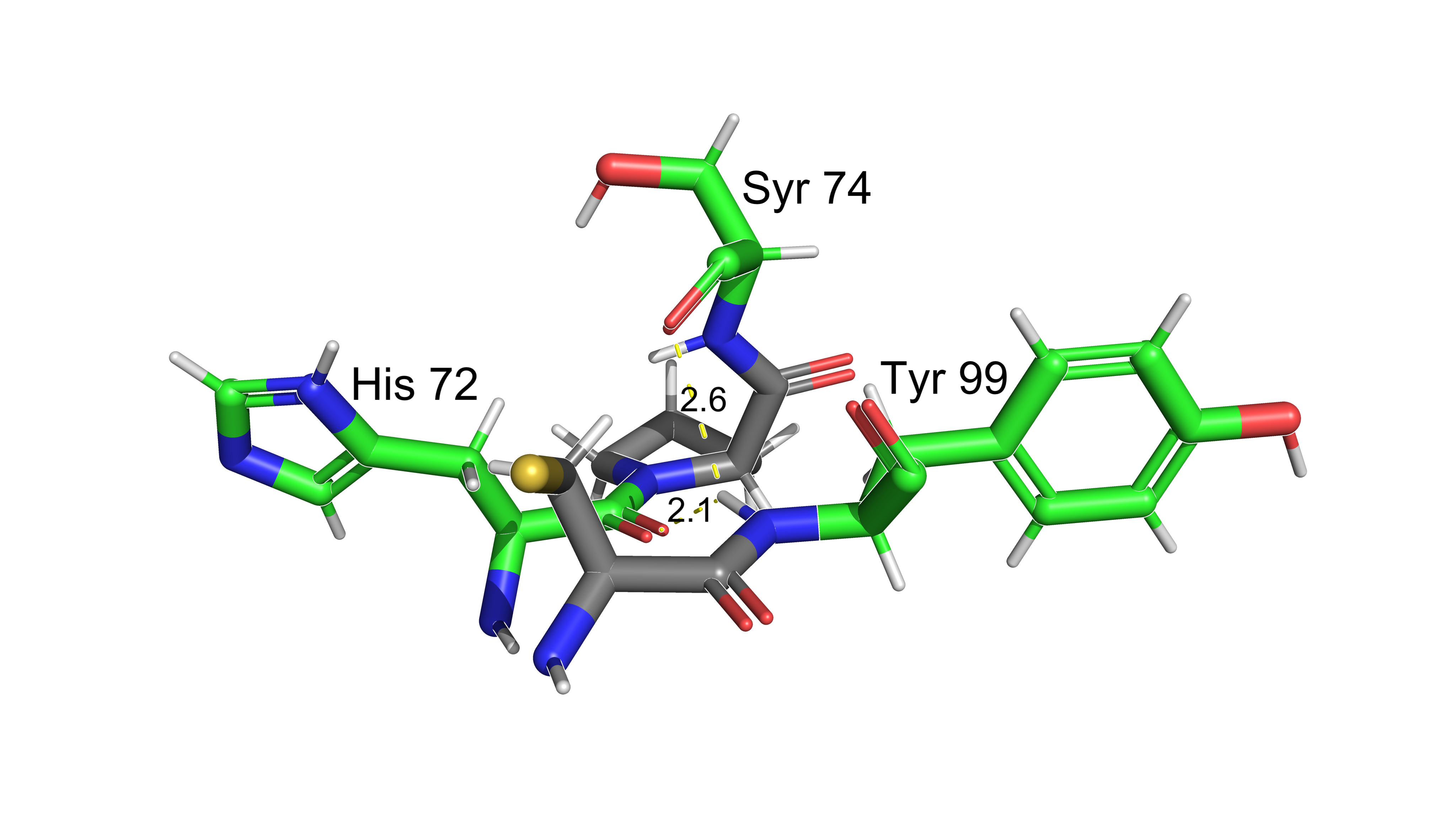
Аминокислоты 77 и 98 образуют дисульфидный мостик.
В последовательности отсутствуют модифицированные аминокислоты.
Микромолекулы.
В записи присутствуют три вида микромолекул:
- Ионы Zn2+ (ZN; ZINC ION)
- Молекулы тригидрометиламмония (144; TRIS-HYDROXYMETHYL-METHYL-AMMONIUM)
- Молекулы воды (HOH)
Ссылка на координаты микромолекул
Как уже было сказано ранее, ионы Zn2+ играют важную роль в реакционной способности
фермента, активирую воду для нуклеофильной атаки и формируют активный сайт металлогидролазы.
Молекулы тригидрометиламмония входят в состав кристаллизационного буфера,
нужного для формирования кристаллов изучаемого белка.[1]
Список литературы
[1] Huong J. T. T. TranMark D. AllenJan LöweMark Bycroft. Structure of the Jab1/MPN Domain and Its Implications for Proteasome Function. Biochemistry 2003, 42, 39, 11460–11465.
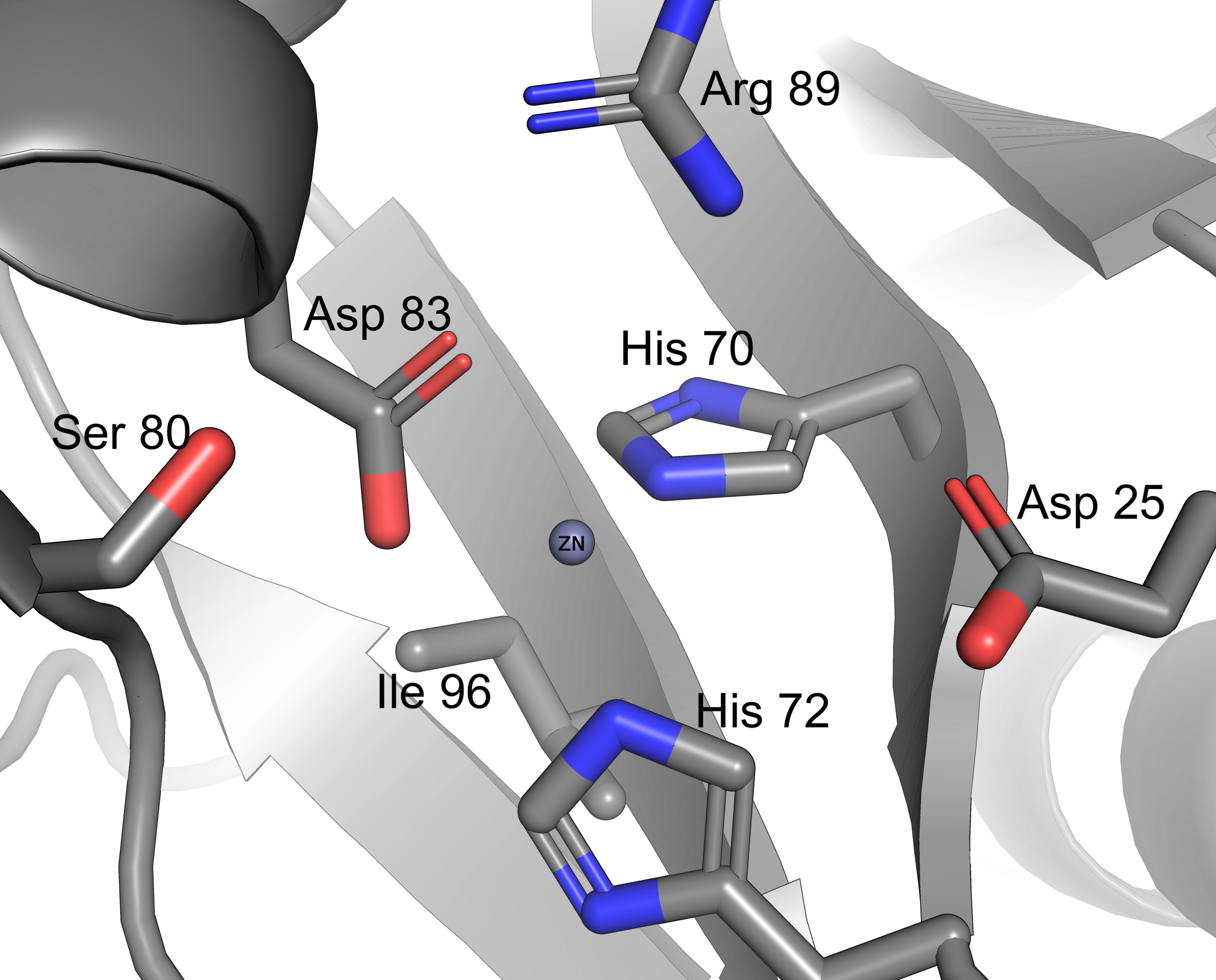
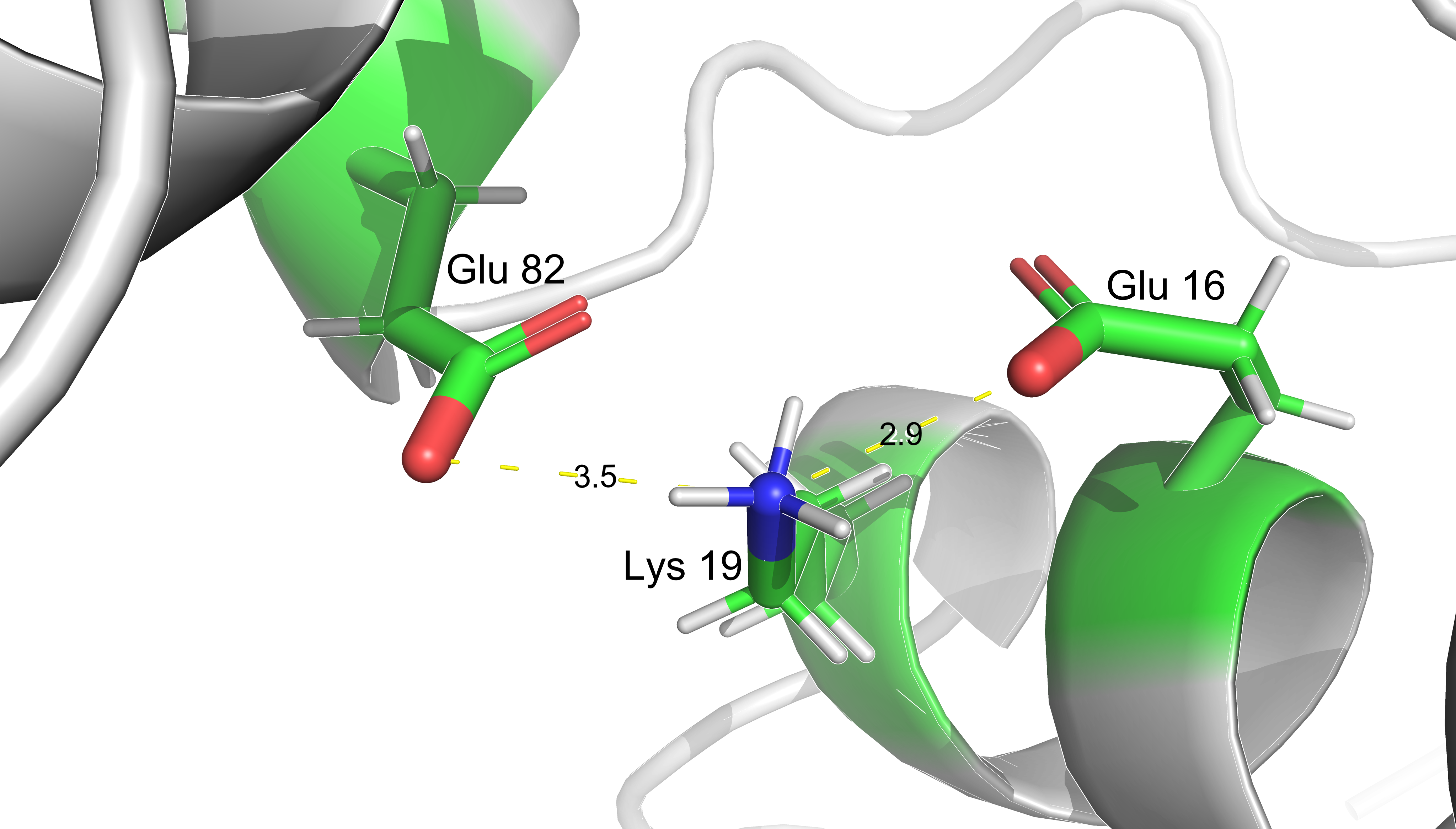
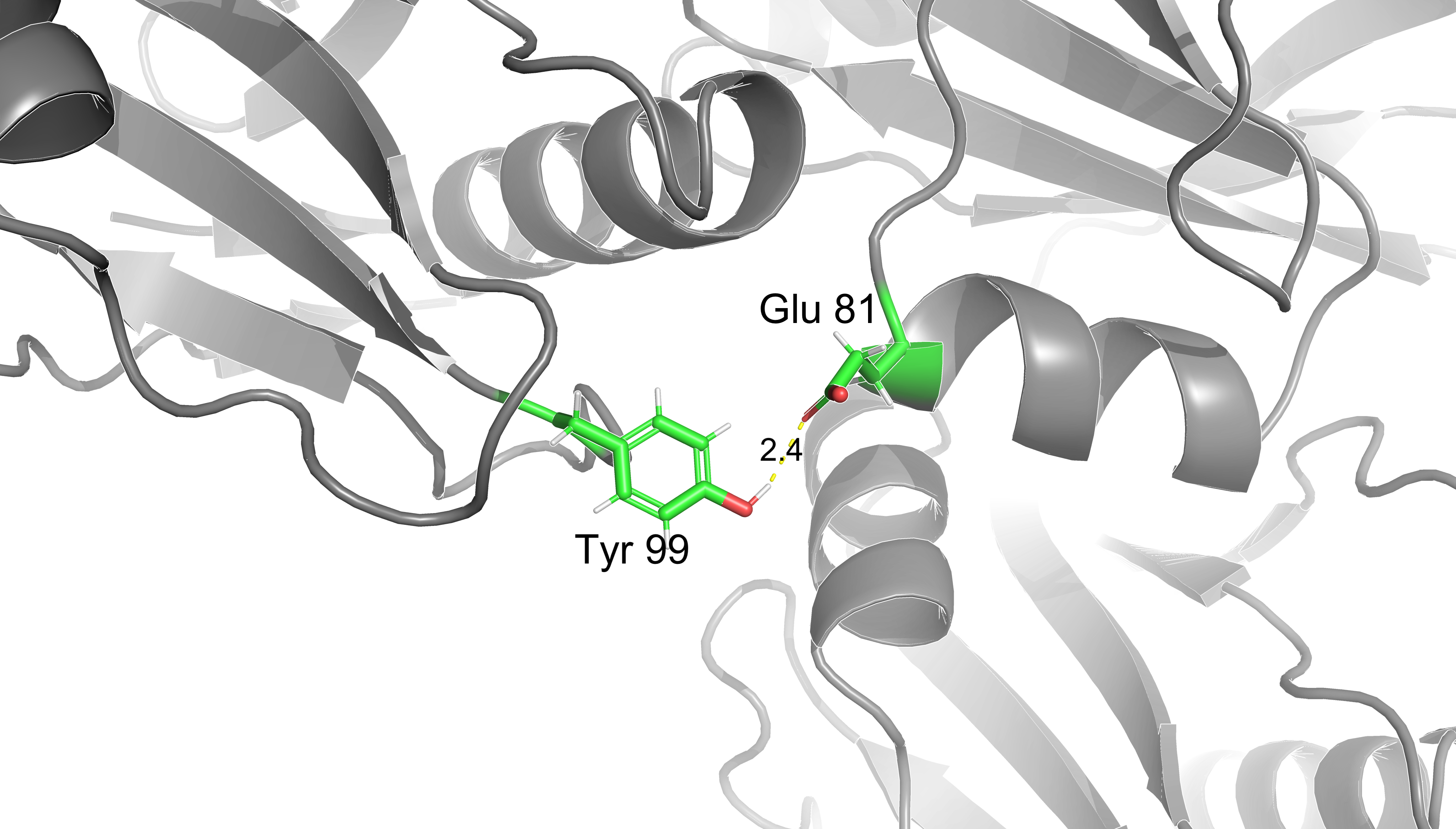
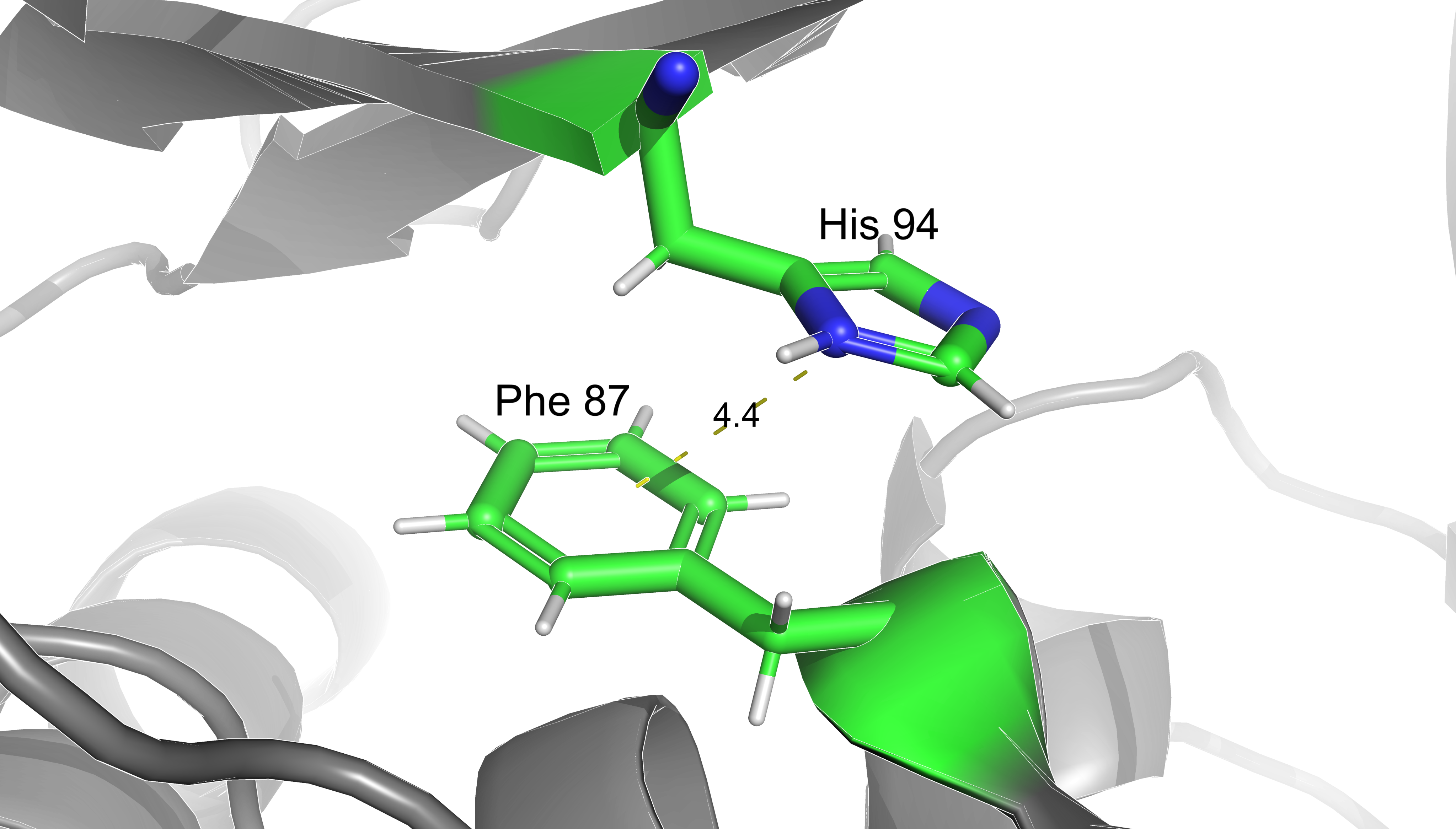
Взаимодействия аминокислот.
В данном разделе представлены некоторые типы взаимодействий аминокислотынх
остатков между собой: солевой мостик, водородные связи, дисульфидный мостик и
стэкинг.
Расстояния указаны в дальтонах.