| Ферменты |
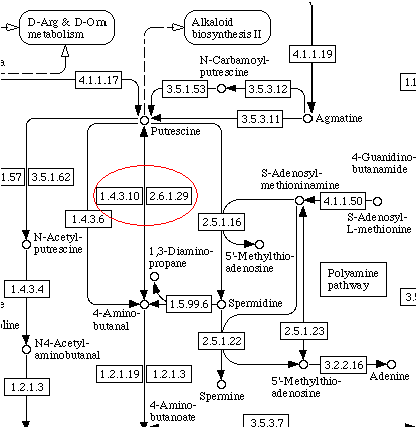
1.4.3.10 |
2.6.1.29 |
| Название |
putrescine oxidase (путресцин-оксидаза) |
amine transaminase (амин-трансаминаза) |
| Синонимы к названию |
monoamine oxidase (моноамин-оксидаза) |
diamine transaminase (диамин-трансаминаза);
diamine aminotransferase (диамин-аминотрансфераза);
diamine-ketoglutaric transaminase (диамин-кетоглутаровая трансаминаза) |
| Систематическое название |
putrescine:oxygen oxidoreductase (deaminating) (путресцин:
кислородная оксидоредуктаза (деаминирование)) |
diamine:2-oxoglutarate aminotransferase (диамин: 2-оксоглутарат
аминотрансфераза) |
| Расшифровка кода |
EC 1 — оксидоредуктазы
EC 1.4 — взаимодействие с группой CH-NH2
EC 1.4.3 — кислород как акцептор
EC 1.4.3.10 — путресцин-оксидаза
|
EC 2 — трансферазы
EC 2.6 — переносчики азотсодержащих групп
EC 2.6.1 — трансаминазы
EC 2.6.1.29 — диамин-трансаминаза
|
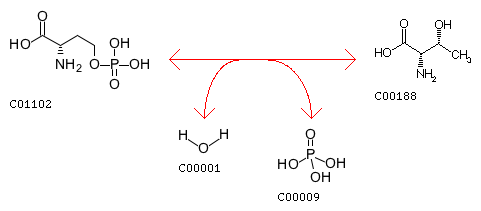
| Катализируемая реакция |
putrescine + O2 + H2O = 4-aminobutanal + NH3
+ H2O2
|
An alpha,omega-diamine + 2-oxoglutarate = an omega-aminoaldehyde +
L-glutamate
|
| Субстрат |
putrescine
(путресцин)
O2
H2
O
|
alpha,
omega-diamine (альфа, омега-диамин)
2-
oxoglutarate (2-оксоглутарат)
|
| Продукт |
4-aminobutanal (4-аминобутаналь)
NH3
H2
O2
|
omega-
aminoaldehyde (омега-аминоальдегид)
L-glutamate (L-глутамат)
|
| Примеры ингибиторов |
Butylamine (бутиламин)
Cyanide (цианид)
Spermine (спермин)
|
Cyanide (цианид)
Hydroxylamine (гидроксиламин)
Semicarbazide (семикарбазид)
|
| Кофактор |
FAD (ФАД) |
Pyridoxal 5'-phosphate (пиридоксал 5'-фосфат) |
| Примеры публикаций |
1) DeSa RJ.
Putrescine oxidase from Micrococcus rubens. Purification and
properties of the enzyme.
J. Biol. Chem. 247 (1972)
5527-34.
2) Yamada, H.
Putrescine oxidase (Micrococcus rubens).
Methods Enzymol.17B (1971)
726-730.
|
1) Kim, K.
Purification and properties of a diamine alpha-ketoglutarate
transaminase from Escherichia coli.
J. Biol. Chem. 239 (1964)
783-786. |