В данном практикуме я работал со структурой MS3494 из Mycobacterium smegmatis. По данным PDB функция данного белка неизвестна.
PDB-коды:
Структура РСА - 7REF, разрешение 2.10 Å
Структура ЯМР - 7S0N, посчитано 100 моделей, представлено 10 моделей
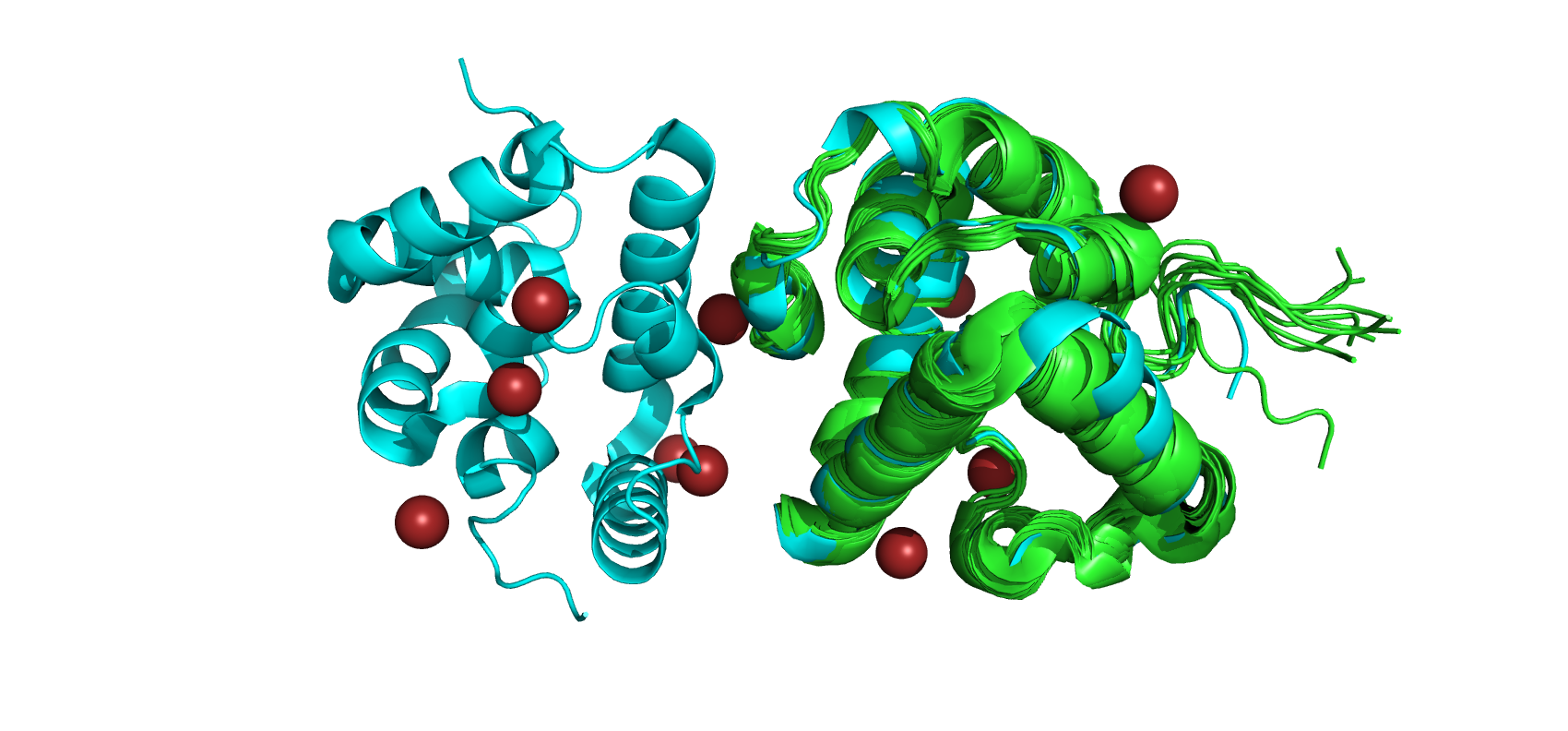
На рис.1 показано наслоение структуры РСА (окрашена в бирюзовый) на структру ЯМР (окрашена в зелёный).

рис.1. Наcлоение 7REF и 7S0N
Сразу можно отметить, что структура РСА состоит из двух субъединиц, в то время как структура ЯМР - из одной.
В структуре РСА присутствует бром (окрашен в красный), а также были молекулы воды (удалены при работе с изображением).
Водороды есть только в структуре ЯМР (рис.2, рис.3)
В целом при наложении элементы вторичных структур соответствуют друг другу. Сильно же различаются только концевые участки, предположительтно из-за высокой подвижности.
Далее я выделил несколько отдельных наблюдений - остатки, которые плохо накладываются друг на друга (рис.2, рис.3), работал с 1 моделью ЯМР.
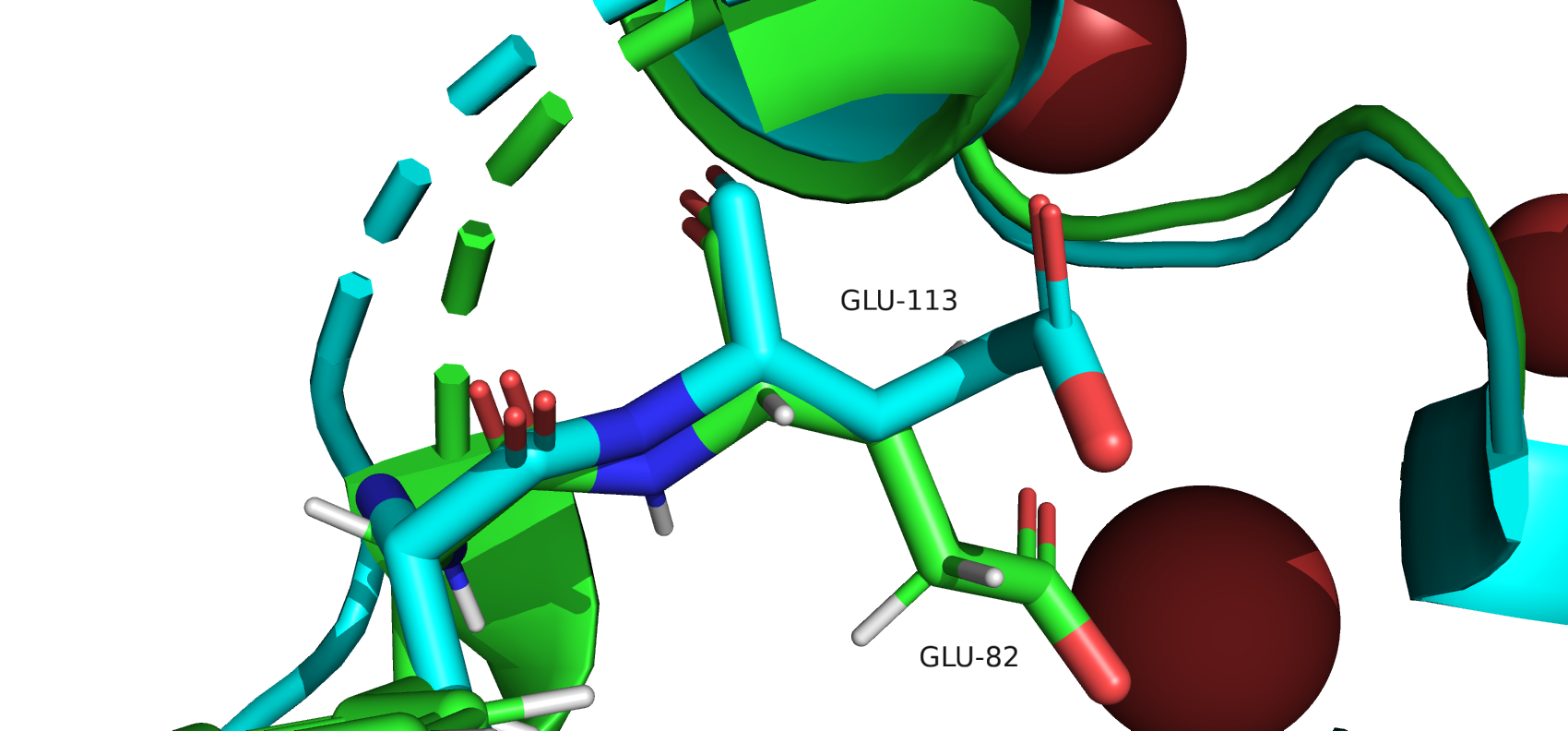
рис.2. GLU-113 в структуре РСА и GLU-82 в структуре ЯМР
Остатки направлены в разные стороны и почти не накладываются друг на друга.
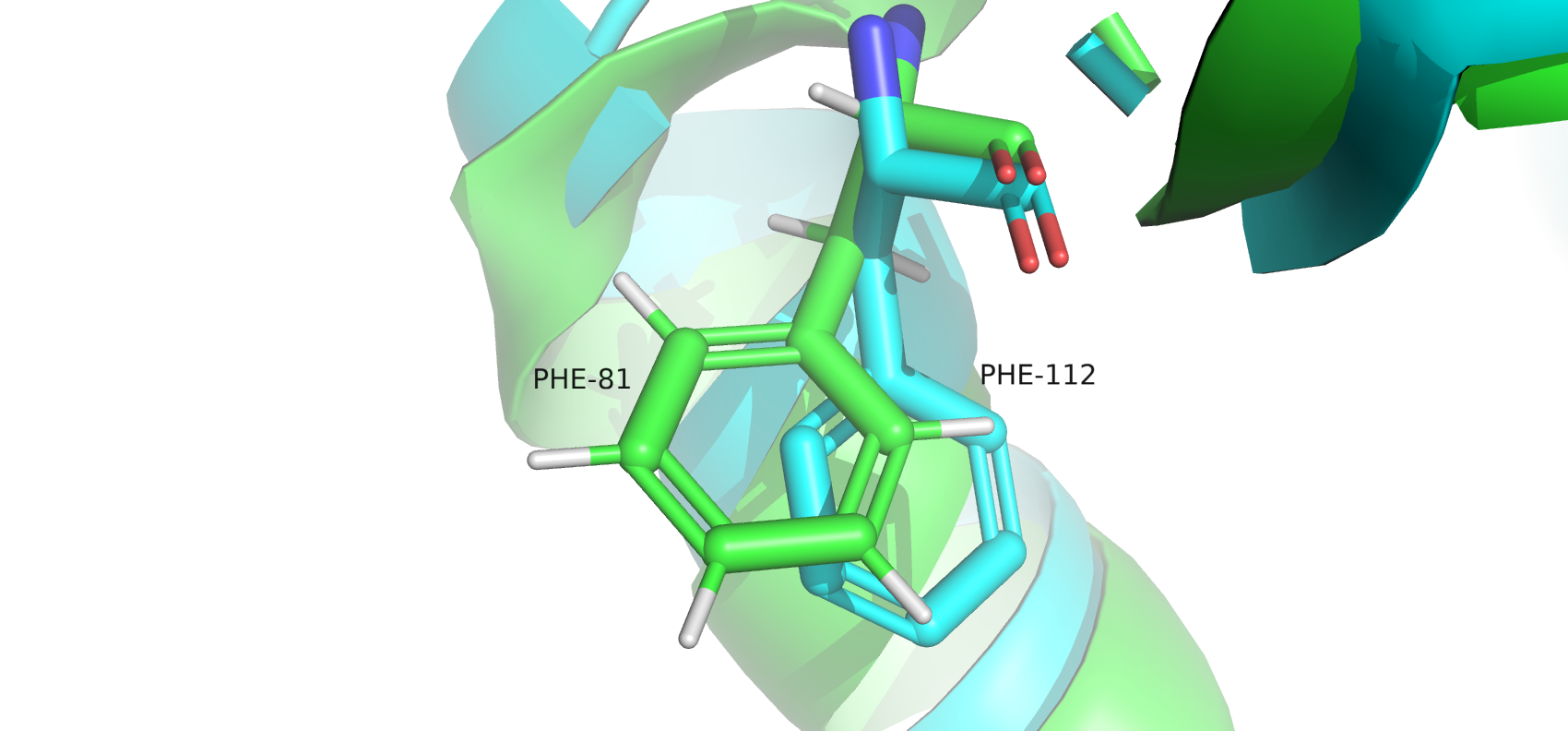
рис.3. PHE-112 в структуре РСА и PHE-81 в структуре ЯМР
Описанные остатки также направлены в разные стороны и плохо накладываются друг на друга.
В обоих случаях остатки были взяты из боковых цепей, расположеных ближе к поверхности белка.
В данном задании было необходимо изучить зависимость средних значений В-факторов структуры РСА от средних RMSF структуры ЯМР.
Предварительтно я убедился, что значения в двух массивах (в обоих случаях цепь А) попарно соответсвтуют одному и тому же остатку.
Средние значения В-фактора вычислялись идентично предыдущему практикуму, средние RMSF с помощью prody.calcRMSF(residue).
Код приведён по ссылке.
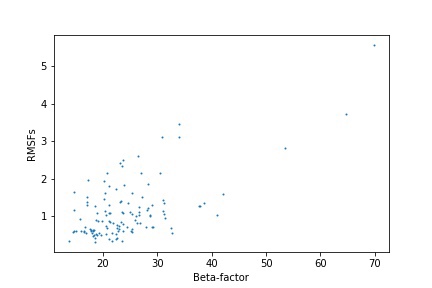
рис.4. Зависимость RSMF от B-факторов
Большинство точек расположены на участке 0-30 по В-фактору и 0-2 по RMSF. Заметно, что с увеличением В-фактора немного растут значения RMSF.
Таким образом можно сказать, что исследуемые модели ЯМР описывают подвижность белка.
По структуре, полученной методом РСА, было необходимо выбрать 3 водородные связи:
- между атомами остова в ядре белка (в моём случае в альфа-спирали, рис.5)
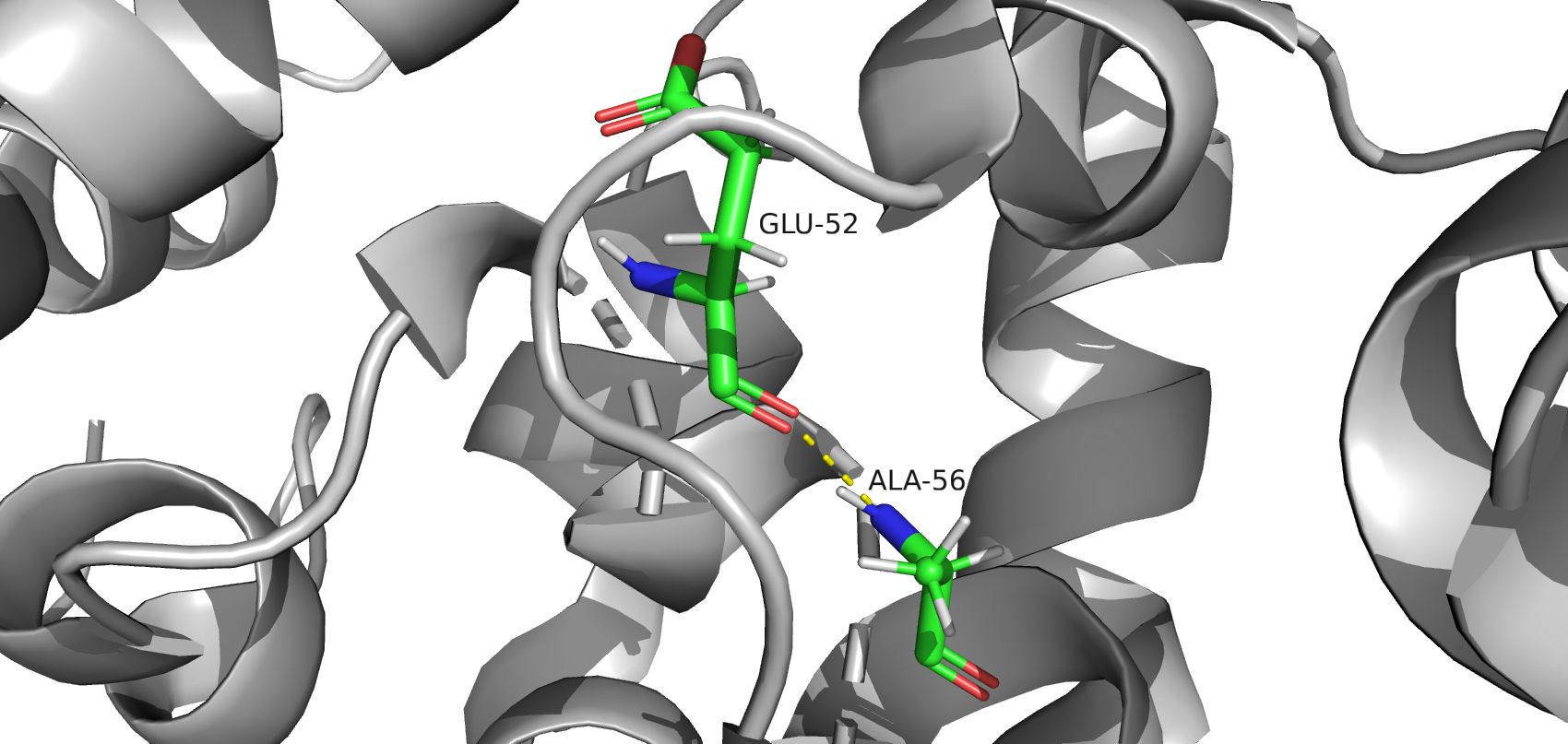
рис.5. Водородная связь между GLU-52 и ALA-56, альфа-спираль в ядре белка
Для ЯМР структуры это связь между GLU-21 и ALA-25.
- водородную связь боковых цепей в ядре белка (рис.6)
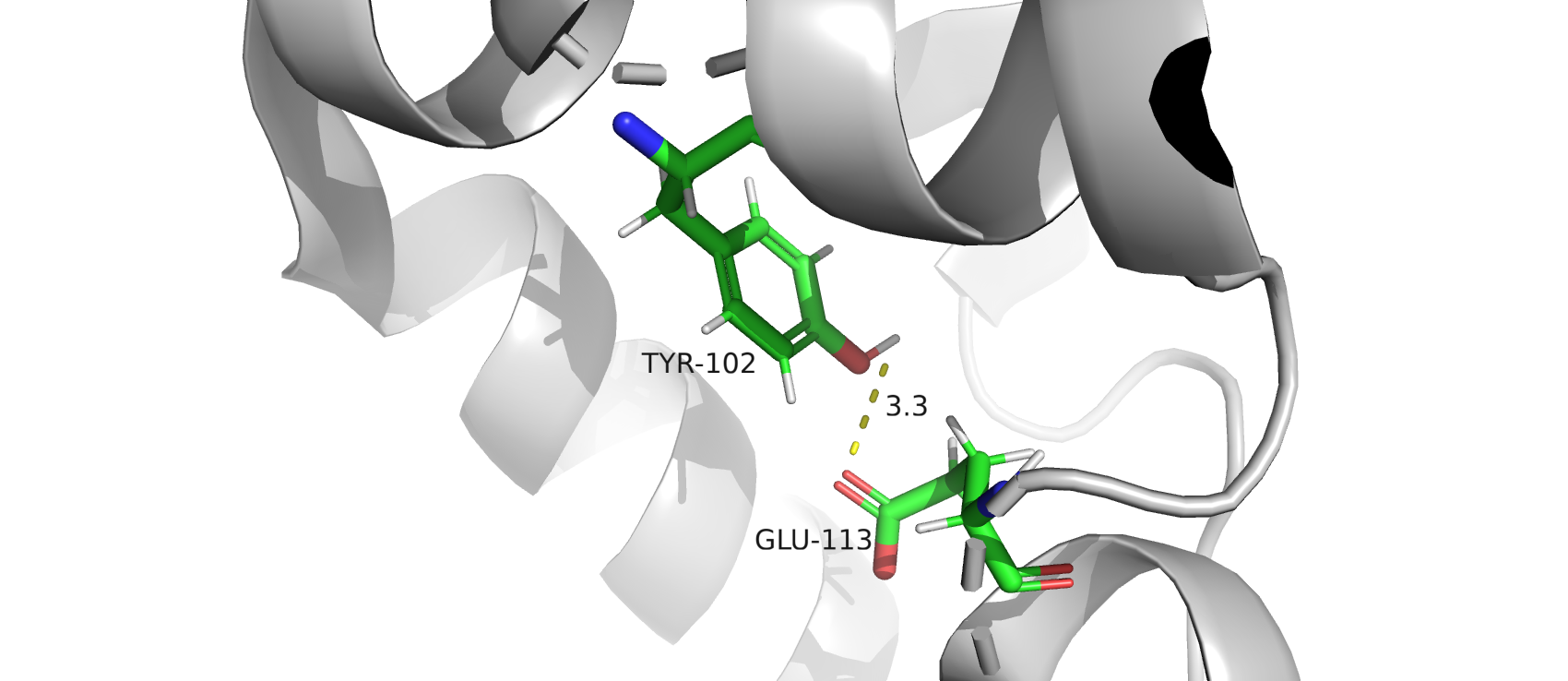
рис.6. Водородная связь боковых цепей между TYR-102 и GLU-113, ядро белка
Для ЯМР структуры это связь между TYR-71 и GLU-82.
Водородную связь боковых цепей в ядре белка оказалось не так просто найти: в большинстве случаев они образуются с атомами остова, а если и между боковыми цепями - то такие связи почти всегда располагаюся на поверности белка. Кажется, что в структуре РСА TYR-71 и GLU-82 слишком близко расположены. Интересно, что для ЯМР минимальное расстояние составило 5.6Å - слишком много для существования водородной связи (см. таблицу 1). Скорее всего мы наблюдаем неточность в определении расположения данных остатков.
- водородную связь в петлях, выходящих на поверхность глобулы (рис.7)
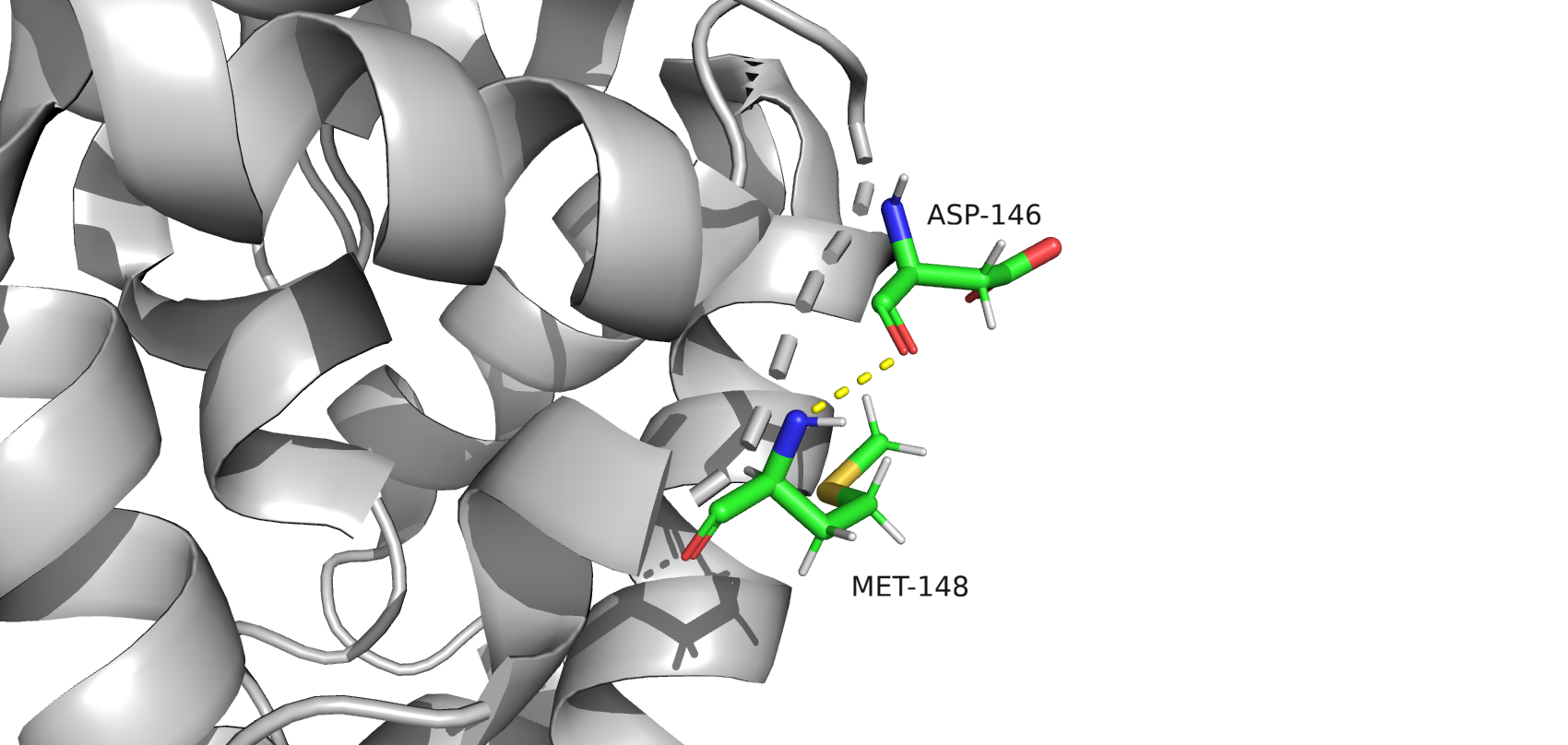
рис.7. Водородная связь между ASP-146 и MET-148, поверхность белка
Для ЯМР структуры это связь между ASP-115 и MET-117.
Таблица 1. Характеристика водородных связей
| Пара\Расстояние | РСА | Минимальное, ЯМР | Максимальное, ЯМР | Медианное, ЯМР | % моделей со связью, ЯМР |
| 1 пара (GLU и ALA) | 2.97 | 2.781 | 2.872 | 2.827 | 100% |
| 2 пара (TYR и GLU) | 3.3 | 5.6 | 9.2 | 6.7 | 0% |
| 3 пара (ASP и MET) | 2.96 | 2.870 | 3.106 | 2. 947 | 100% |
Ниже приведены изображения тех же водородных связей в структуре ЯМР (включено отображение всех моделей).
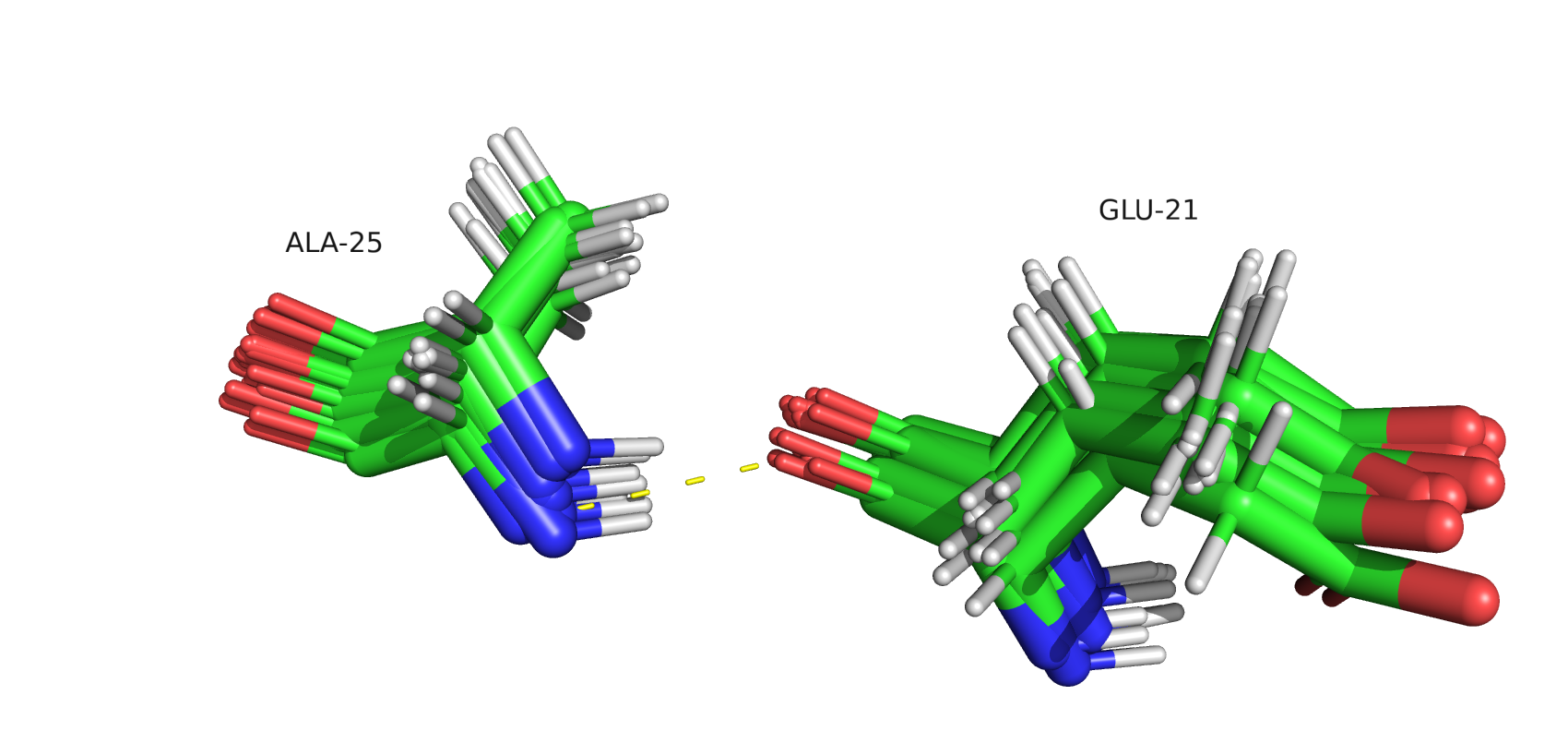
рис.8. Водородная связь между GLU-21 и ALA-25, альфа-спираль в ядре белка
Положение остатков слабо меняется, поэтому можно предположить, что данный участок малоподвижен. Он находится внутри альфа-спирали в ядре белка, теоретически данный сегмент должен быть стабильным и не менять своё положение.
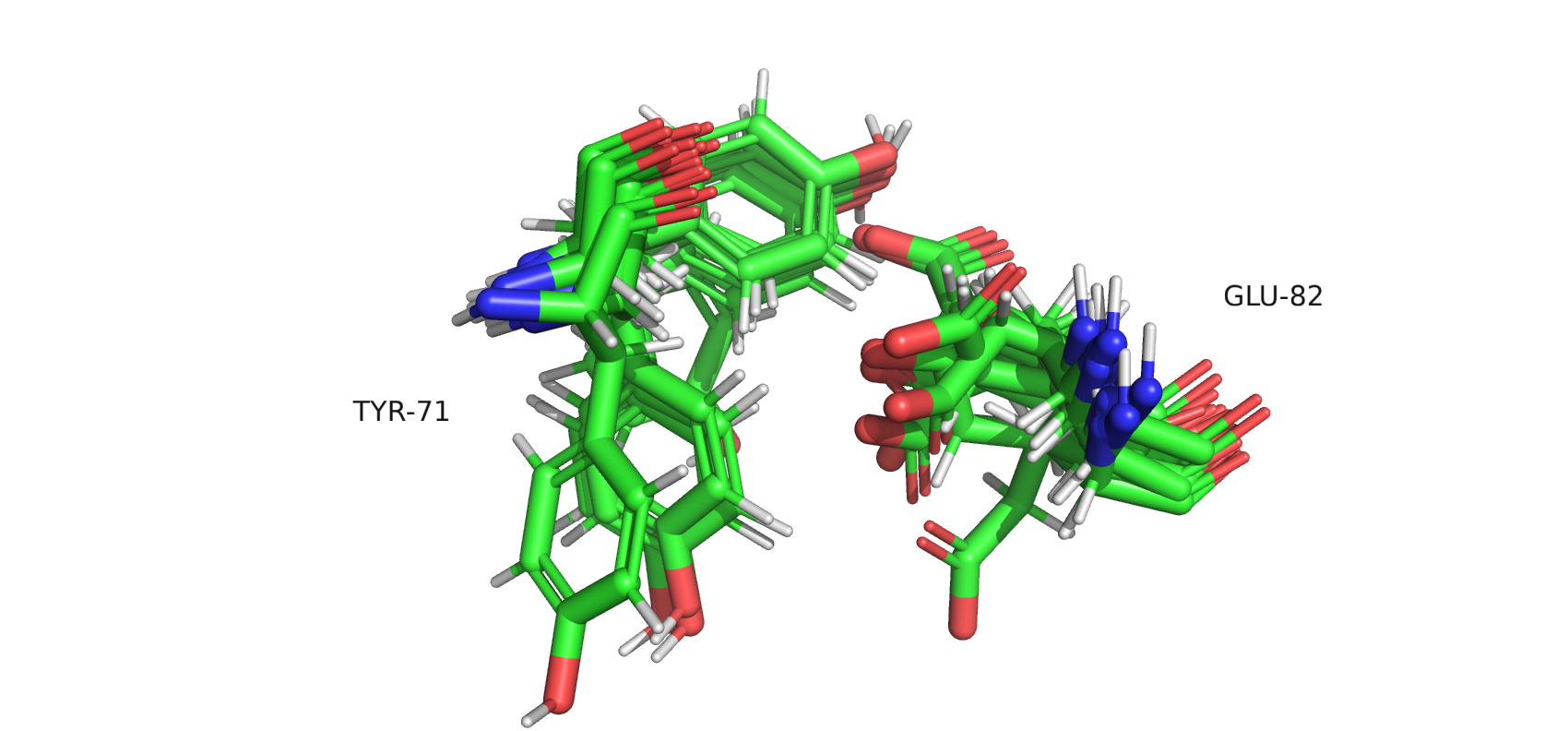
рис.9. Расположение TYR-71 и GLU-82, боковые цепи в ядре белка
Мало того что расстояние для образование водородной связи слишком большое, так ещё и остатки достаточно подвижные (особенно TYR-71, имеет несколько предполагаемых положений). Из этого можно сделать вывод, что остатки были подобраны неудачно, водородной связи не образуют, а структура РСА содержит неточные данные о расположении TYR-102 и GLU-113.
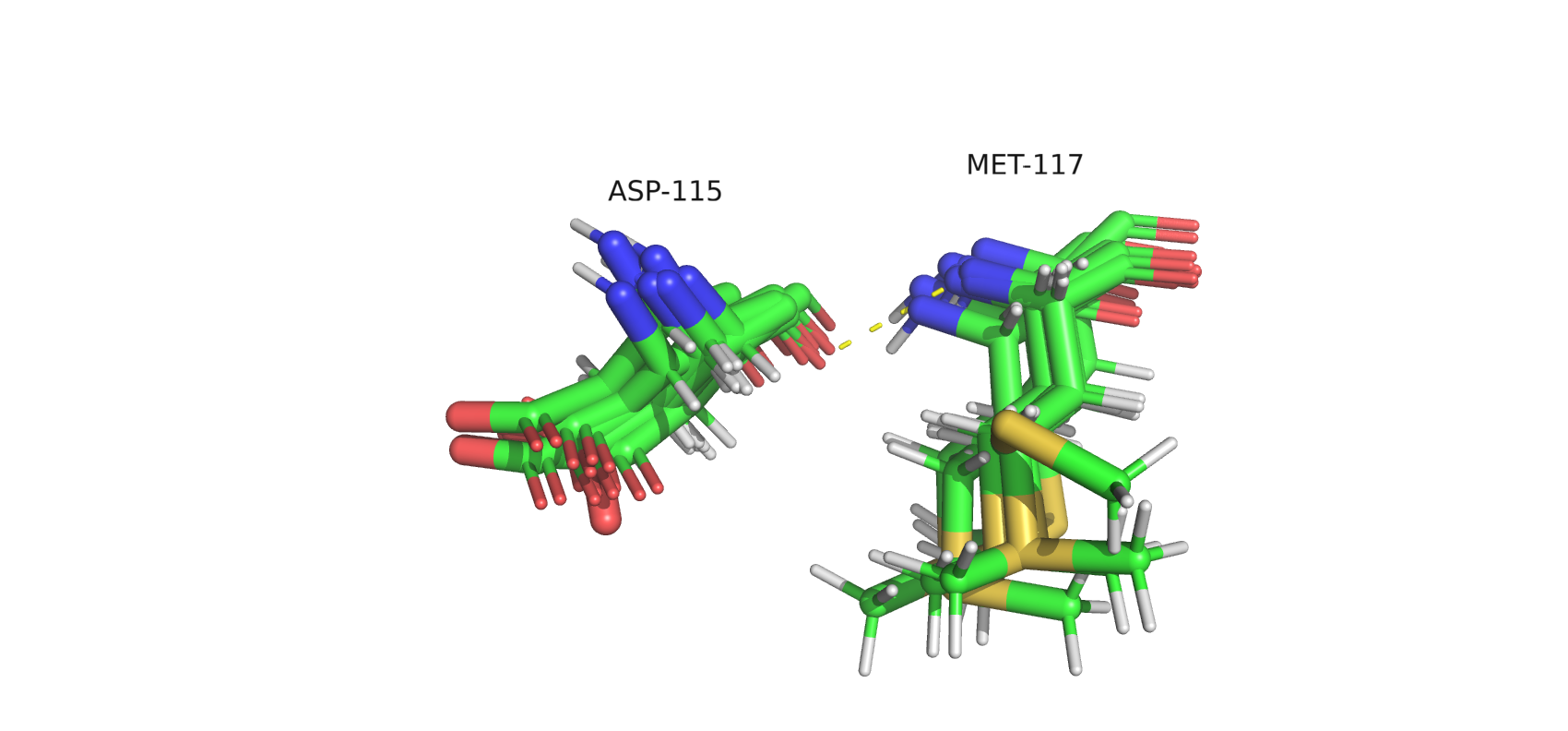
рис.10. Водородная связь между ASP-115 и MET-117, боковая цепь на поверхности белка
На мой взгляд это наиболее подвижный участок (можно наблюдать достаточно сильное отклонение в некоторых моделях).
Самое интересное - атомы остатков, образующие водородную связь, как раз малоподвижны (хорошо накладываются друг на друга), а вот атома, не образующие связь, отклоняются. Данный участок и должен быть подвижным, он входит в состав боковой цепи на поверхности белка.