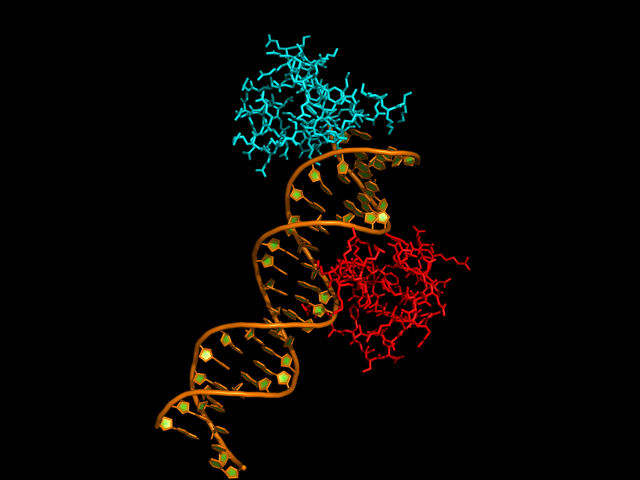

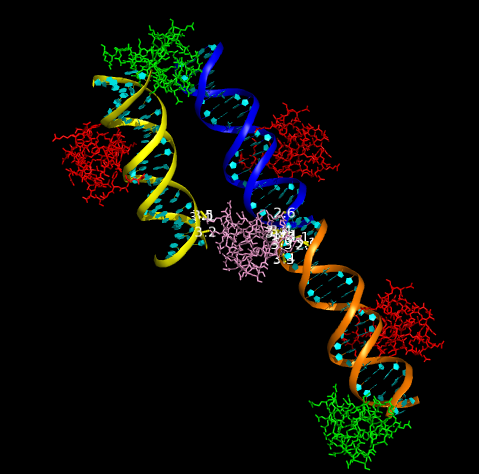
Далее была выполнена команда symexp относительно белковой цепи B с целью восстановить ближайших соседей. Порог расстояния был выбран 30 ангстрем, так как на меньших расстояниях симметричность и структуры была заметна плохо. Ниже представлено полученное изображение.
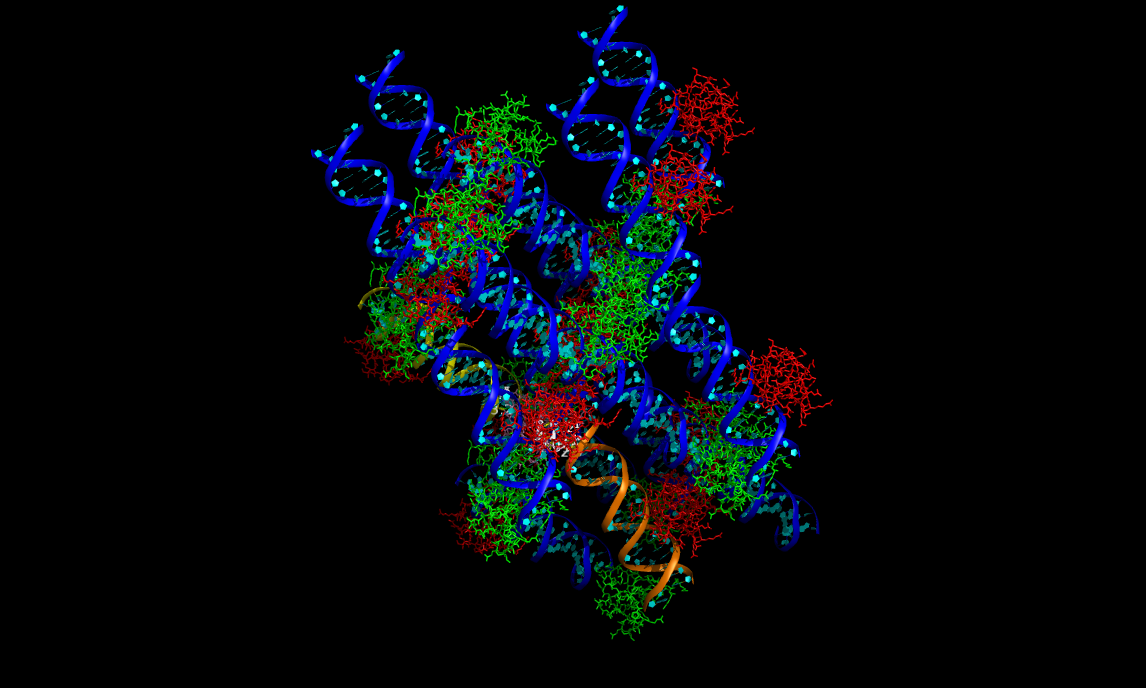
Далее, с помощью команды dist были построены все возможные водородные связи для цепочки B и молекул ДНК из соседних ячеек. На данном рисунке преведна молекула цепи B розовым цветом, и показаны водородные связи для нее и для двух соседних молекул ДНК.
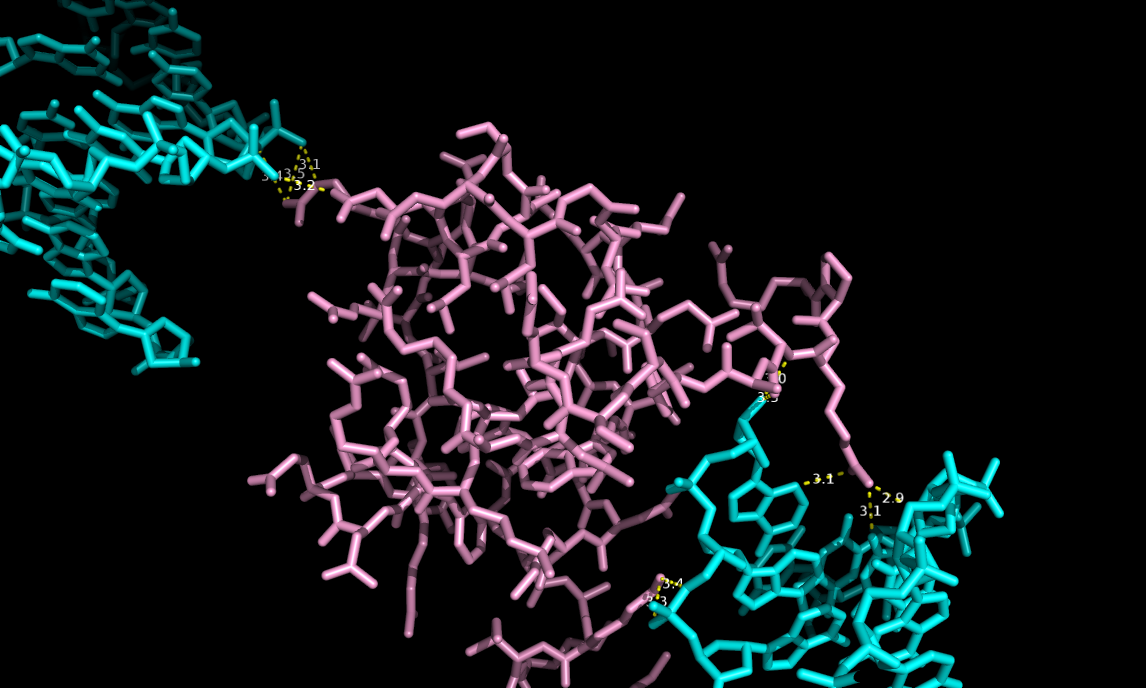
Чтобы наглядно продемонстрировать с какими цепями ДНК в кристалее имеет водородные связи цепь B, приведен следующий рисунок. Молекулы ДНК, с которыми у цепи B есть полярные связи, окрашены в оранжевый, cиний и желтый цвета. Оранжевым покрашена исходная молекула ДНК. Желтым и синим - восстановленные молекулы (командой symexp).
| Атомы цепи B | Атомы молекул ДНК |
| GLN33-NE2 | DG205-OP1(sym01000001) |
| ARG29-NE | DC206-OP1(sym01000001) |
| ARG29-NH2 | DC206-OP1(sym01000001) |
| ARG29-NH2 | DG205-O3(sym01000001) |
| THR6-O | DA342-O3(sym0200-100) |
| THR6-N | DA342-O3(sym0200-100) |
| ARG5-NH1 | DT204-O4(sym0200-100) |
| ARG5-NH1 | DT203-O2(sym0200-100) |
| ARG5-NH2 | DA342-N3(sym0200-100) |
| LYS55-NZ | DA341-OP2(sym0200-100) |
| LYS55-NZ | DA341-O5(sym0200-100) |
В таблице, приведенной выше, описаны все атомы из цепи В и цепей молекул ДНК (соседних), которые между собой образуют водородные связи. Не учтены водородные связи, образуемые между цепью B и исходной цепочкой ДНК (она оранжевая!).

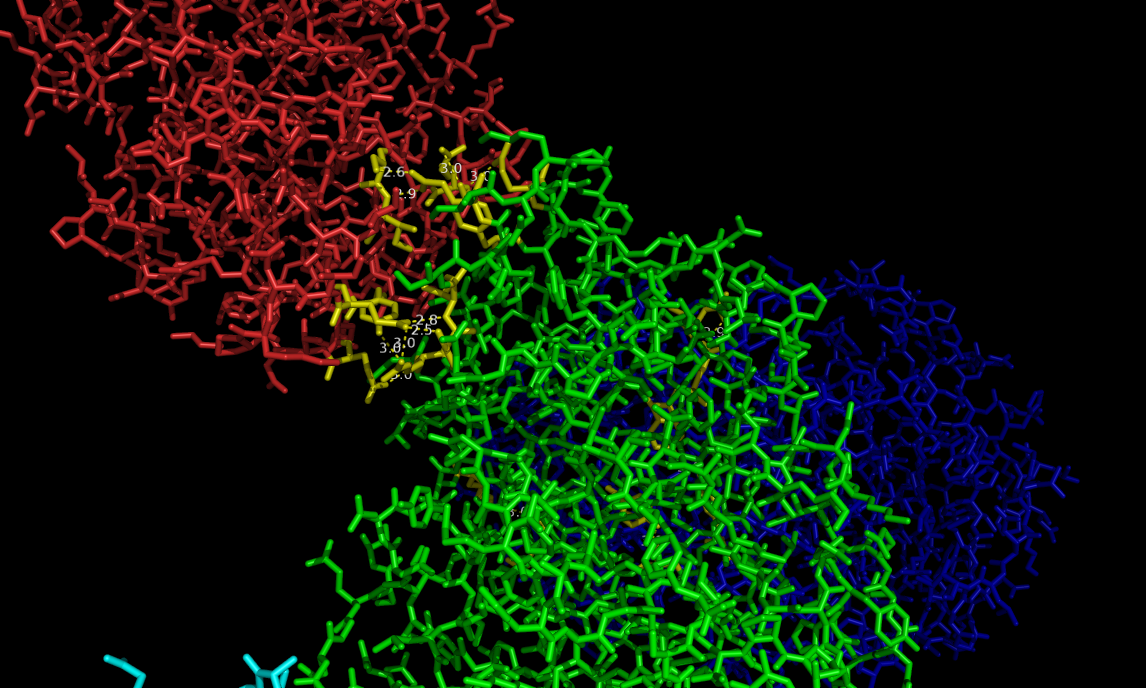
Для начала была взята молекула цепи А, и для нее были построены все возможные водородные связи с соседними молекулами. Оказалось, что это исключительно молекулы цепей B соседних белков (3 таких цепи - на картинке слева: цепь А - синяя, а три цепи В соседних молекул, с которыми у нее есть водородные связи, окрашены оранжевым, розовым и красным; аминокислотные остатки, участвующие в образовании водородной связи, помечены желтым цветом):
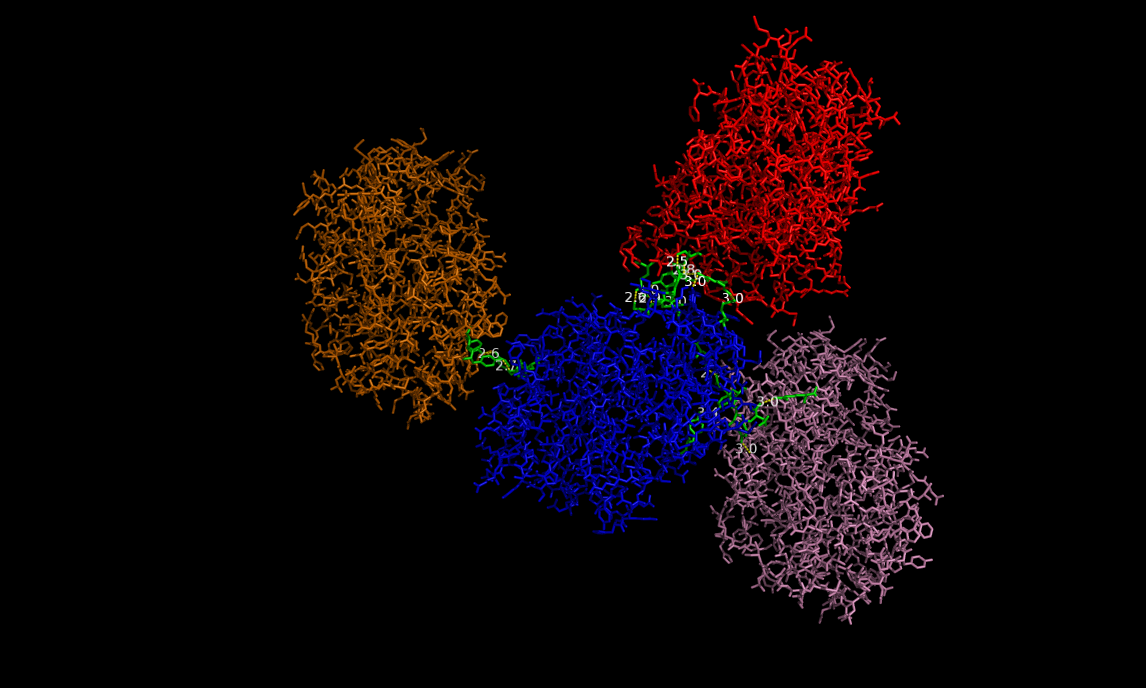
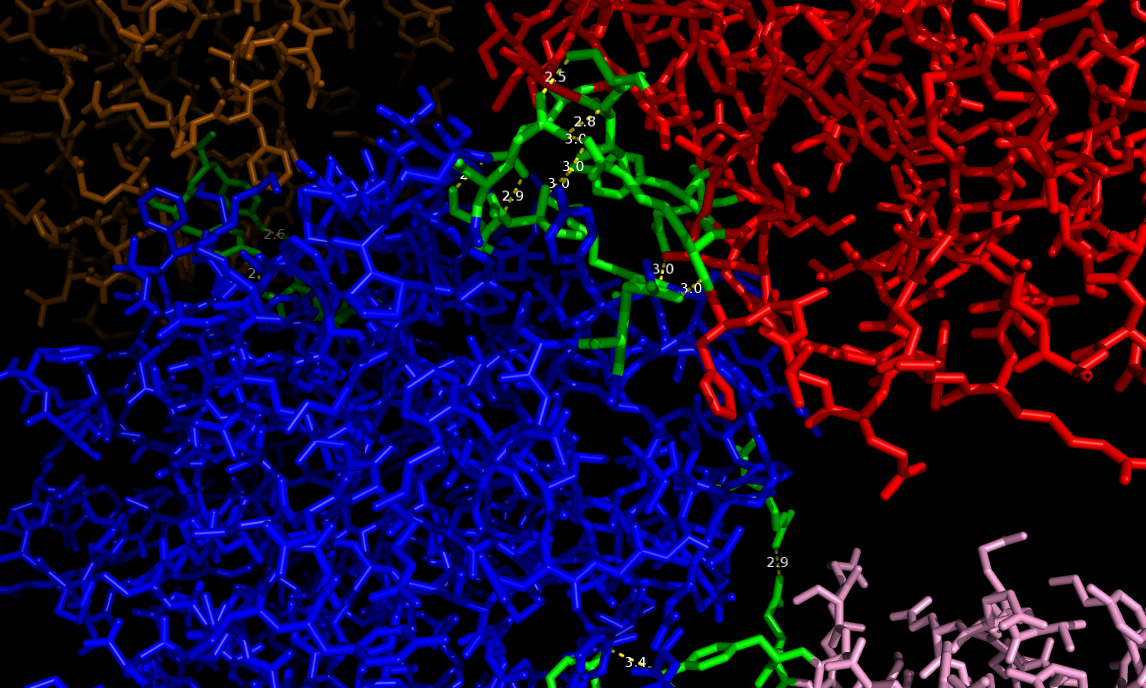
Все определенные водородные связи приведены в таблице (sym прописан для удобства, чтобы различать разные молекулы):
| Атомы цепи А | Атомы цепей В соседних молекул |
| TYR24-OH | sym000000-1-TYR25-OH |
| TYR24-OH | sym000000-1-TYR25-OH |
| ARG168-NH1 | sym00-10000-GLU143-OE2 |
| TYR149-OH | sym00-10000-TYR142-OH |
| TYR139-O | sym00-10000-ARG168-NH2 |
| TYR142-OH | sym00-10000-PRO160-O |
| SER108-OG | sym01000000-GLU113-OE1 |
| ILE109-N | sym01000000-GLU113-OE2 |
| ARG176-NH2 | sym01000000-TYR183-OH |
| ARG176-N | sym01000000-GLU196-OE1 |
| GLU113-OE1 | sym01000000-SER108-OG |
| GLU113-OE2 | sym01000000-ILE109-N |
| GLU113-OE2 | sym01000000-ARG176-NH2 |
| GLU186-OE1 | sym01000000-ARG176-N |
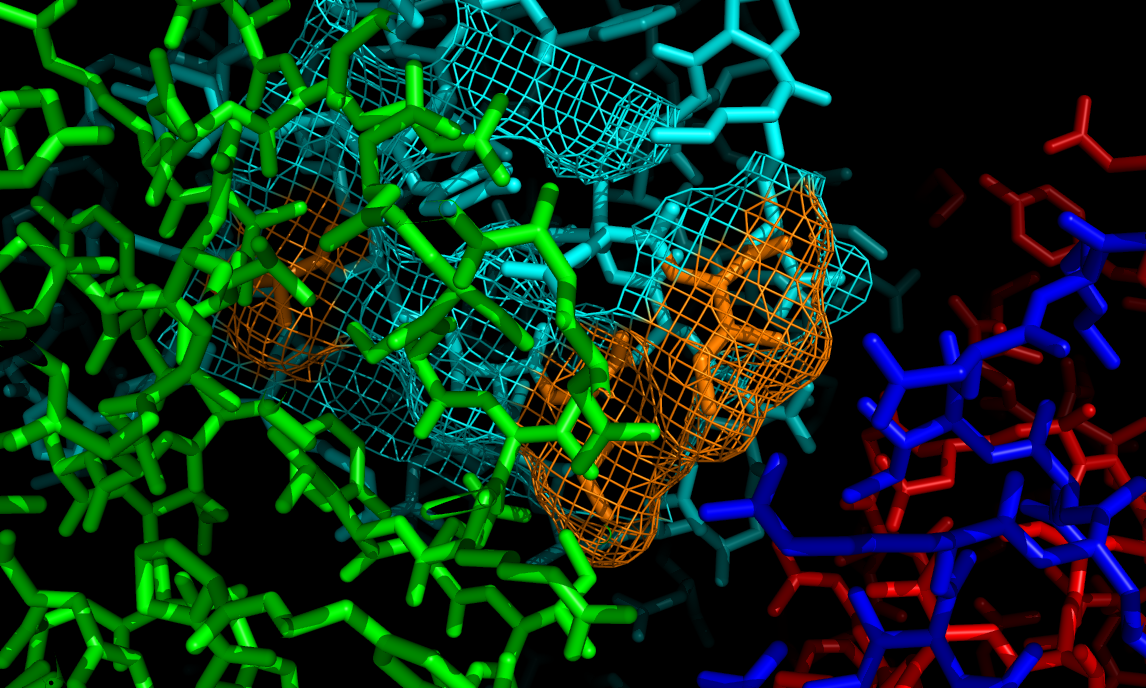
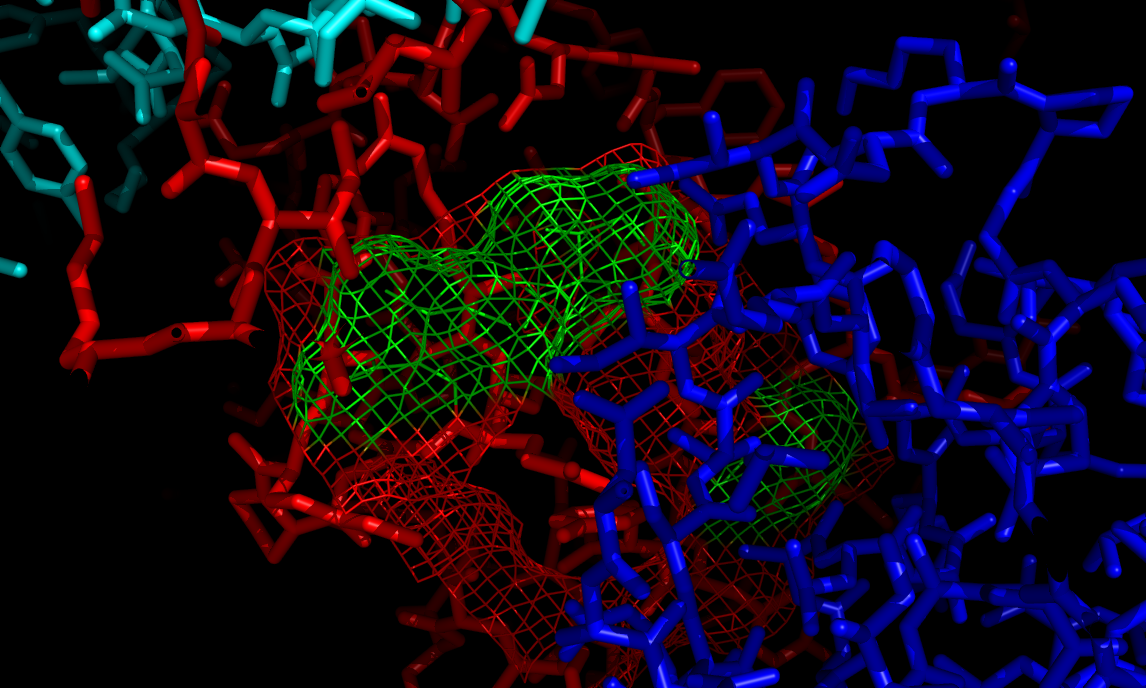
Всего выявлено 14 водородных связей между цепью А исходной молекулы и 3-мя цепями В соседних молекул. С гидрофобными связями все сложнее. Для моего белка почти все гидрофобные связи спрятаны внутри глобулы и на поверхности экспонированы полярные молекулы. Однако имеется 3 аминокислоты, на поверхности глобулы одной из цепей В вокруг исходной цепи А, которые могут образовывать гидрофобную поверхность - ala179, ile114, ile110 - sym01000000 chain B. Они помечены зеленым цветом на рисунке внизу.
Для цепи B из исходной молекулы получились очень похожие результаты. Действительно, цепь В образует водородные связи с 3-мя соседними молекулами, но только с цепями А! На рисунке ниже слева цепь В отмечена зеленым; остатки, участвующие в образовании водородных связей - желтые.
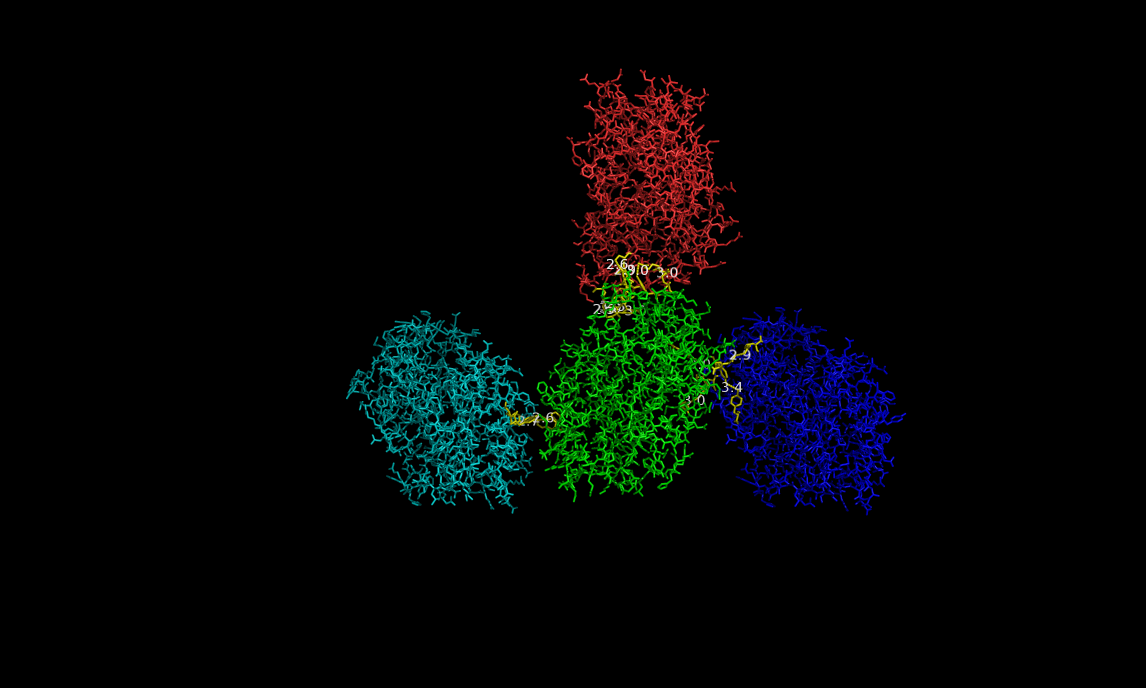
Все определенные водородные связи приведены в таблице (sym прописан для удобства, чтобы различать разные молекулы):
| Атомы цепи B | Атомы цепей A соседних молекул |
| ARG168-NH2 | sym00010000-GLU139-O |
| PRO160-O | sym00010000-TYR142-OH |
| TYR142-OH | sym00010000-TYR149-OH |
| GLU143-OE2 | sym00010000-ARG168-NH1 |
| SER108-OG | sym01000000-GLU113-OE1 |
| ILE109-N | sym01000000-GLU113-OE2 |
| ARG176-NH2 | sym01000000-GLU113-OE2 |
| ARG176-NH2 | sym01000000-TYR183-OH |
| ARG176-N | sym01000000-GLU186-OE1 |
| GLU113-OE1 | sym01000000-SER108-OG |
| GLU113-OE2 | sym01000000-ILE109-N |
| TYR183-OH | sym01000000-ARG176-NH2 |
| GLU186-OE1 | sym01000000-ARG176-N |
| TYR25-OH | sym00000001-TYR24-OH |
| TYR24-OH | sym00000001-TYR25-OH |
В данном случае водородных связей 15. Обратите внимание на схожесть с цепью А! Например, и там и там есть водородная связь между остатками SER108-OG и GLU113-OE1, и таких примеров несколько, что указывает на схожесть друг с другом цепей А и В. Также, указание на сходство двух цепей, потенциальный гидрофобный контакт на границе двух субъединиц из соседней ячейки. Для цепи В выступают гидрофобными те же остатки на соседней цепочке А, что и для цепи А на соседней с ней цепочке В (см. выше). Если конкретнее, то вот они эти аминокислоты для цепи В - ala179, ile114, ile110 - sym01000000 chain A. Обратите внимание, тот же самый сосед, но просто разные цепи! На рисунке ниже эти аминокислоты помечены оранжевым, а исходная цепь В - зеленым. Гидрофобные контакты построены из соображения оптимального расстояния неполярной связи 5 ангстрем.