На данной странице представлен практикум по созданию Jmol апплета для визуализации биомолекул
Представленный белок – гидролаза, выделенная из Rosa hybrid cultivar в 2020 году[1],[2]. В его структуре обнаруживается один лиганд – гераниолпирофосфат, что свидетельствует о
участии данного белка в метаболизме изопреноидов. Это предположение подтверждается данными со страницы RSCB PDB, посвященной данному белку[3]. Идентификатор белка – 6YPF.
Для запуска скрипта нажмите кнопку "Start", для смены изображения – кнопку "Resume", также Вы можете включить или отключить вращение белка с помощью кнопок "Spin on" и "Spin off".
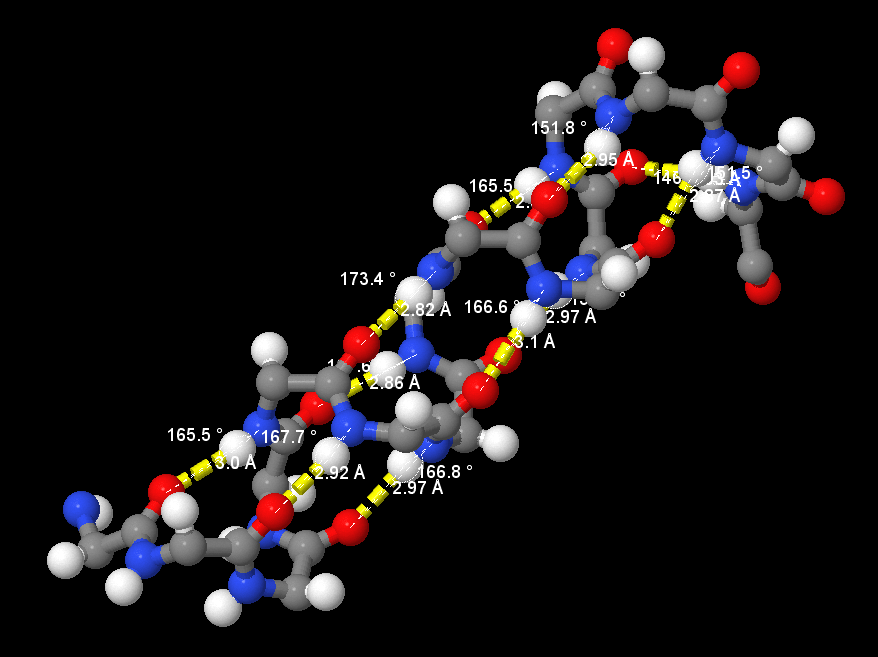

Таблица с измерениями элементов вторичной организации белка:
| № | Имена атомов | Длина связи (Å) | Угол N-H-O (°) | |
|---|---|---|---|---|
| Альфа-спираль | ||||
| 1 | N(59CYS)-O(55SER) | 3.00 | 165.5 | |
| 2 | N(60ALA)-O(56PHE) | 2.92 | 167.7 | |
| 3 | N(61ALA)-O(57GLU) | 2.97 | 166.8 | |
| 4 | N(62ARG)-O(58GLU) | 2.86 | 167.6 | |
| 5 | N(63GLU)-O(59CYS) | 2.82 | 173.4 | |
| 6 | N(64LEU)-O(60ALA) | 3.10 | 166.6 | |
| 7 | N(65LYS)-O(61ALA) | 2.97 | 157.0 | |
| 8 | N(66GLU)-O(62ARG) | 2.85 | 165.5 | |
| 9 | N(67GLU)-O(63GLU) | 2.95 | 151.8 | |
| 10 | N(68THR)-O(64LEU) | 2.87 | 151.5 | |
| Среднее | 2.93Å | 163.3° | ||
| Параллельный Бета-тяж | ||||
| 1 | N(16LYS)-O(93GLN) | 2.85 | 163.1 | |
| 2 | N(95VAL)-O(16LYS) | 2.84 | 153.4 | |
| 3 | N(18ALA)-O(95VAL) | 2.93 | 158.0 | |
| 4 | N(97VAL)-O(18ALA) | 2.85 | 168.3 | |
| 5 | N(20VAL)-O(97VAL) | 2.86 | 164.1 | |
| 6 | N(99MET)-O(20VAL) | 2.83 | 163.9 | |
| 7 | N(22CYS)-O(99MET) | 2.69 | 169.8 | |
| 8 | N(101ALA)-O(22CYS) | 2.99 | 142.1 | |
| 9 | N(24LEU)-O(101ALA) | 2.94 | 172.2 | |
| Среднее | 2.86Å | 161.7° | ||
| Антипараллельный Бета-тяж | ||||
| 1 | N(94TYR)-O(83ASN) | 2.72 | 162.7 | |
| 2 | N(83ASN)-O(94TYR) | 2.88 | 128.9 | |
| 3 | N(96ALA)-O(81THR) | 2.88 | 159.6 | |
| 4 | N(81THR)-O(96ALA) | 2.95 | 154.9 | |
| 5 | N(98PHE)-O(79THR) | 2.86 | 169.5 | |
| 6 | N(78LEU)-O(98PHE) | 2.86 | 169.1 | |
| 7 | N(100ARG)-O(76GLU) | 2.82 | 156.2 | |
| 8 | N(76GLU)-O(100ARG) | 2.85 | 153.7 | |
| 9 | N(102VAL)-O(73GLY) | 2.96 | 168.5 | |
| 10 | N(73GLY)-O(102VAL) | 2.73 | 161.1 | |
| Среднее | 2.85Å | 158.4° | ||
Обсуждение.
Средняя длина водордной связи в альфа-спирали по результатам измерений составляет 2.93Å(максимальное - 3.10Å
, минимальное - 2.82Å), а средний угол N-H-O равен 163.3°(макимальный - 173.4°, минимальный - 151.5°).
По литературным данным[4], стандартное значение длины между кислородом и азотом в
водородной связи - 2.99±0.14Å, а угол - 155±11°. Некоторые полученные значения выбиваются из этих диапозонов, но среднее значение соответствует стандартам. Выбившиеся измерения можно
объяснить переходом правозакрученной альфа-спирали в левозакрученную на конце рассатриваемого участка(можно увидеть на соответсвующей вкладке в апплете)
Средняя длина водордной связи в параллельном бета-листе по результатам измерений составляет 2.86Å(максимальное - 2.99Å, минимальное - 2.69Å), а средний угол N-H-O равен 161.7°(макимальный - 172.2°,
минимальный - 142.1°).
По литературным данным[4], стандартное значение длины между кислородом и азотом в водородной связи - 2.92±0.14Å, а угол - 161±9°. Некоторые полученные
значения выбиваются из этих диапозонов, но среднее значение также соответствует стандартам.
Средняя длина водордной связи в антипараллельном бета-листе по результатам измерений составляет
2.85Å(максимальное - 2.96Å, минимальное - 2.72Å), а средний угол N-H-O равен 158.4°(макимальный - 169.5°, минимальный - 128.9°).
По литературным данным[4], стандартное значение длины
между кислородом и азотом в водородной связи - 2.91±0.14Å, а угол - 160±10°. Некоторые полученные значения выбиваются из этих диапозонов, но среднее значение также соответствует стандартам.
Выбившиеся измерения можно объяснить закрученностью бета-листов на рассматриваемом участке(можно увидеть на соответсвующей вкладке в апплете), что свидетельствует о напряженности этих
связей(так как отличны от идеальных 180°[5]) и как следствие, о средней силе этих взаимодействий.
Литература.
1)Sun,P., Dégut,C., Réty,S. (2020), Functional diversification in the Nudix hydrolase gene family
drives sesquiterpene biosynthesis in Rosa wichurana. Plant J., 104: 185-199.
2)Страница Wiley Online Library со ссылкой на статью о белке
https://onlinelibrary.wiley.com/doi/10.1111/tpj.14916
3)Cтраница RSCB PDB, посвященная изучаемому белку.
https://www.rcsb.org/structure/6YPF
4)Baker, E. N. & Hubbard, R. E. (1984). Hydrogen bonding in globular proteins. Prog. Biophys. Mol. Biol., Vol. 44, pp. 97 179.
5)Steiner, T. The Hydrogen Bond in the Solid State / T. Steiner // Angew. Chem. Int. Ed. - 2002. - V. 41. - P. 48-76.