На данной странице представлен практикум по анализу структуры и участков трансмембранных белков в различных базах данных.
1) База данных OPM:
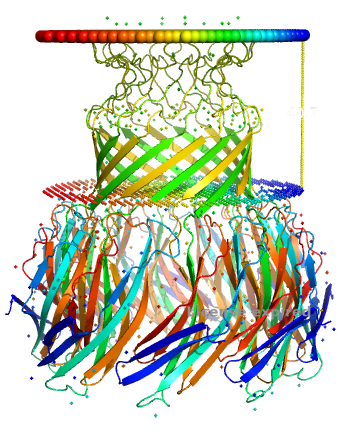
Для анализа был выбран Porin MspA:
- Название: Main porin from Mycobacterium smegmatis (MspA) – Основной порин Mycobacterium smegmatis (MspA)
- Организм Mycolicibacterium smegmatis - Грам+ бактерия
- Функция: Транспорт из внеклеточной среды фосфатов, различных аминокислот и катионов. Также играет роль в транспорте антибиотиков бета-лактамного ряда.
- Выдача ОРМ: Ссылка
- Идентификатор Uniprot: A0QR29
- Структура: 1UUN
| Толщина трансмембранной части белка: | 40,7 Å |
|---|---|
| Координаты трансмембранных участков: | A: 1(74-83),2(111-119) B: 1(74-83),2(111-119) C: 1(74-83),2(111-119) D: 1(74-83),2(111-119) E: 1(74-83),2(111-119) F: 1(74-83),2(111-119) G: 1(74-83),2(111-119) H: 1(74-83),2(111-119) |
| Количество остатков а/к в одном тяже β-листа: | 19 |
| Местонахождение белка: | Единственная мембрана Грам+ бактерии |
Комментарии к таблице:
1) Ширина трансмембранного участка подтверждается данными со страницы
выдачи ОРМ (The calculated intrinsic hydrophobic thickness of the MspA stem domain is ~41 A.)
2) Белок является гомооктомером, поэтому координаты трансмембранных участков в разных субъединицах
одинаковы.
3) Количество остатков а/к в одном тяже β-листа бралось для одной субъединицы, хотя формально это все один β-лист, формирующий β-бочонок.
4) M. smegmatis является
Грамм-положительной бактерией, поэтому она имеет только одну мембрану, в которой и находится изучаемый белок.
2) DeepTMHMM: Предсказание ТМ элементов по последовательности белка:
Для анализа и предсказания были взяты два белка:
- Main porin M. smegmatis (MspA) из предыдущего упражнения
- Probable beta-carotene 15,15'-dioxygenase (Blh) - деоксигеназа β-каротина из археи Halobacterium salinarum. Данный фермент участвует в синтезе бактериородопсина, катализируя расщепление β-каротина до двух молекул ретиналя. Он локализован в клеточной мембране и представляет собой α-спиральный трансмембранный белок
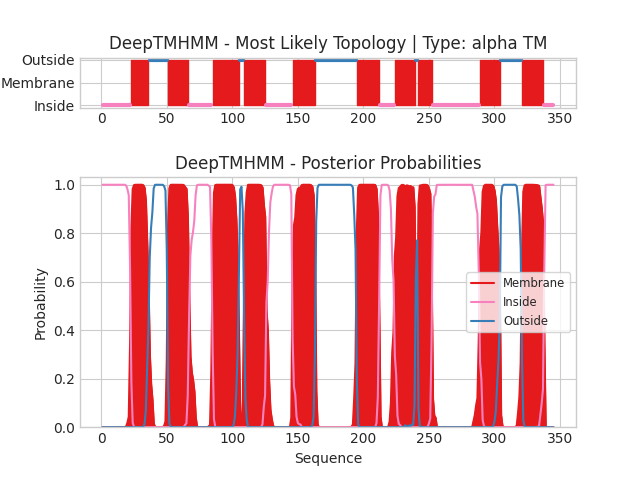
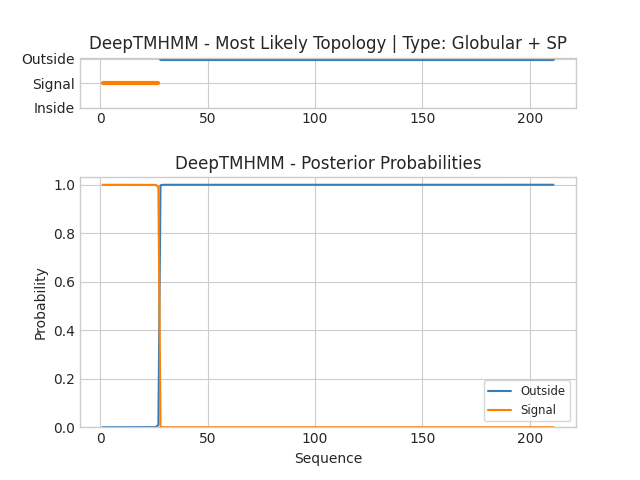
Иллюстрация выдачи: на верхнем рисунке изображено расположение белка в мембране: красным цветом выделены трансмембранные участки, синим - внеклеточные, розовым - внутриклеточные. На нижнем рисунке для каждого остатка белка показаны вероятности вхождения в одну из этих категорий, цвета те же.
Blh
Результат предсказания трансмембранных элементов для белка Blh:
Текстовая-gff3 выдача сервиса:
>sp|Q9HNE6|BLH_HALSA | TM
MGASPVALTPLTARARRTLARPALALGWVAISIAALPAITGVSLSPTARYAPLVASAVVFGMPHGAIDYLALPRAVTGTVTVRWLAVVGVLYLVLGGGYAAAWFFAPVPAAFAFVAITWLHWGQGDLYPLLDFLDVDYLDTRPRRAATVLIRGGLPMLVPLLGFPERYRSVVDAFAAPFGGSVGDLAVFDPRVRLWLGVAFAAATVAVLAAGRRRTHSPGAWRVDAAETLLLWVFFFVVPPVFAVGVYFCVWHSVRHVARAIAVDGSVHPSLRAGDILGPLARFGVEAAPMTAAALALGGVLWWAVPNPPTTLESGAALYLVLIAVLTLPHVAVVTWMDRVQGVL
IIIIIIIIIIIIIIIIIIIIIIMMMMMMMMMMMMMMOOOOOOOOOOOOOOMMMMMMMMMMMMMMMMIIIIIIIIIIIIIIIIIIMMMMMMMMMMMMMMMMMMMMMOOOMMMMMMMMMMMMMMMMMIIIIIIIIIIIIIIIIIIIIMMMMMMMMMMMMMMMMMMOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOMMMMMMMMMMMMMMMMMMIIIIIIIIIIIMMMMMMMMMMMMMMMMOOMMMMMMMMMMMIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIMMMMMMMMMMMMMMMMOOOOOOOOOOOOOOOOMMMMMMMMMMMMMMMMMIIIIIIII
Для данного белка отчетливо предсказаны 10 трансмембранных участков, что согласуется с его структурой (Рис. 4).
MspA
Результат предсказания трансмембранных элементов для белка MspA:
Текстовая-gff3 выдача сервиса:
>sp|A0QR29|MSPA_MYCS2 | SP
MKAISRVLIAMVAAIAALFTSTGTSHAGLDNELSLVDGQDRTLTVQQWDTFLNGVFPLDRNRLTREWFHSGRAKYIVAGPGADEFEGTLELGYQIGFPWSLGVGINFSYTTPNILIDDGDITAPPFGLNSVITPNLFPGVSISADLGNGPGIQEVATFSVDVSGAEGGVAVSNAHGTVTGAAGGVLLRPFARLIASTGDSVTTYGEPWNMN
SSSSSSSSSSSSSSSSSSSSSSSSSSSOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOOO
К сожалению, алгоритм сервиса не справился с верной аннотацией участков данного белка. Он выдал наличие сигнального участка, а оставшийся фрагмент, по его мнению, никак не связан с мембраной. Видимо,это произошло из-за того, что данный белок является мономером в октомерном гомомерном белке, его трансмембранные свойства проявляются только в присутствии остальных составляющих комплекса
3) PPM: Предсказание положения белка в мембране:
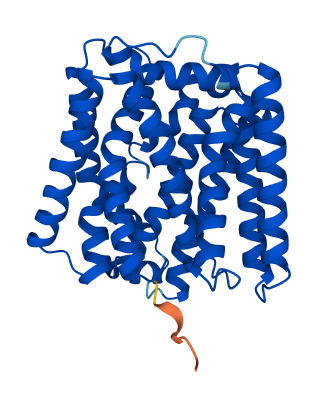
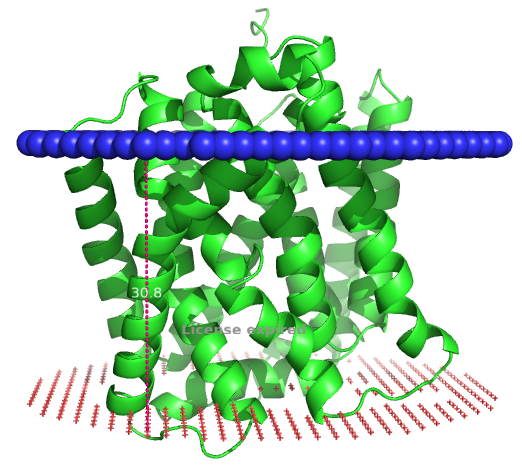
Выданный белок – probable beta-carotene 15,15'-dioxygenase (Blh) (BLH_HALSA) - деоксигеназа β-каротина из археи Halobacterium salinarum. Данный фермент участвует в синтезе бактериородопсина, катализируя расщепление β-каротина до двух молекул ретиналя. Он локализован в клеточной мембране и представляет собой α-спиральный трансмембранный белок. Структура данного белка изображена на рисунке 4.
Для получения предсказания положения данного белка в мембране был запущен сервис PPM с параметрами,
изображенными на рисунке 5.
Комментарии к параметрам:
- Количество мембран, которые пронизывает данный белок, было выбрано исходя из предположения о том, что у архей только одна мембрана.
- Тип мембраны был выбран также из
понимания того, что Halobacterium salinarum – архея.
- Запрет на искривление мембраны был выставлен из-за низкой представленности у архей мембранных органелл, где эта скрученность имеет место быть.
- Топология N-конца была выставлена исходя из данных, полученных в прошлом упражнении с помощью DeepTMHMM.
- Структура белка, предсказанная с помощью AlphaFold, была выгружена из Uniprot –
ссылка.
| Толщина трансмембранной части белка: | 30.8 ± 1.0 Å |
|---|---|
| Координаты трансмембранных участков: | 1( 22- 40), 2( 47- 72), 3( 84- 108), 4( 109- 130), 5( 143- 165), 6( 193- 212), 7( 222- 243), 8( 244- 262), 9( 277- 303), 10( 316- 340) |
| Среднее количество остатков а/к в α-спирали: | 22,8 |
| Местонахождение белка: | Единственная мембрана археи |

4) Сравнение алгоритмов предсказания трансмембранных спиралей:
DeepTMHMM ппоказал себя противоречиво для выбранных белков, как алгоритм предсказания трансмембранных участков. Для белка MspA он совершенно не справился с задачей: не предсказал верно ни один участок. Возможно это связано с олигомерностью белка или с тем, что алгоритм не рассчитан на предсказание положения мономеров относительно мембраны. Для белка Blh алгоритм справился с задачей: прредсказал все 10 трансмембранных участков из 10. Границы данных участков отличаются от истинных незначительно.
Структура, полученная при помощи AlphaFold (Рис. 4), имеет высокую оценку качества предсказания почти для всех аминокислотных остатков, что также одтверждается изображением полученным с помощью сервиса DeepTMHMM. Качество предсказания снижено только в одном месте – на N-концевом участке, но тот вероятно и in vivo не очень стабилен и обладает некоторой вариабельностью положения, т.к. связан через линкер. Могла ли достоверность модели оказать влияние на результаты предсказания сервера PPM? Да, вероятно могла, но не в данном случае, т.к. достоверность модели очень велика и результаты соответствуют друг-другу.
5) База данных TCDB:
MspA
Перевод информации с TCDB: Порин M. smegmatis, MspA (катионоселективен из-за высокой плотности отрицательных зарядов в зоне поры, но транспортирует глюкозу, серин, гидрофильные β-лактамы и (медленно) фосфат (Wolschendorf et al., 2007)). Паралог MspC по-видимому, имеет ту же специфичность, что и MspA. Оба могут также транспортировать фторхинолоны и хлорамфеникол, но не более крупные эритромицин, канамицин и ванкомицин (Danilchanka et al., 2008). Также позволяет поглощать трехвалентное железо (Jones and Niederweis, 2010). Трехмерная структура известна (PDB#1UUN). Это β-бочка с N- и C-концами их одиночных шпилек снаружи, а их цепочки проходят против часовой стрелки вокруг центральной поры. Обе эти характеристики противоположны в большинстве β-стволов грамотрицательных бактерий (Remmert et al., 2010). Образует октамерные потенциалзависимые нанопоры, где каждая субъединица вносит 2 TMS в 16-цепочечный β-ствол (Faller et al., 2004; Rodrigues et al., 2011; Pavlenok et al., 2012). Можно использовать для нанопорового секвенирования (Laszlo et al. 2016). MspA является биосенсором для секвенирования ДНК и многих других приложений, позволяя создавать поры с различными мутациями субъединиц и диаметром пор (Pavlenok et al. 2012), которые можно использовать для нанопорового секвенирования (Laszlo et al. 2016).
Суммируя:
Функция: Транспорт из внеклеточной среды фосфатов, различных аминокислот и катионов. Также играет роль в транспорте антибиотиков бета-лактамного ряда.
Перспективен, как белок, который можно использовать в нанопоровом секвенировании.
ТС код: 1.B.24.1.1
1 - Channels/Pores
B - β-Barrel Porins
24 - The Mycobacterial Porin (MBP) Family
Blh
Белок не был найден, что логично ведь это не транспортер.
Sorry! q9hne6 is not included in TCDB