Пространственная структура белка-ингибитора киназы
PDB ID: 4YBK
Структура в целом
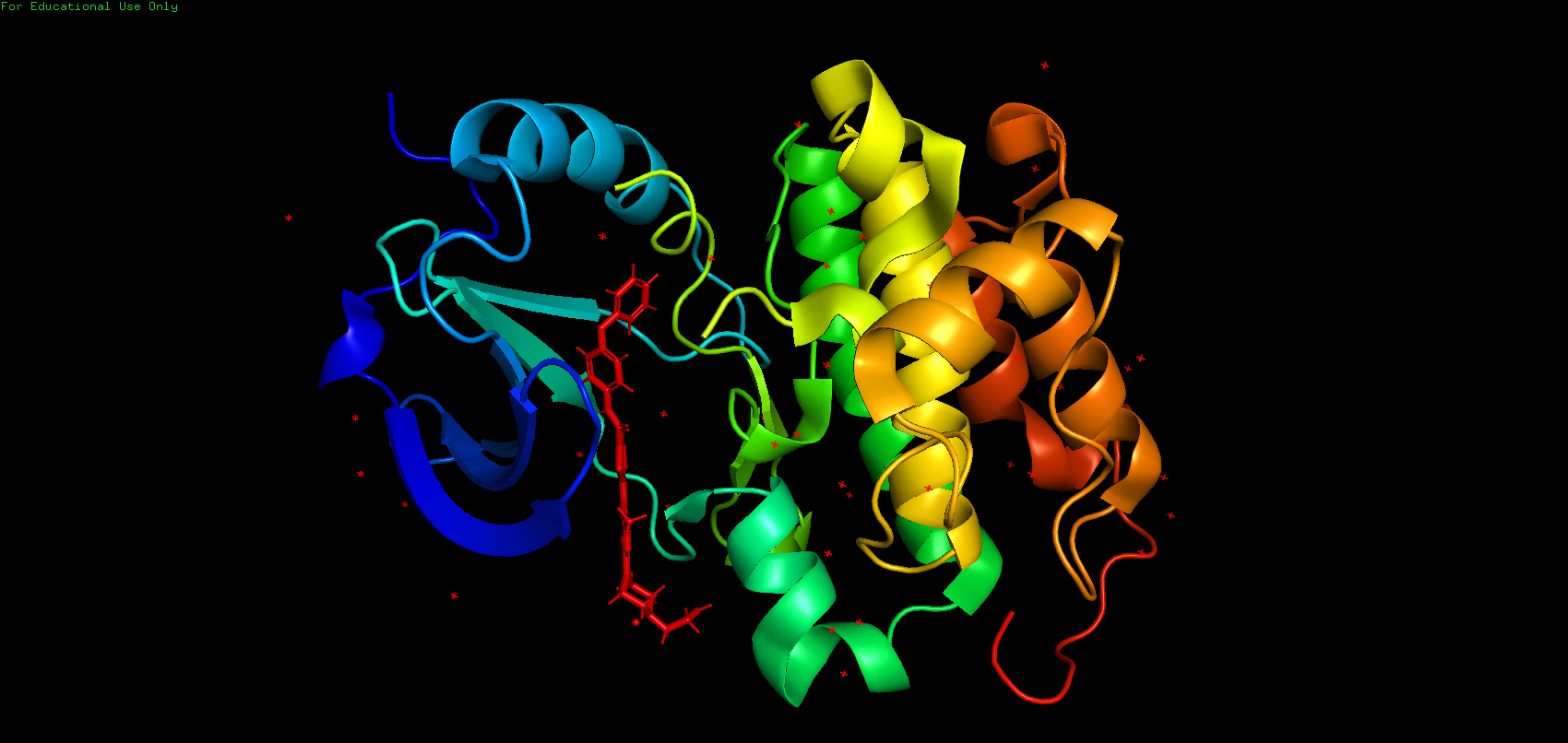
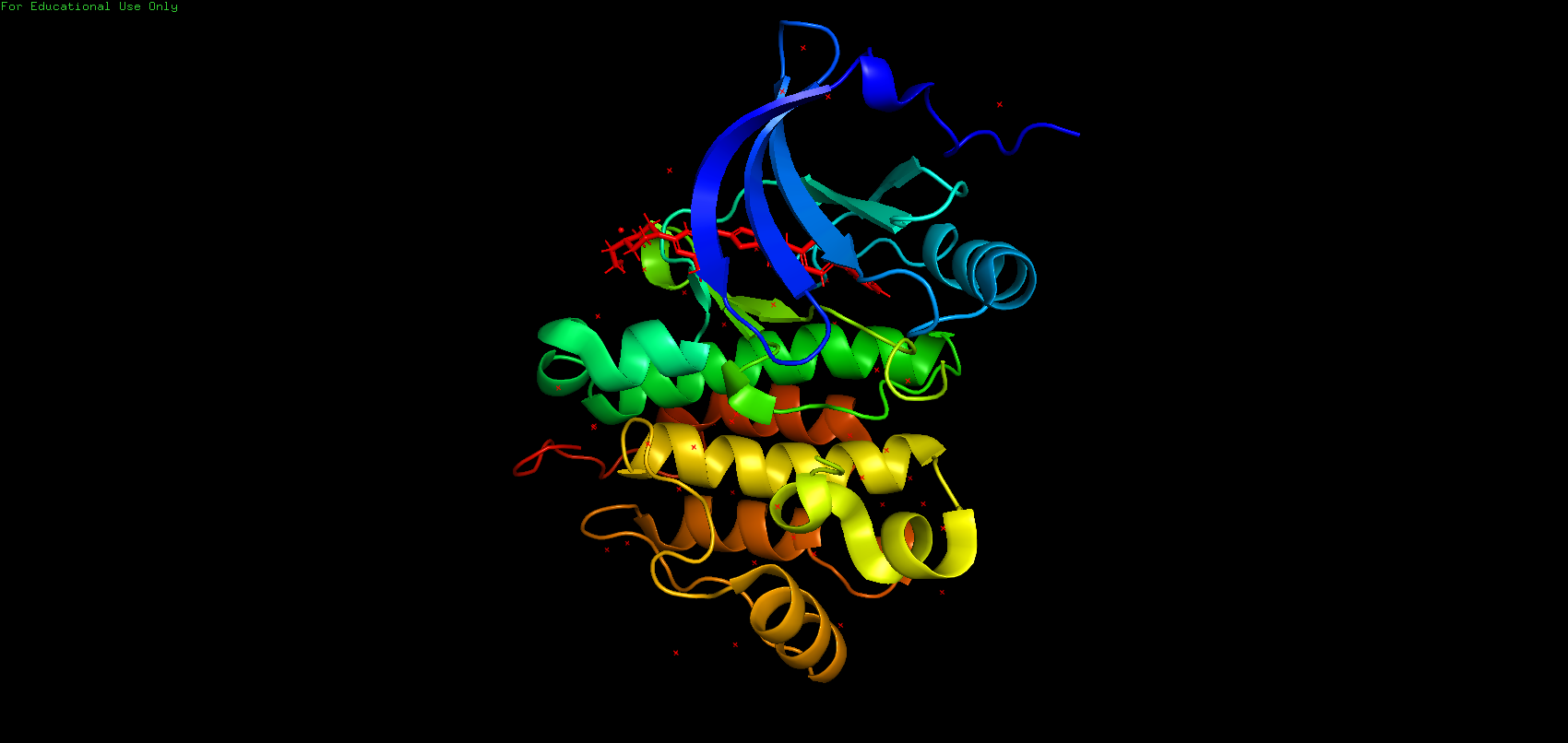
Данная структура представляет собою белковый фермент, который относится к классу трансфераз, т.е. ферментов, катализирующих перенос функциональных групп и молекулярных остатков от одной молекулы к другой. По строению структура является мономером, то есть имеет только одну полимерную цепь. Структура не имеет выраженной симметрии. Биологическая единица полностью совпадает с асимметрической. Является аналогом ингибитора киназы вещества дезатиниба – противоопухолевого средства. Общий вид хода остова полимерных цепей приведён ниже.
Отдельные цепи
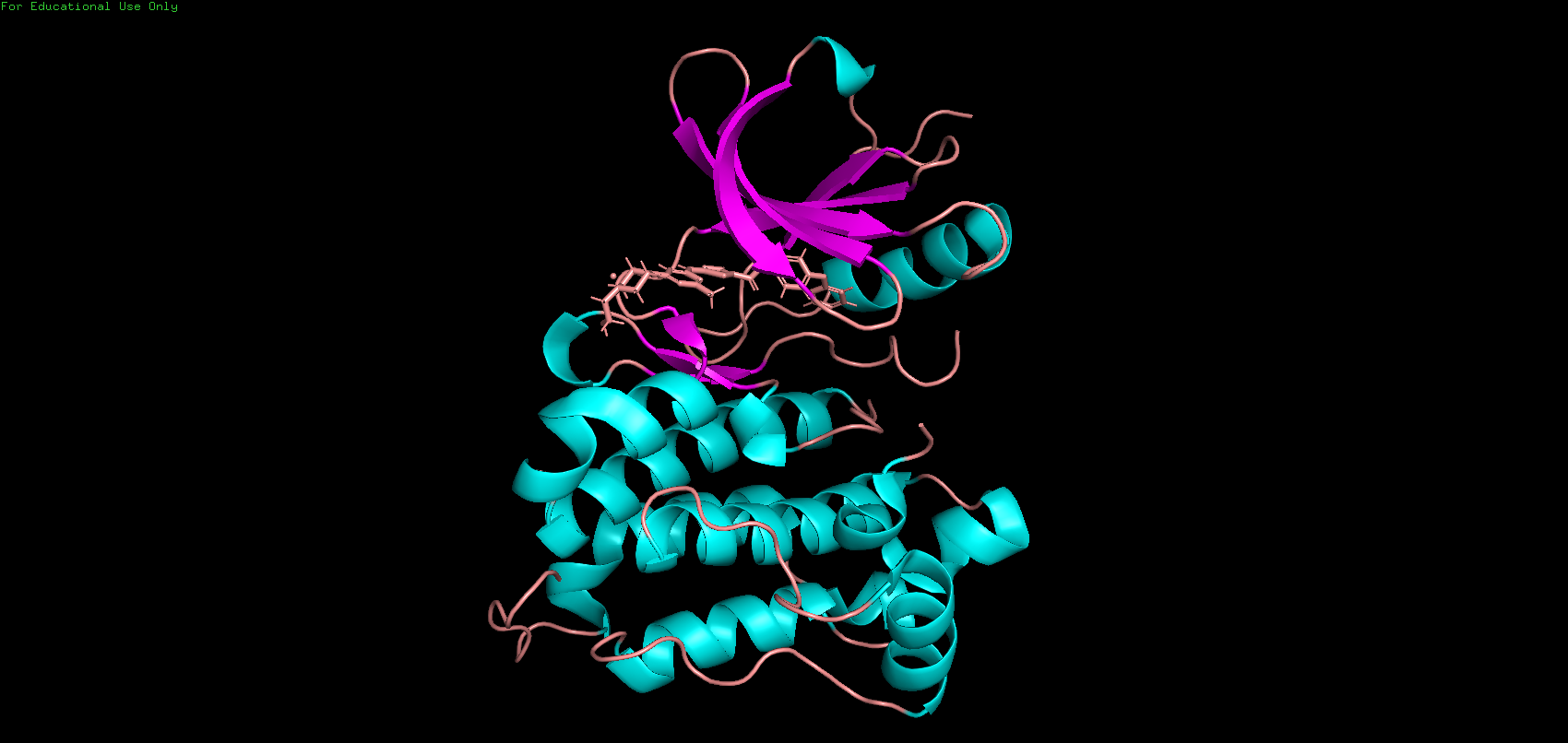
Цепь (как и вся макромолекула) выделена из Gallus gallus (банкивская джунглевая курица). Экспрессирована при помощи бактерии Escherichia coli (кишечная палочка).
Uniprot_id цепи 4YBK_1 (цепь А) — P00523.
Вещество выполняет функцию конформационно-селективного ингибитора киназы.
В последовательности отсутствуют мутации относительно референса из Uniprot.
В составе цепи нет модифицированных остатков аминокислот.
Малые молекулы
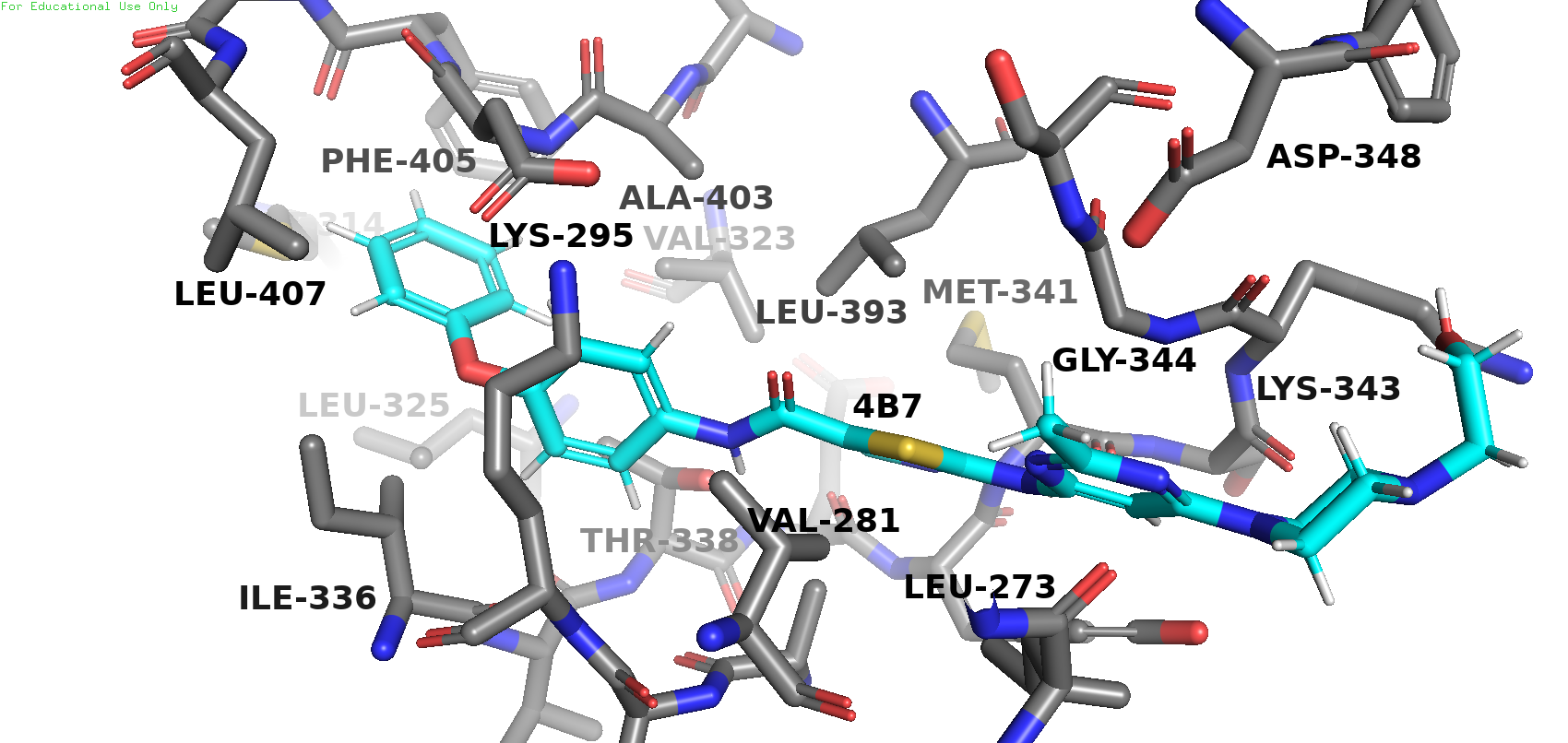
В записи PDB присутствуют два типа малых молекул: 4B7 (2-({6-[4-(2-hydroxyethyl)piperazin-1-yl]-2-methylpyrimidin-4-yl}amino)-N-(4-phenoxyphenyl)-1,3-thiazole-5-carboxamide, брутто-формула: C27 H29 N7 O3 S) и HOH (вода).
Координаты молекул:
Взаимодействия между аминокислотными остатками
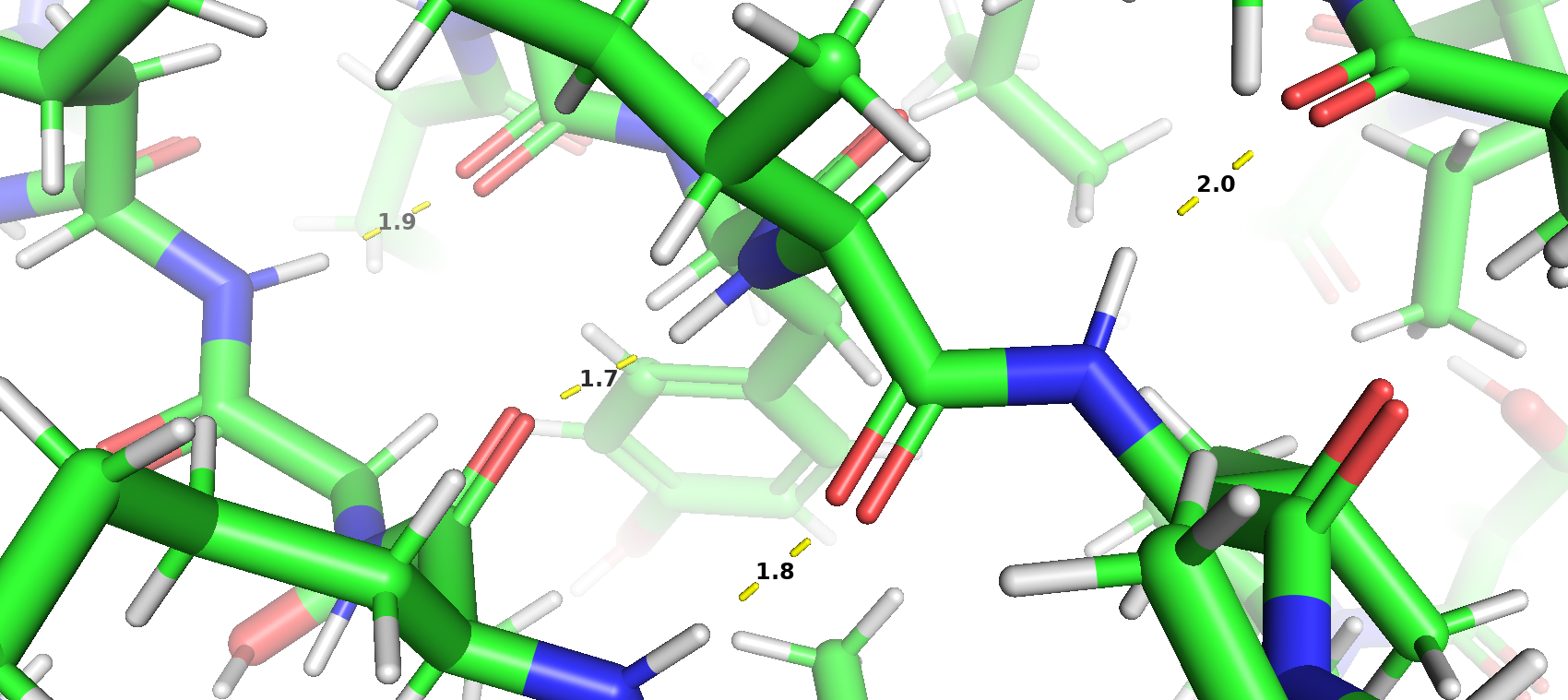
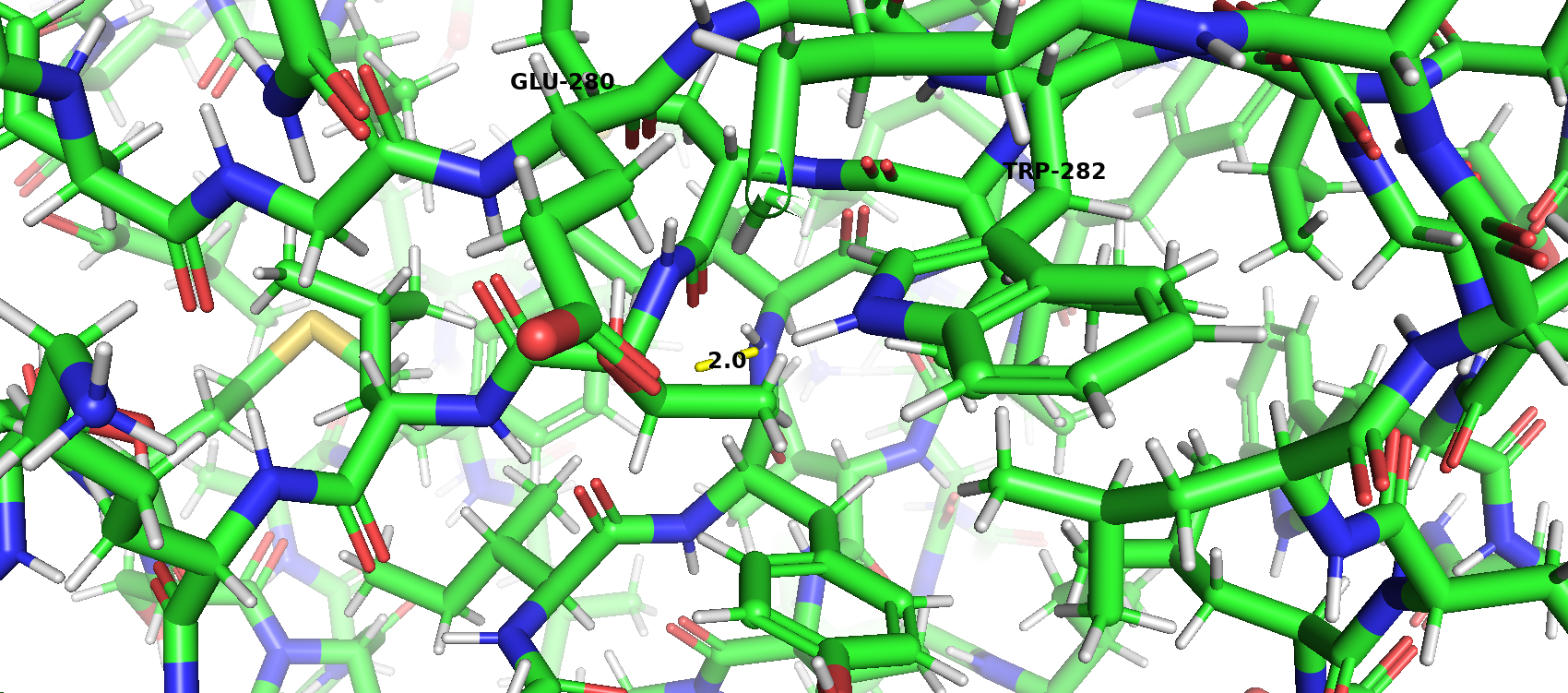
В белковой структуре присутствуют такие типы взаимодействия, как водородные связи, солевые мостики, стекинг. Дисульфидные связи отсутствуют. Фермент был синтезирован при pH 6,5.
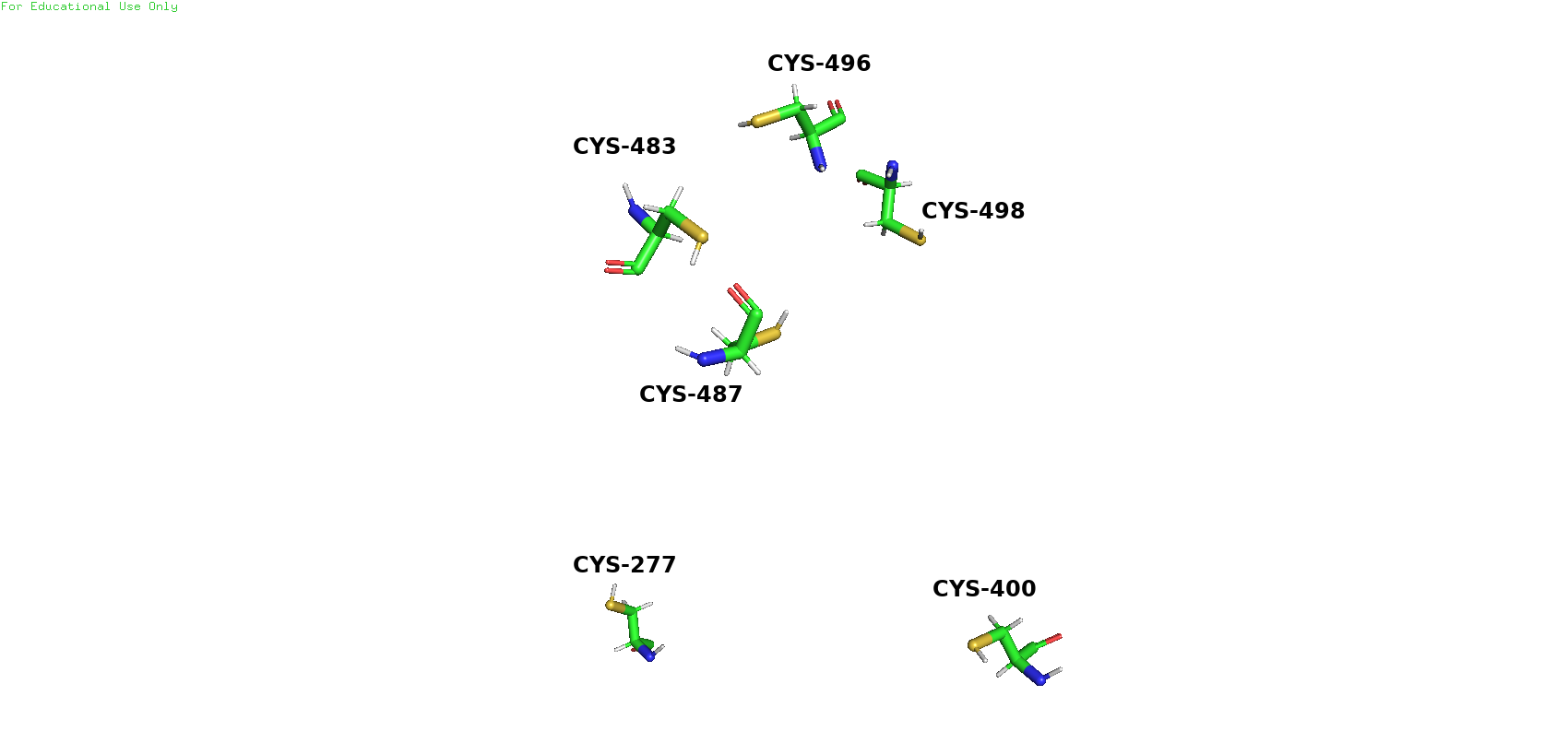
Активный центр
Данный белок — неспецифическая тирозиновая протеин-киназа. Имеет код EC: 2.7.10.2.
Фосфорилирует L-тирозин при помощи энергии АТФ.
Ниже представлено уравнение реакции:
ATP + L-tyrosyl-[protein] <=> ADP + H(+) + O-phospho-L-tyrosyl-[protein]
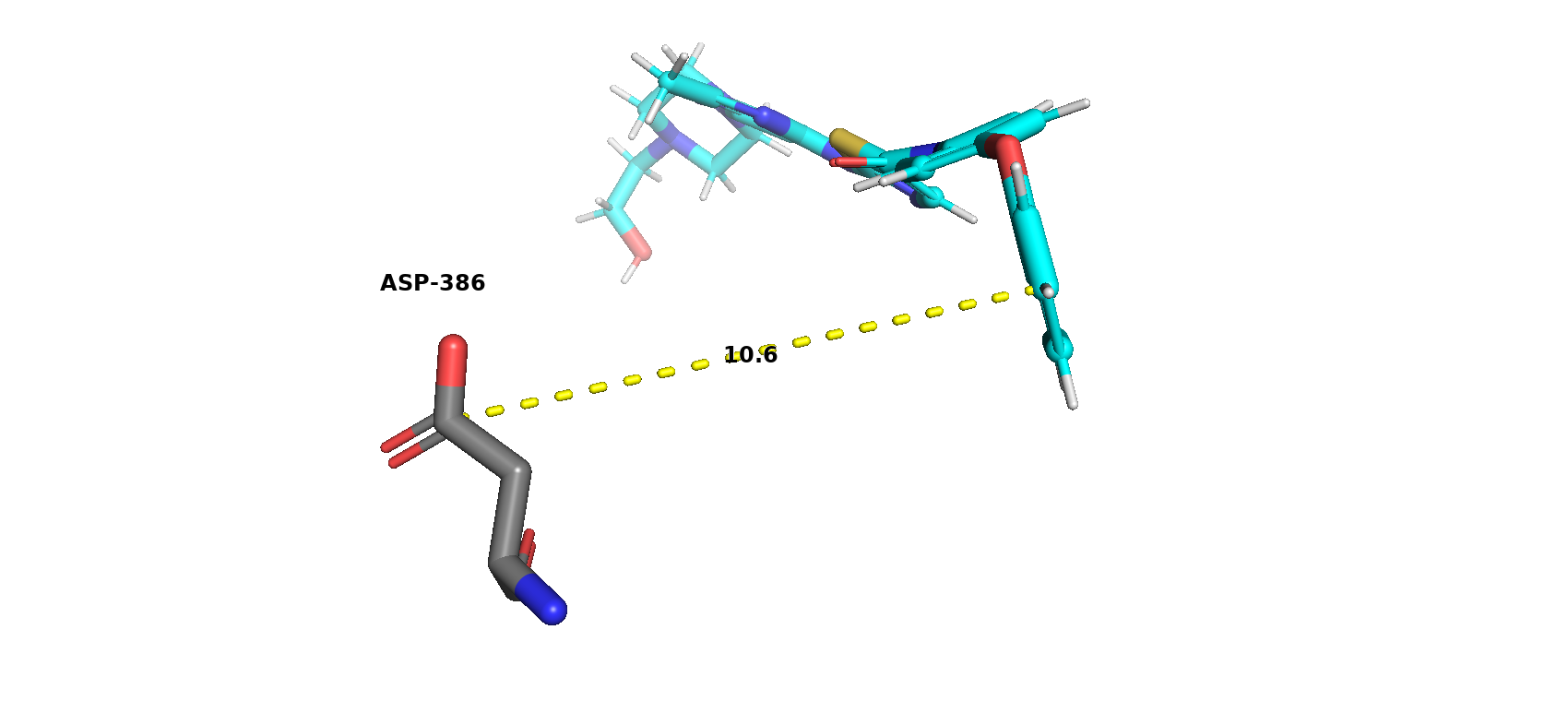
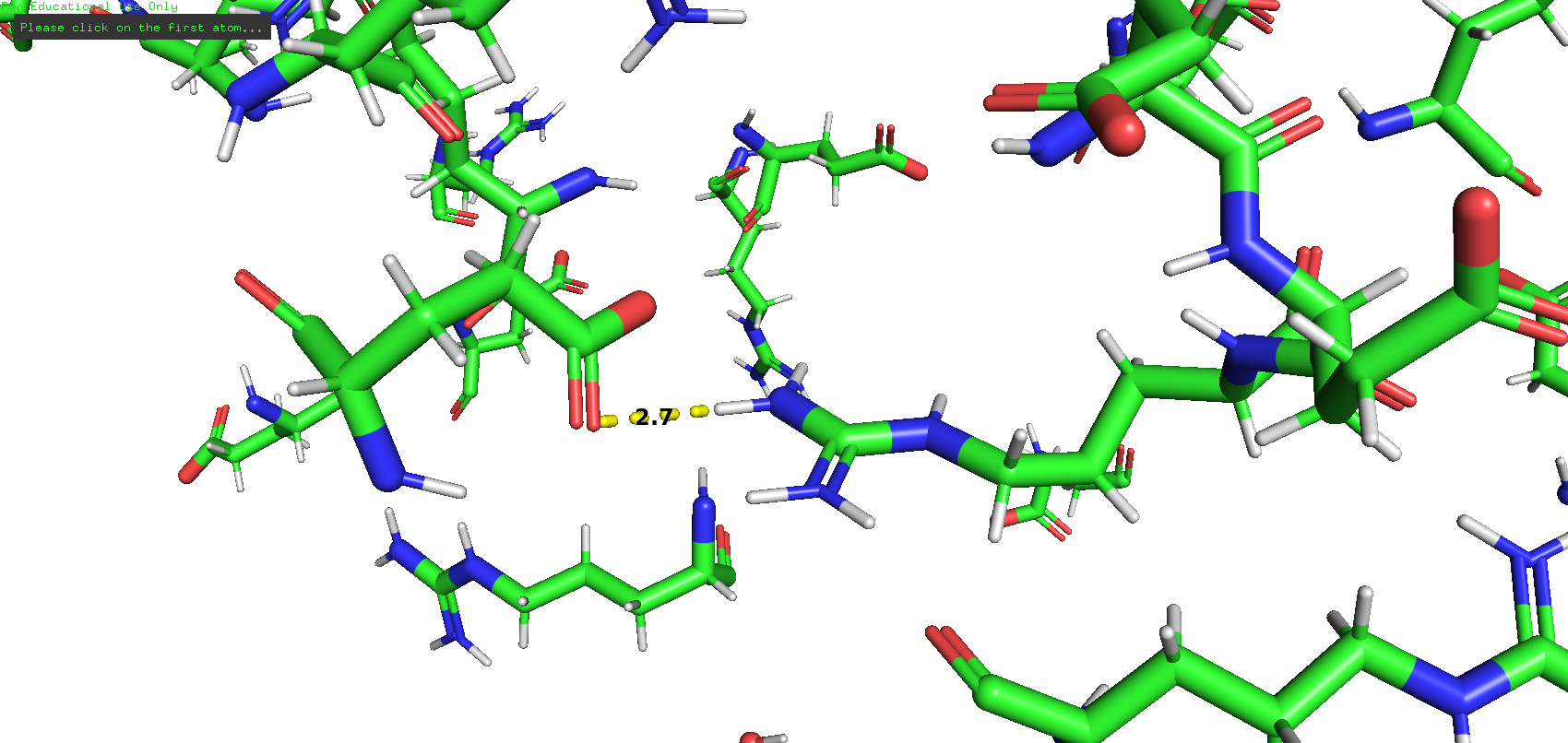
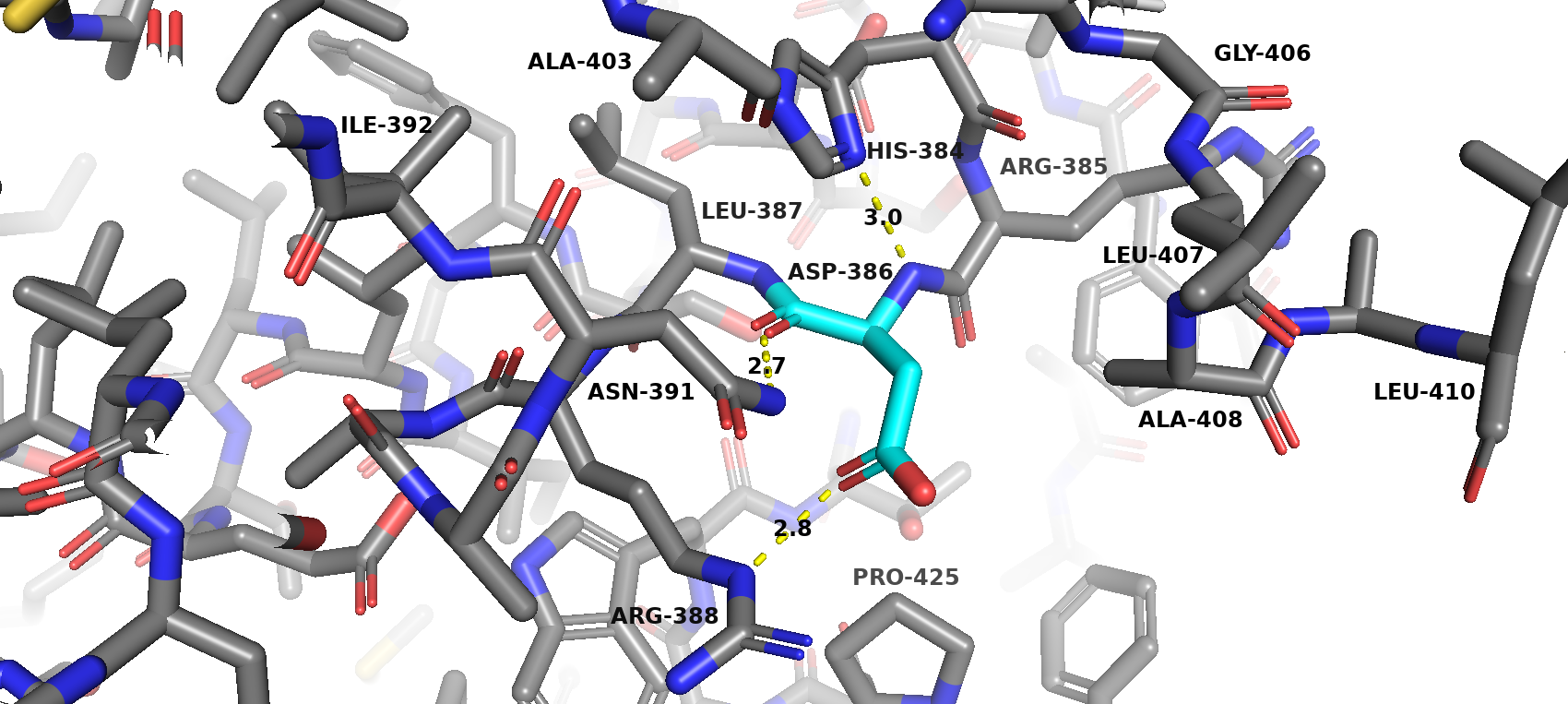
В состав каталитического центра входит единственная аминокислота ASP-386, а значит, взаимодействий между остатками каталитического центра нет.
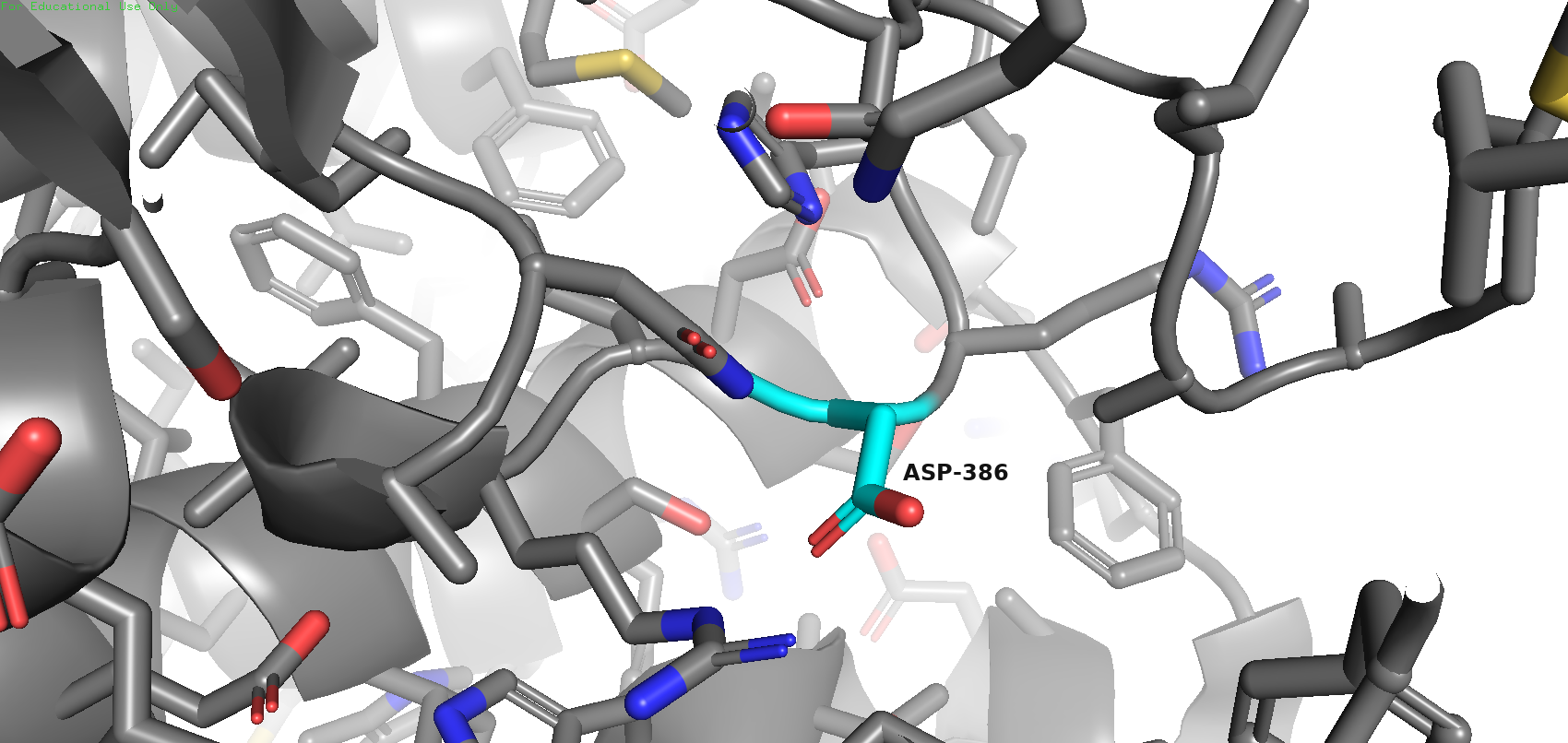
Остаток каталитического центра (аспарагиновая кислота) образует водородные связи с аминокислотами ASN-391 и ARG-388.
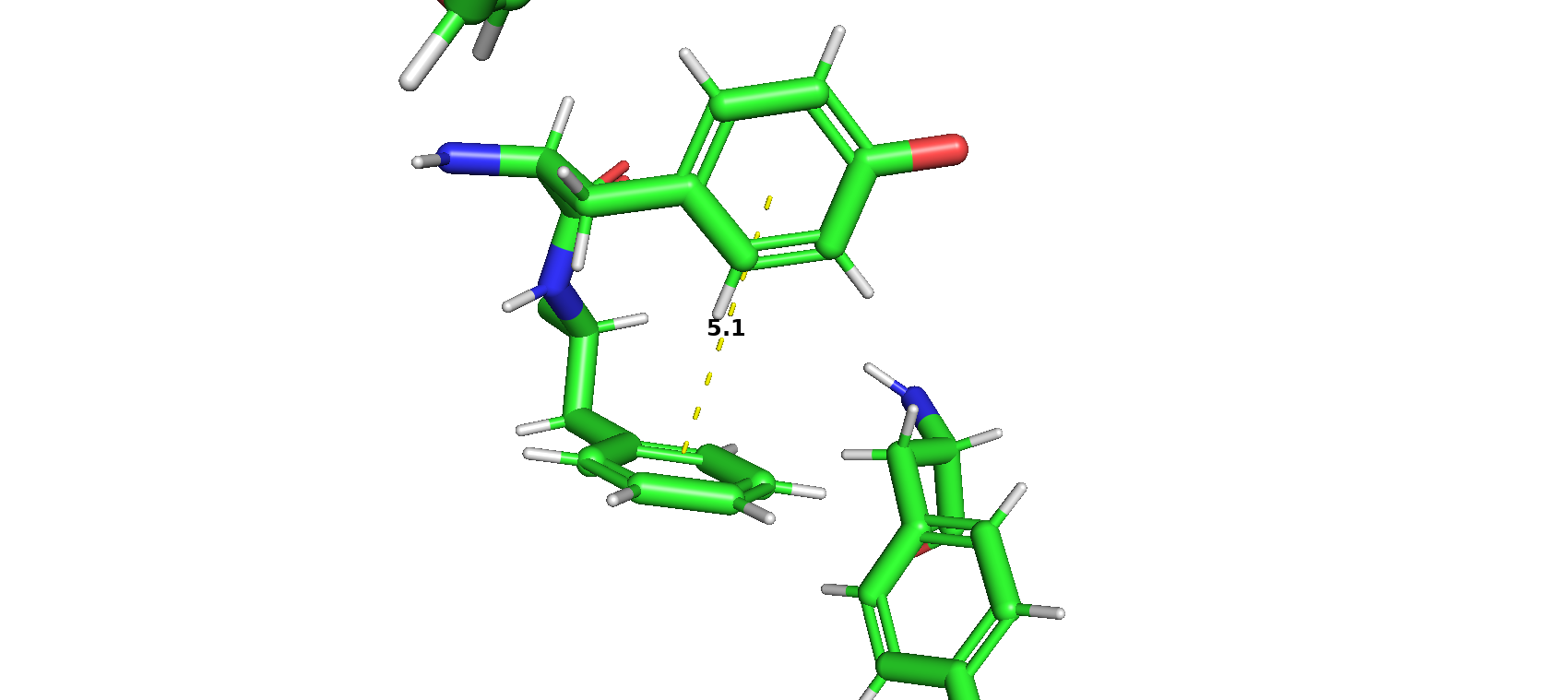
Молекула ингибитора взаимодействует с аминокислотами MET-341 и THR-338 c образованием водородных связей и с PHE-405 по типу Т-стекинга.
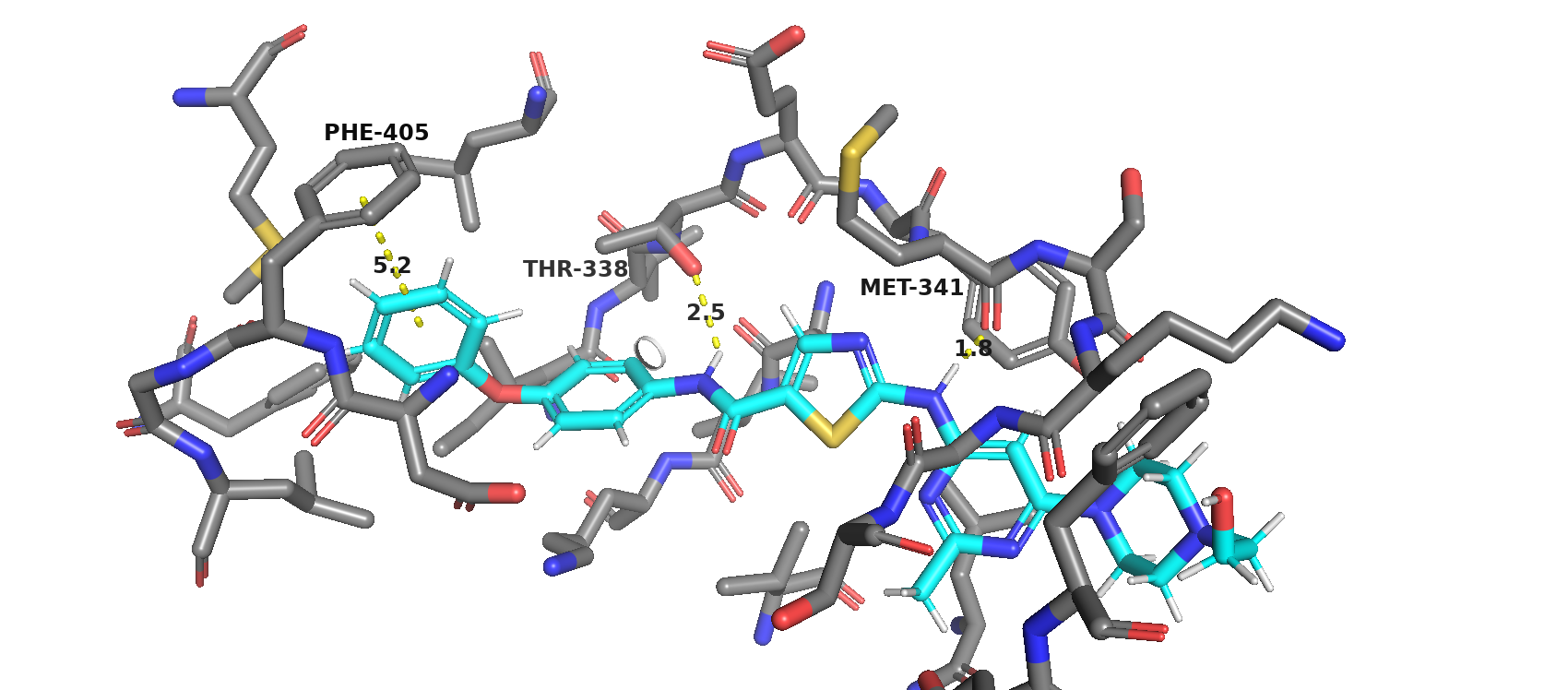
Расстояние между активным центром фермента и ингибитором приблизительно 10.6 ангстрем. Расстояние довольно велико, так что остановка каталитической активности достигается путём неконкурентного ингибирования.