Задание 1
Рассмотрим пример атомов с коэффициентом заполнения (Occupancy), не равным 1. Коэффициент заполнения отражает долю атомов, находящихся в определенной конформации. Часто так бывает, что остаток в белке принимает несколько конформаций, и это отражается в PDB файле. Рассмотрим бета-лактамазу TRU-1 из бактерии Aeromonas enteropelogenes с PDB ID 6fm6. В pdb файле мы видим следующие строки:
ATOM 181 CA AMET A 26 15.132 -15.108 18.830 0.50 4.97 C ATOM 182 CA BMET A 26 15.143 -15.119 18.890 0.25 6.59 C ATOM 183 CA CMET A 26 15.137 -15.129 18.849 0.25 4.70 C ATOM 184 C MET A 26 16.506 -14.545 18.540 1.00 3.43 C ANISOU 184 C MET A 26 451 352 497 51 12 -3 C ATOM 185 O MET A 26 17.517 -15.115 18.940 1.00 3.69 O ANISOU 185 O MET A 26 486 412 500 59 -10 59 O ATOM 186 CB AMET A 26 14.758 -14.809 20.291 0.50 5.13 C ATOM 187 CB BMET A 26 14.881 -14.961 20.399 0.25 6.96 C ATOM 188 CB CMET A 26 14.812 -14.952 20.325 0.25 4.70 C ATOM 189 CG AMET A 26 14.757 -13.313 20.612 0.50 5.29 C ATOM 190 CG BMET A 26 15.167 -13.583 21.003 0.25 7.15 C ATOM 191 CG CMET A 26 14.565 -13.520 20.724 0.25 4.74 C ATOM 192 SD AMET A 26 14.419 -12.865 22.322 0.50 5.60 S ATOM 193 SD BMET A 26 13.722 -12.514 21.046 0.25 7.68 S ATOM 194 SD CMET A 26 13.516 -13.464 22.174 0.25 4.82 S ATOM 195 CE AMET A 26 12.652 -13.121 22.394 0.50 5.84 C ATOM 196 CE BMET A 26 12.725 -13.420 22.226 0.25 7.71 C ATOM 197 CE CMET A 26 13.416 -11.699 22.410 0.25 4.87 CКоэффициент заполнения записан в 10 столбце, и видно, что в некоторых случаях он меньше 1. Значит, для остатка MET26 имеется 3 альтернативные конформации боковой цепи, в которых он находится с вероятностями 50%, 25% и 25%. Coответственно, в 4 столбце эти конформации отмечены как AMET, BMET и CMET. А вот как это выглядит в структуре (рис.1).
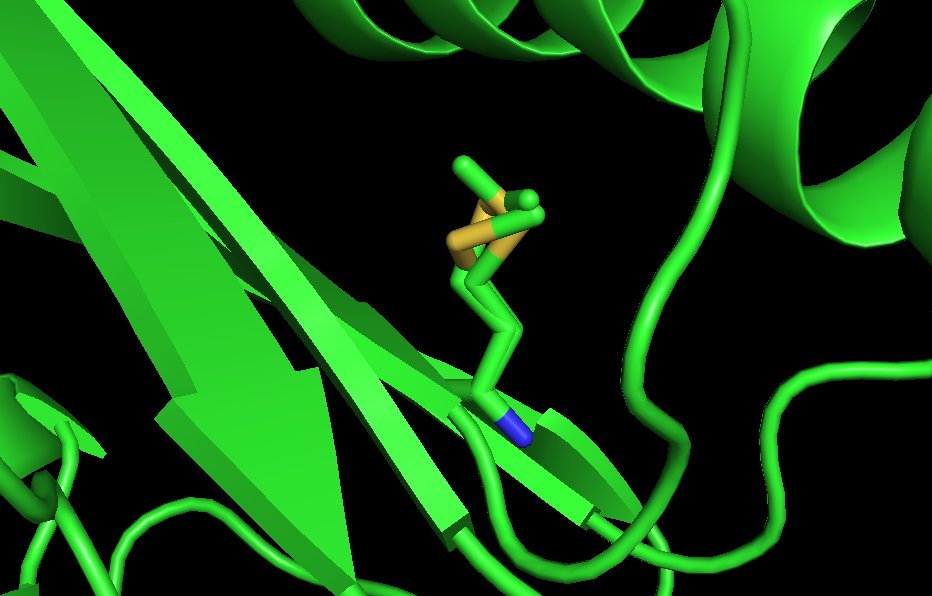
Рисунок 1. Альтернативные конформации метионина.
Задание 2
Теперь рассмотрим пример PDB структуры с отсутствующими остатками (missing residues). Такое бывает, в разных случаях, например при плохом разрешении. Иногда даже при хорошем разрешении определить положение остатка не удается, например, если он расположен на подвижном участке цепи (чаще всего, на конце). Рассмотрим структуру 2-гидроксибифенил-3-монооксигеназы с PDB ID 5brt. В pdb файле мы наблюдаем такую ситуацию:
REMARK 465 MISSING RESIDUES REMARK 465 THE FOLLOWING RESIDUES WERE NOT LOCATED IN THE REMARK 465 EXPERIMENT. (M=MODEL NUMBER; RES=RESIDUE NAME; C=CHAIN REMARK 465 IDENTIFIER; SSSEQ=SEQUENCE NUMBER; I=INSERTION CODE.) REMARK 465 REMARK 465 M RES C SSSEQI REMARK 465 MET A 1 REMARK 465 SER A 2 REMARK 465 ASN A 3 REMARK 465 SER A 4 REMARK 465 GLN A 195 REMARK 465 MET A 196 REMARK 465 GLY A 197 REMARK 465 ILE A 198 REMARK 465 GLY A 199 REMARK 465 ASP A 200 REMARK 465 SER A 201 REMARK 465 ARG A 219 REMARK 465 ARG A 228 REMARK 465 ALA A 229 REMARK 465 GLY A 230 REMARK 465 SER A 231 REMARK 465 GLY A 232 REMARK 465 ILE A 233 REMARK 465 ASN A 234 REMARK 465 GLY A 235 REMARK 465 VAL A 236 REMARK 465 TYR A 256 REMARK 465 GLU A 257 REMARK 465 LYS A 258 REMARK 465 SER A 259 REMARK 465 LYS A 260 REMARK 465 GLY A 261 REMARK 465 THR A 262 REMARK 465 PRO A 263 REMARK 465 GLU A 264 REMARK 465 ILE A 265 REMARK 465 ALA A 586Как можно заметить, здесь отсутствуют несколько участков цепи, как в начале и в конце, так и в середине (я выделила только относящиеся к цепи А). Посмотрим на их расположение в структуре (рис. 2).
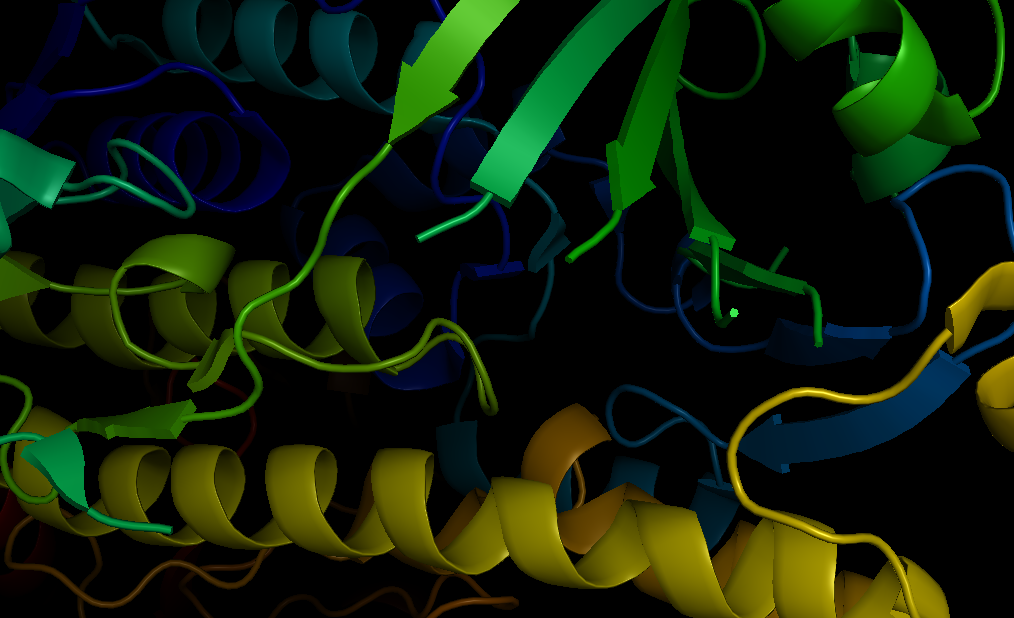
Рисунок 2. Пропуски в цепи.
Почти все пропуски располагаются в одном месте, что говорит о высокой подвижности в конкретном участке структуры.
Задание 3
C PDB структурой белка связаны три последовательности: (1) последовательность природного белка из Uniprot; (2) последовательность белка, который кристаллизовали — он может отличаться наличием тэгов, или же быть частью природного белка, например, доменом; (3) та часть последовательности (2), которая соответствует "видимой" методом РСА (то есть одинаково расположенной во всех ячейках кристалла) части белка. В некоторых случаях последовательности (1) и (2) могут отличаться. Рассмотрим пример такой структуры, мышиной бета-маннозидазы 6DDT.
DBREF 6DDT A 22 879 UNP Q8K2I4 MANBA_MOUSE 22 879 SEQADV 6DDT ASP A 12 UNP Q8K2I4 EXPRESSION TAG SEQADV 6DDT ARG A 13 UNP Q8K2I4 EXPRESSION TAG SEQADV 6DDT HIS A 14 UNP Q8K2I4 EXPRESSION TAG SEQADV 6DDT HIS A 15 UNP Q8K2I4 EXPRESSION TAG SEQADV 6DDT HIS A 16 UNP Q8K2I4 EXPRESSION TAG SEQADV 6DDT HIS A 17 UNP Q8K2I4 EXPRESSION TAG SEQADV 6DDT HIS A 18 UNP Q8K2I4 EXPRESSION TAG SEQADV 6DDT HIS A 19 UNP Q8K2I4 EXPRESSION TAG SEQADV 6DDT LYS A 20 UNP Q8K2I4 EXPRESSION TAGСтроки DBREF содержат информацию об аминокислотной последовательности природного белка из базы данных UniProt. В данном случае это последовательность Q8K2I4. Строки SEQADV содержат информацию об отличиях последовательности из данного pdb-файла от природной. В последнем столбце указана причина отличий. В данном случае в последовательность был введен тэг (гистидиновый) для облегчения выделения белка.
Задание 4
B-фактор (температурный фактор) характеризует размазанность электронной плотности атома относительно предсказанного положения его центра. Значения B-фактора меньше 10 Å2 говорят о "жестком" положении атома, когда значения порядка 50 Å2 - о его высокой подвижности. Рассмотрим максимальное и минимальное значения В-фактора для структуры 6fm6 из задания 1.
ATOM 1789 O ASN A 211 -1.033 -12.480 3.659 1.00 40.48 O ATOM 2616 C ASN A 311 8.810 2.052 19.315 1.00 2.98 CВ-фактор записан в предпоследней колонке. Как можно заметить, у разных атомов одной структуры он может различаться в 20 раз.*