5.Сравнение ЯМР- и РСА-структур одного белка
Среди списка структур определенных разными методами, я выбрал структуру белка Bcl-xL (номер кластора - 345). Среди приведенных структур для анализа я отобрал стркутуру полученную РСА (PDB ID: 4QVE, разрешение - 2.05 Å), и структуру полученную ЯМР (PDB ID: 2M04, число моделей - 20). На рис. 1 приведены обе структуры, выравненные для удобства.
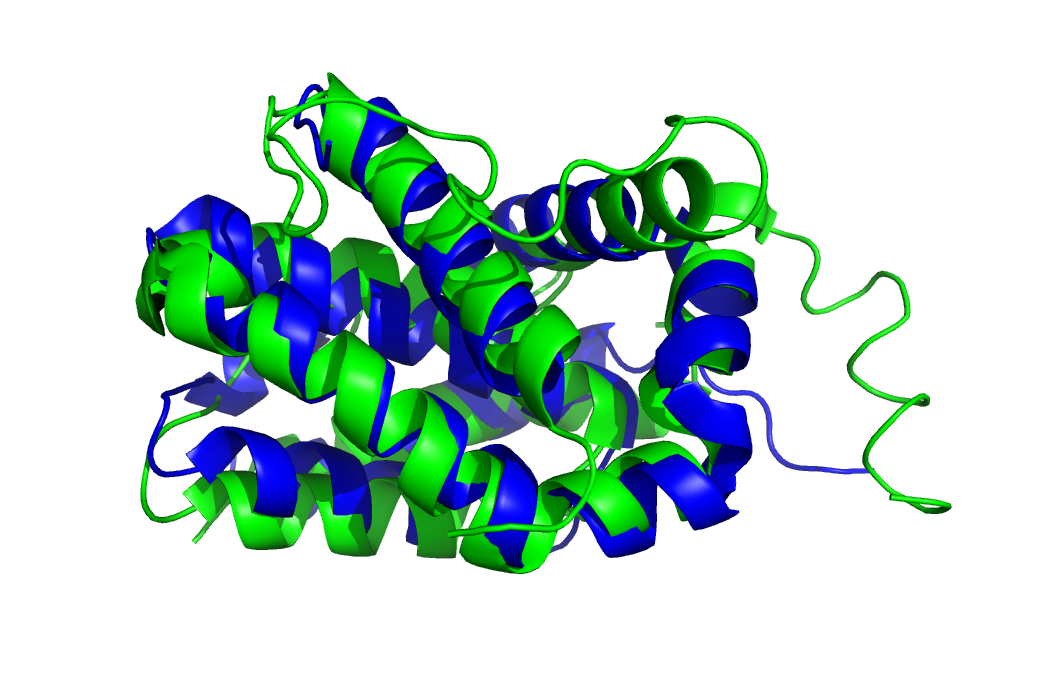
Рисунок 1. Структура Bcl-xL с BH3 доменом полученая ЯМР (PDB ID: 2M04) показанна зеленым, а аналогичная структура, но полученная РСА (PDB ID: 4QVE) показанна синим.
Стоит отметить, что обе структуры полученны в комплексе с BH3 доменом, которые, возможно, могут слегка отличаться. Однако я выбрал именно эти структуры, т.к. "нативные" не совпадают от слова совсем - это связанно с тем, что нативный Bcl-xL в кристале образует гексомер, которого, по понятным причинам, не образуется в растовре белка.
| Талица 1. Сравнение водородных связей в структурах белка, расшифрованных методами РСА и ЯМР | |||||||
| № | Остатки | Описание | Длинна связи (РСА, Å) | Число моделей со связью (ЯМР) | Min длина связи, Å (ЯМР) | Max длина связи, Å (ЯМР) | Медиана длинны связи, Å (ЯМР) |
| 1 | Glu179-Gln183 | Альфа-спираль | 2.9 | 13(65%) | 2.1 | 2.5 | 2.4 |
| 2 | Asn5-Trp188 | Внутри ядра | 3.1 | 0 (0%) | - | - | - |
| 3 | Asn128-Tyr173 | На поверхности | 3.4 | 0 (0%) | - | - | - |
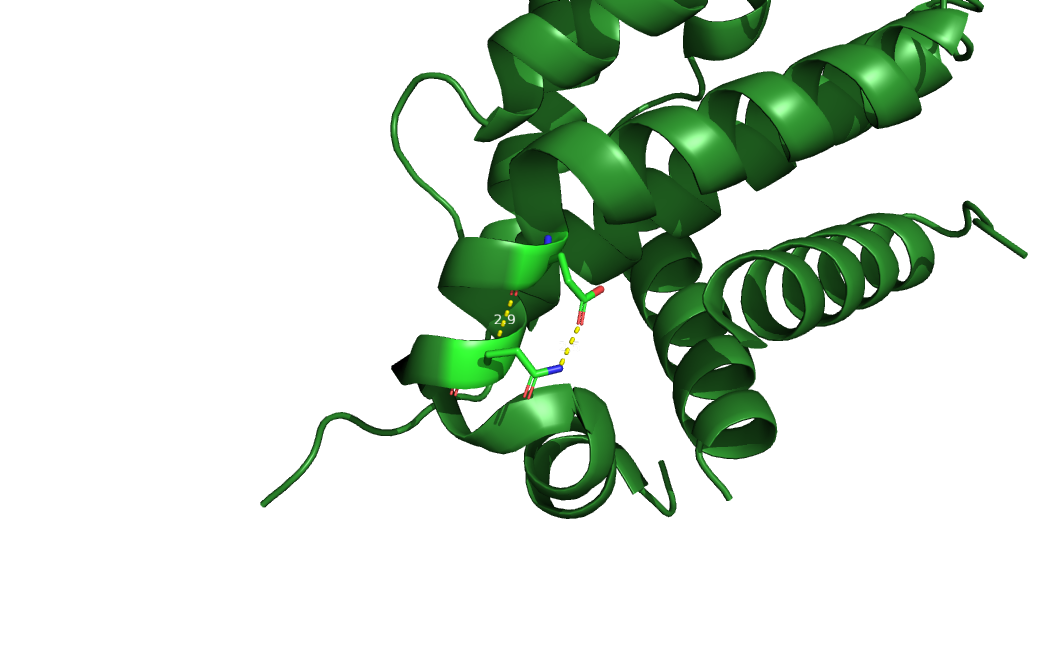
Рисунок 2. Водородная связь №1, показанна РСА структура.
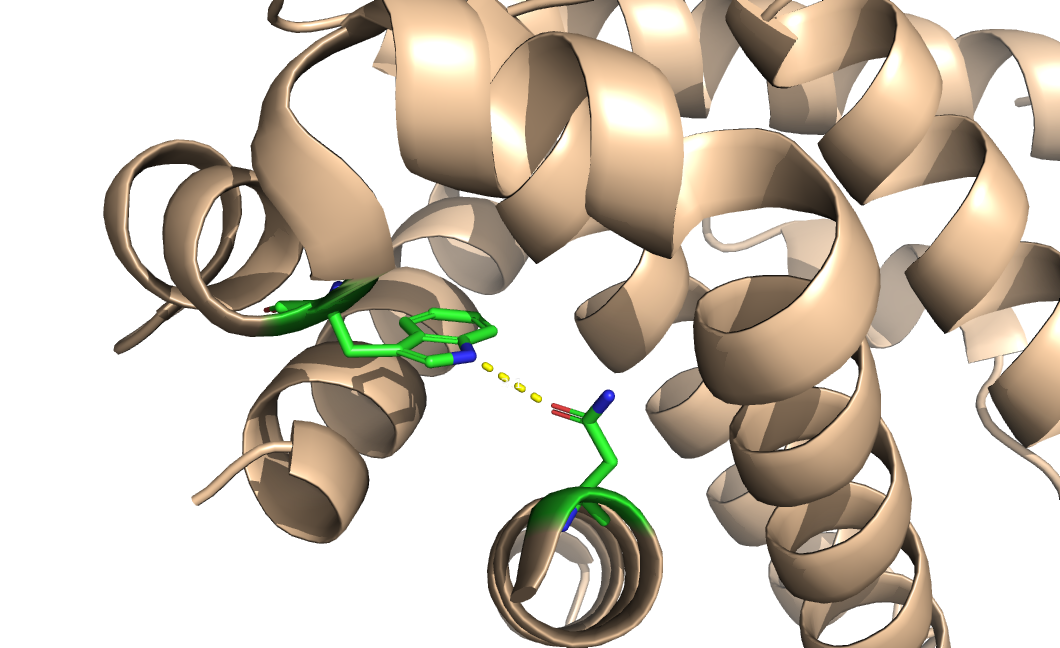
Рисунок 3. Водородная связь №2, показанна РСА структура.
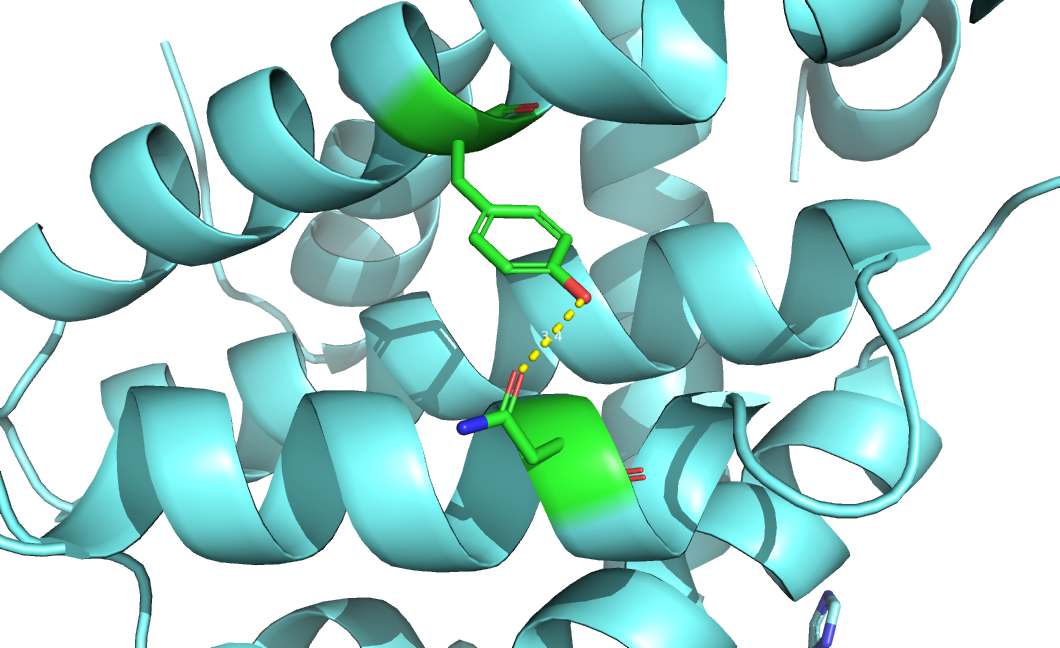
Рисунок 4. Водородная связь №3, показанна РСА структура.
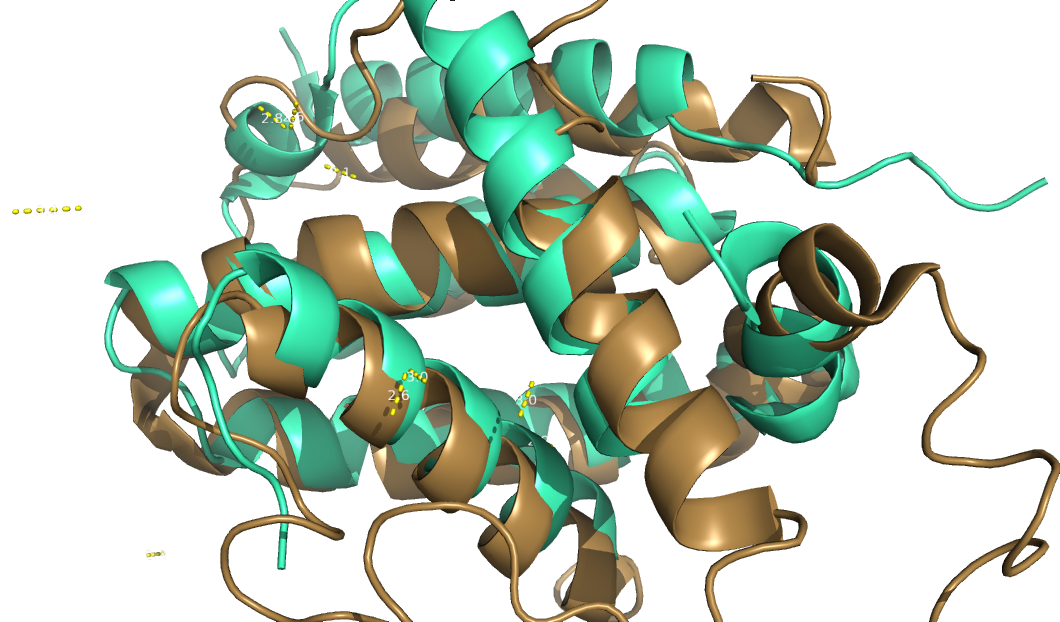
Рисунок 5. Демонстрация того, что структура ЯМР менее склонна сближаться из-за возможности сальватации.
В попытках обнаружить "общие" водородные связи я обнаружил, что множество связей у РСА и ЯМР очень слабо пересекается - видимо, дело в лучшей структурированности астомов в крисатале (РСА), а так же наличие воды (тяжелой воды) в растворе белка (ЯМР), которая хоть и хуже образует водородные связи чем "обычная", однако все же дает возможность цепям "разбежаться", что может существенно сказываться на внутренней энергии, вследствии энтропийного эффекта.
| на главную |
© Гавриш Глеб 2017 |