Триптофан
Введение: Триптофан относится к незаменимым для человека и животных аминокислотам, поскольку является предшественником ряда важных биологически активных веществ, в частности серотонина и рибонуклеотида никотиновой кислоты. Серотонин в организме подвергается окислительному дезаминированию с образованием индолилук-сусной кислоты, которая выделяется с мочой. Содержание этой кислоты в моче повышено при поражениях кишечника злокачественными карци-ноидами, когда около 60 % триптофана окисляется по серотониновому пути. Содержание триптофана в организмах невелико. Но потребность в триптофане значительно меньше, чем в лизине и глутаминовой кислоте. Триптофан в небольших количествах используется в животноводстве, медицине и при различных биохимических исследованиях. Вместе с тем это очень важная аминокислота, она входит в белки и участвует в многочисленных превращениях соединений, имеющих циклическую структуру. Отсутствие этой аминокислоты или нарушение процессов синтеза ее ведет к тяжелым заболеваниям организма.
Обнаружен впервые в 1901 г. Гопкинсом и Колом в казеине.
Трехбуквенные и однобуквенные коды: Trp, W
Химическая формула: 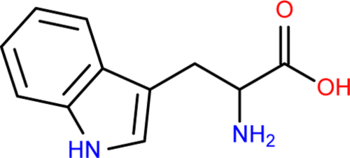
Физико-химические свойства
Систематическое наименование: 2-амино-3-(1H-индол-3-ил)пропионовая кислота
Брутто формула: C11H12N2O2
Молекулярная масса: 204
Номер в PubChem: 6305
pKa с изображениями всех соответствующих (де)протонированных форм и именами тяжелых атомов
| pKa = 7.38 (at 25 °C) | |
| pK1 = 2.38 /SRC: carboxylic acid/; | |
| pK2 = 9.39 /SRC: primary amine/ |
Биохимические и другие особенности
Триптофан имеет самую объемную боковую цепь. Его небольшая полярность обусловлена наличием гетероциклического индоль-ного цикла. Довольно подвижная боковая цепь метионина содержит один атом серы в тиоэфирной группе, что приводит к появлению дипольного момента. Все самые крупные неполярные остатки: Val, He, Leu, Phe, Pro, Тгр и в меньшей степени Met - располагаются преимущественно внутри белковых молекул.Катаболические превращения L-триптофана в организме человека:
Катаболизм триптофана в организмах: Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат Кинуренин→антранилат→3-гидроксиантранилат 3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3- гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
Нехватка триптофана может приводить к различным заболеваниям, таким как: Семейная гипертриптофанемия, Болезнь Хартнапа и другие.
Интересные факты
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте.
Также триптофан обладает наиболее сильной флуоресценцией среди всех 20 протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Взаимодействия
Если скрипт работает плохо, то вот ссылка на его текст.
Страница находится в стадии разработки © Гавриш Глеб, Чистяков Василий 2016 |