
 |  |
Clp протеаза, имеет активную централизованную каталитическую триаду. В E. coli Clp protease - это ser-111, his-136 и asp-185. CLPPL_CYAPA потерял все эти остатки и, следовательно, неактивен. CLPP_CHLEU содержит две вставки, а CLPP_CHLRE - одну вставку.
Ферменты Proteolytic, которые используют serine для своей каталитической активности, обнаружены в вирусах, бактериях и эукариотах ( PUBMED:7845208). Эти энзимы обладают большим разнообразием пептидазной деятельность, включая exopeptidase, endopeptidase, oligopeptidase и омега-peptidase деятельности. Идентифицировано свыше 20 семейств серин протеаз (обозначаемые S1 - S27), они сгруппированные в 6 кланов (SA, SB, SC, SE, SF и SG) на основе структурного и функционального сходств (PUBMED:7845208). Структуры известные для четырех кланов (SA, SB, SC и SE): белки этих кланов сильно отличаются, следовательно, они предполагают, по крайней мере, четыре различные отправные точки для серин пептидаз (PUBMED:7845208).
Несмотря на различное происхождение, существуют сходства в механизмах реакции нескольких петидаз. Chymotrypsin, subtilisin и carboxypeptidase имеют каталитическую триаду serine, aspartate и histidine. Геометрические ориентации каталитических остатков - аналогичные между семьями, несмотря на то, что они образовывались из различных белков (PUBMED:7845208). Линейная организация каталитических остатков обычно отражает деление на кланы. Например, каталитическая триада в клане chymotrypsin (SA) - это HDS, DHS - в клане subtilisin (SB), SDH - в carboxypeptidase клане (SC) (PUBMED:7845208, PUBMED:8439290).
Протеазы очень похожие на ClpP обнаружены в геноме бактерий, животных, некоторых вирусов и в хлоропластовых заводах. Множество белков в этой семье классифицированы как non-peptidase гомологи или lack amino acid residues.
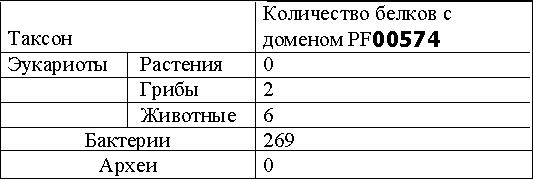 |
Краткаие сведения о домене CLP_protease:
|
© Бабаян Тигран, 2005