Восстановление кристалла из PDB файла
1. Описание взаимодействий в структуре белка 5T30 с белками из соседних ячеек.
Содержание поля CRYST1 выбранного фермента 5T30:
CRYST1 77.900 77.900 238.442 90.00 90.00 120.00 P 61 2 2 24Первая тройка чисел - нормы направляющих векторов в ангстремах, определяющих базис относительных координат элементарной ячейки (в данном случае два направляющих вектора по модулю равны). Вторая тройка чисел - углы между ними в градусах. P 61 2 2 - обозначение типа симметрии кристалла согласно. P - примитивная группа центровки. Обычные поворотные оси n-го порядка обозначаются арабской цифрой n (для данного белка 2). Винтовые оси обозначаются цифрой соответствующей поворотной оси с индексом, характеризующим величину переноса вдоль оси при одновременном повороте, т.о. 61 [61] - поворот на 60° и сдвиг на 1/6 трансляции соответственно. 24 - число белковых глобул в элементарной ячейке.
Рисунок 1. Изображение части кристалла - содержимого ячейки (ярко-оранжевым цветом) из PDB-файла и ряда соседних ячеек. Элементарная ячейка выделена оранжевой границей, асимметрические единицы покрашены в разные цвета.
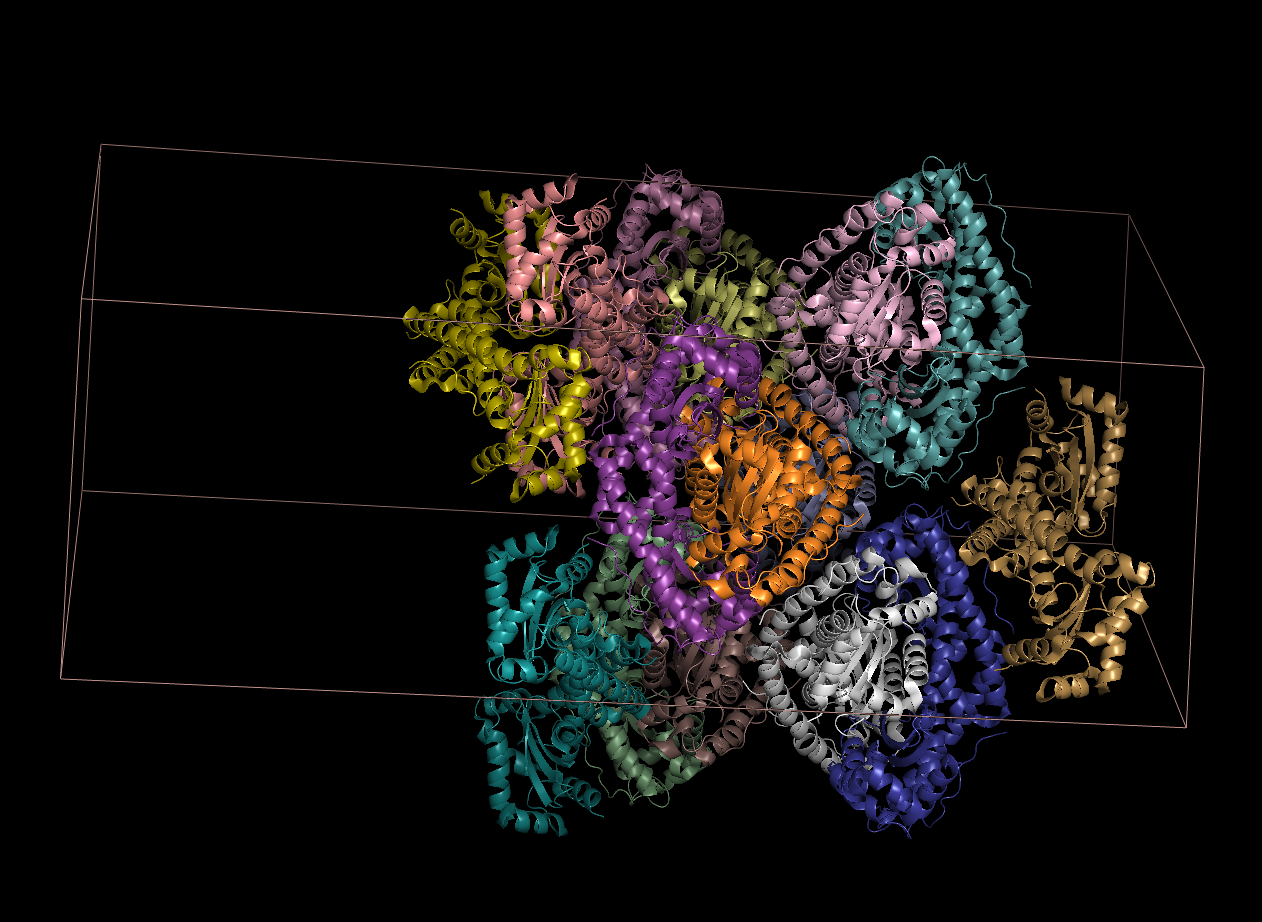
На расстоянии не более 12 ангстрем от выбранной молекулы в общей структуре были отображены соответствующие образы симметрии, суммарно их было найдено 15 штук. На рис. 1 представлены некоторые из соседей для лучшей визуализации.
Рисунок 2. Часть кристалла со всеми образами симметрии на расстоянии до 12 Å.
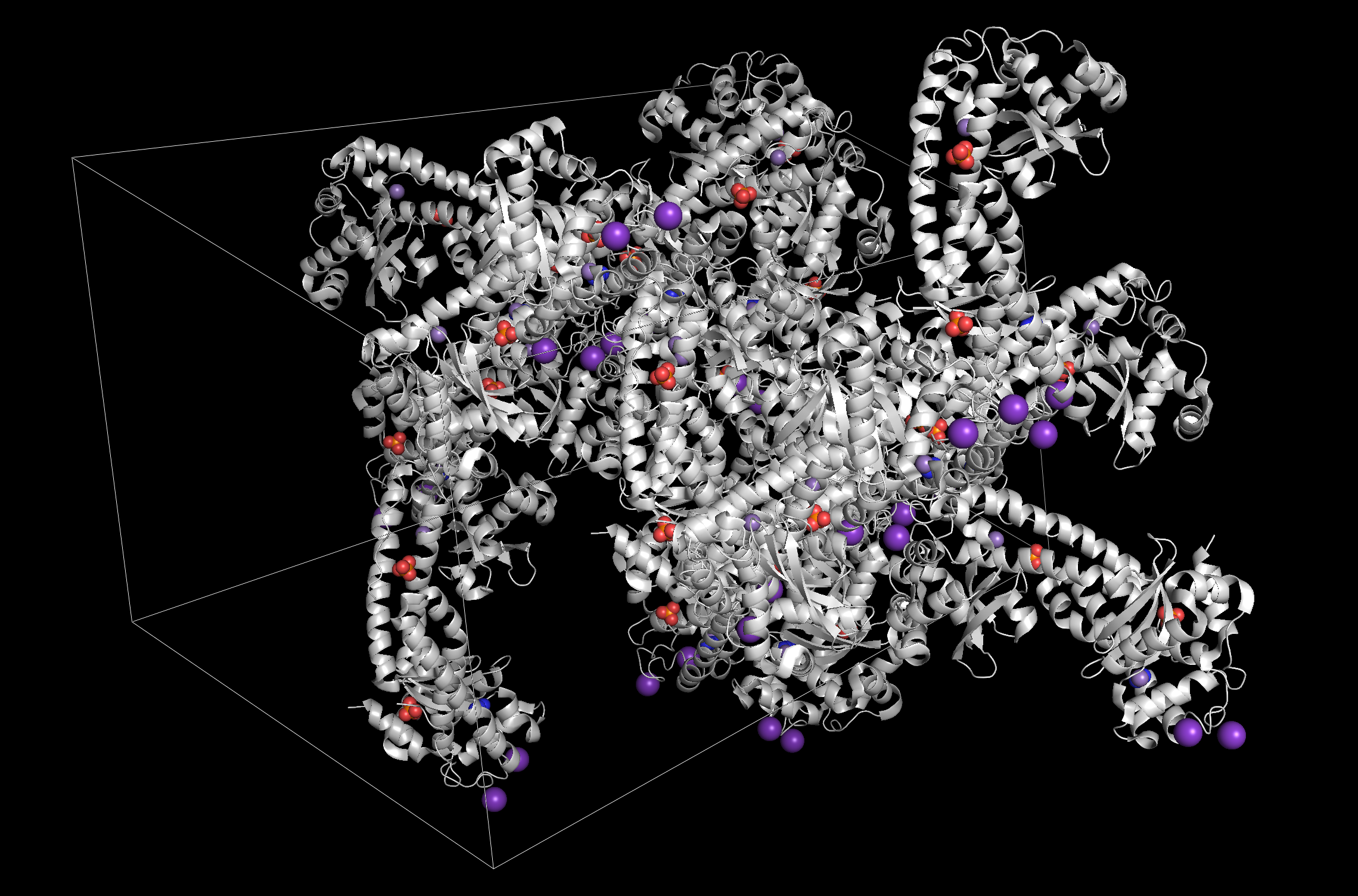
MnSOD - митохондриальная супероксиддисмутаза, в клетке имеет биологическую активность в форме гомотетрамера, связывая один ион марганца в каждой субъединице. Поэтому далее интересно было посмотреть на разные зоны контакта между белками. Поскольку гидрофобные контакты образуются на расстоянии до 4 ангстрем между остатками A, V, L, I, F, M, P и W, а водородные связи - на расстоянии 3.5, то в качестве порогового значения я выбрала 3.5 Å.
Рисунок 3.
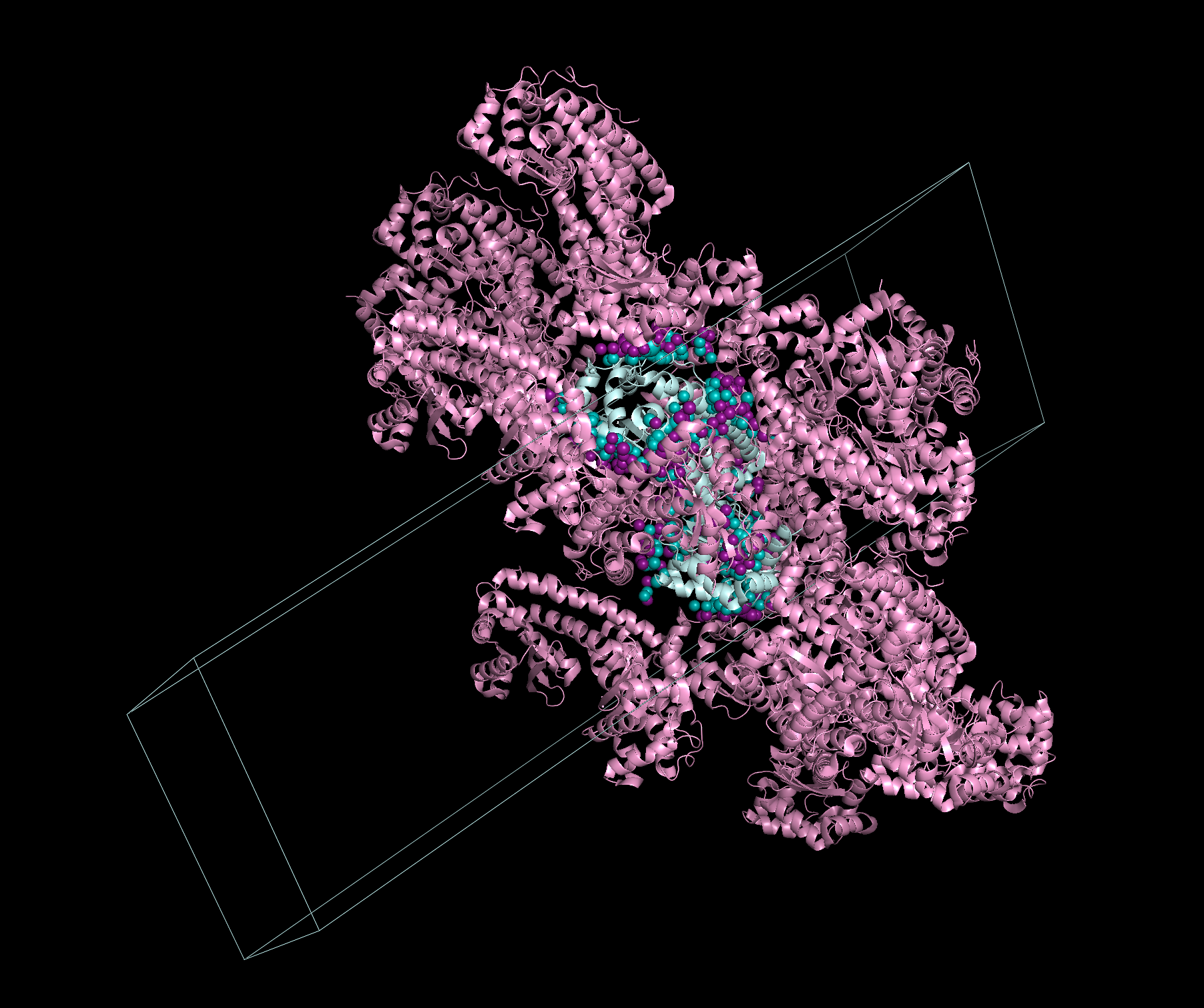
Рисунок 4.
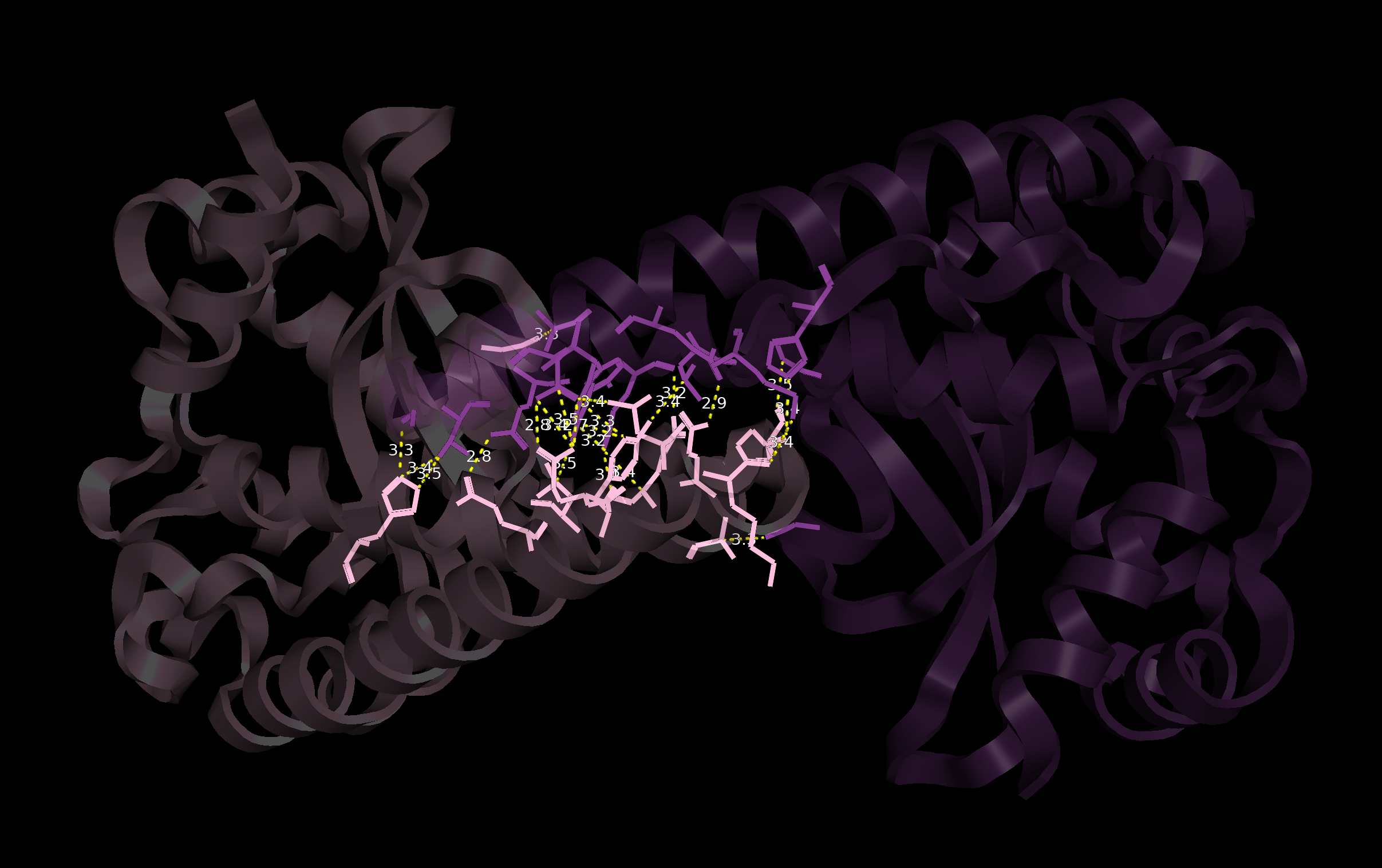
Рисунок 5.

Рисунок 6.

Так, на рис. 3 показан салатовым цветом показана основная глобула c "пограничными" темно-салатовыми атомами, а розовым - остальные асимметрические единицы (их атомы покрашены в пурпурный). Рис. 4 представляет водородные связи между разными цепями белка в одной ячейке (их достаточно много), а рис. 5,6 - взаимодействия между цепью A из основной глобулы и цепью B белка, находящегося в соседней ячейке. В последнем случае Н-связей гораздо меньше, и это может говорить о том, что выявленные между ячейками связи, вероятно, являются артефактами кристаллизации.
2. Расположение белковых цепей в структуре ДНК-белкового комплекса.
В этом задании нужно было объяснить странное расположение белковых цепей в структуре ДНК-белкового
комплекса 3HDD. При первичном рассмотрении структуры (рис. 7) кажется, что белковые цепи комплекса с ДНК
расположены странно - одна из цепей (В) будто бы свисает с ДНК и практически с ней не взаимодействует. Однако при
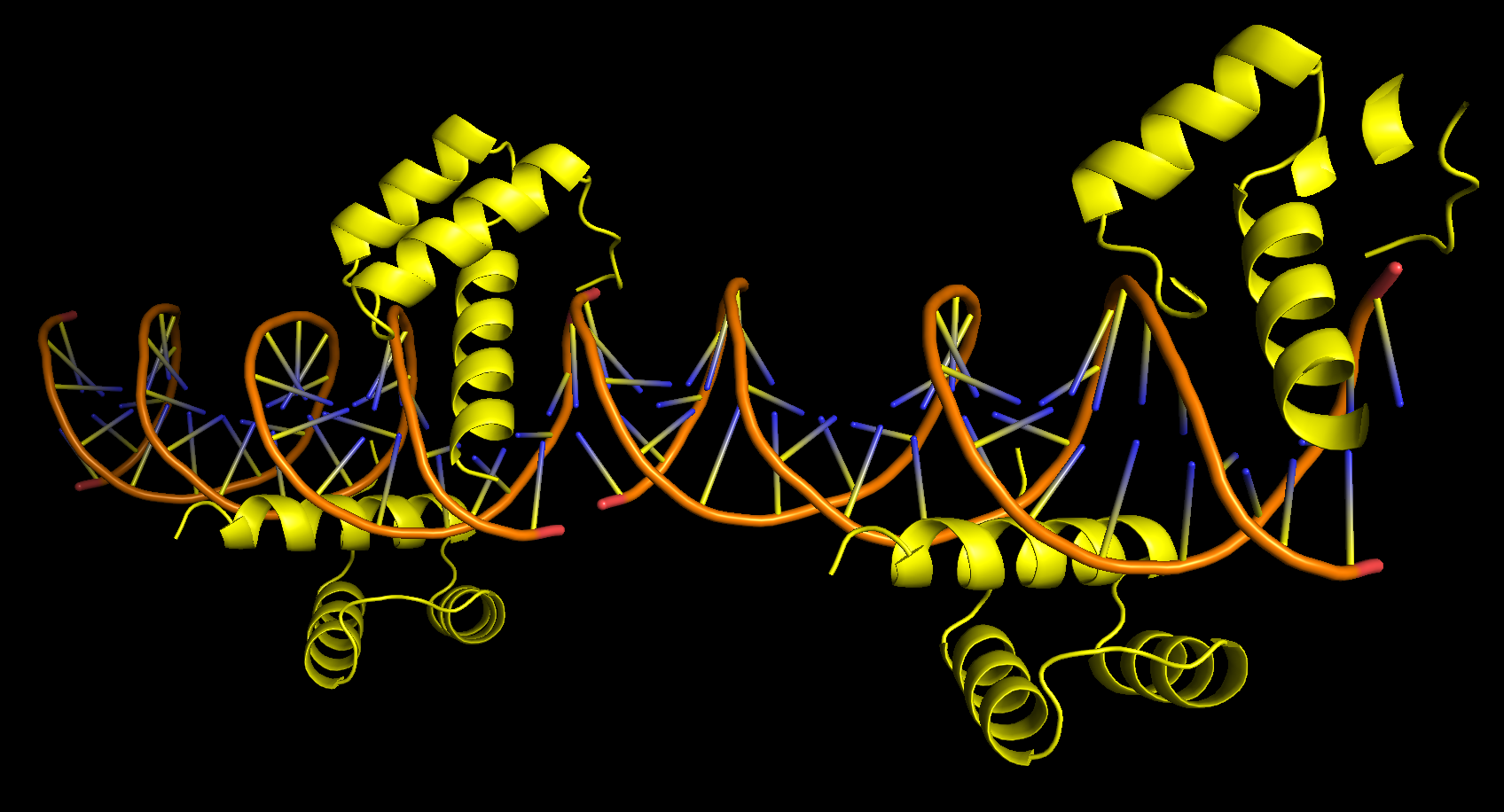
восттановлении соседней ячейки видно (рис. 8), что на самом деле она контактирует с молекулой ДНК сразу в 2 соседних
ячейках. Таким образом, кажущееся сначала "нестандартное" расположение цепи В относительно ДНК объясняется тем, что
изначально цепь В попала на границу асимметрической ячейки.
Рисунок 7.
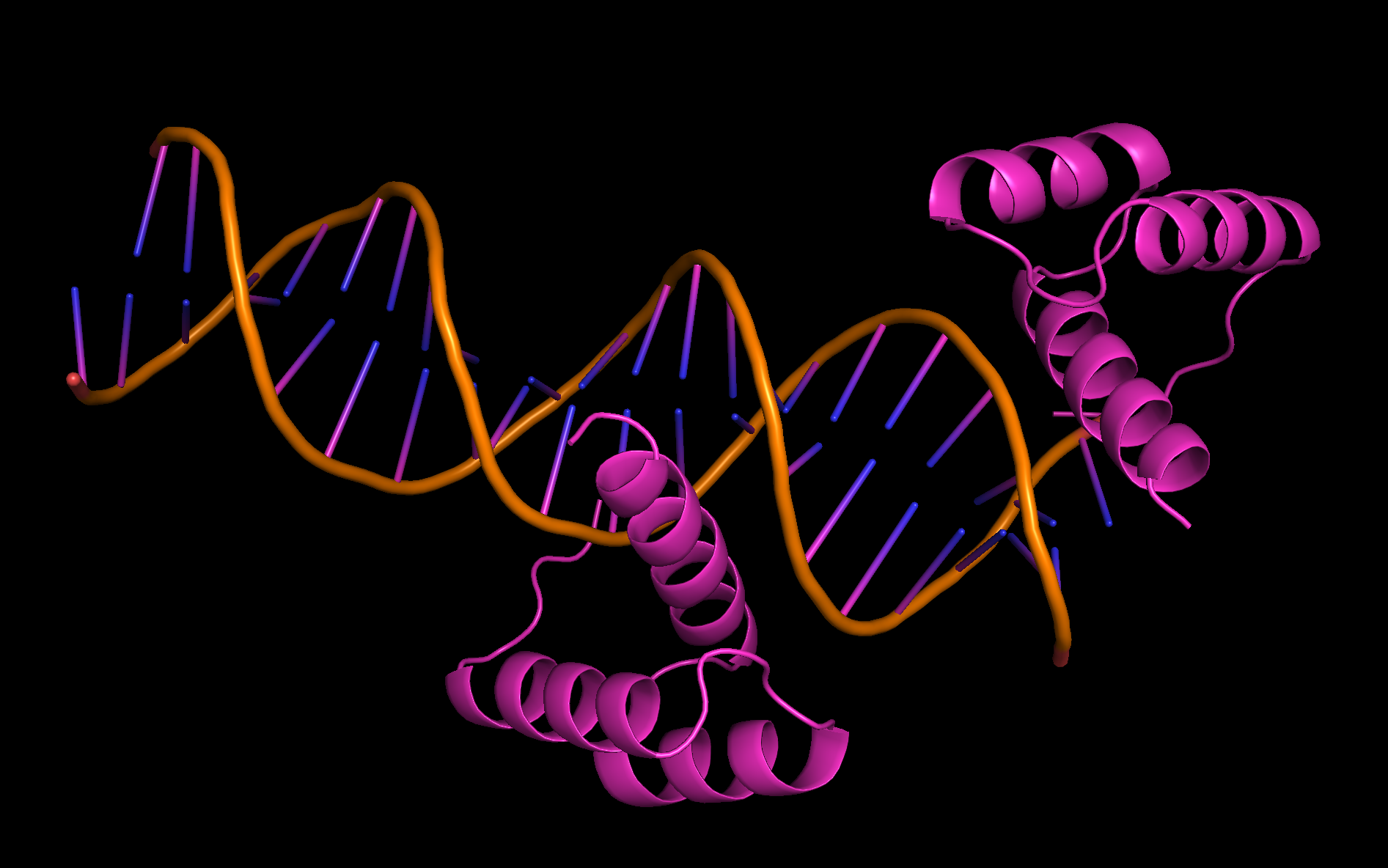
Рисунок 8.
3. Примеры PDB файлов, асимметрическая единица которых не совпадает с биологической единицей.
Чаще всего функциональная биологическая и асимметрическая (минимальная часть кристалла из которой
можно восстановить всю структуру) единицы совпадают, однако существуют примеры структур, у которых
данные единицы различны.
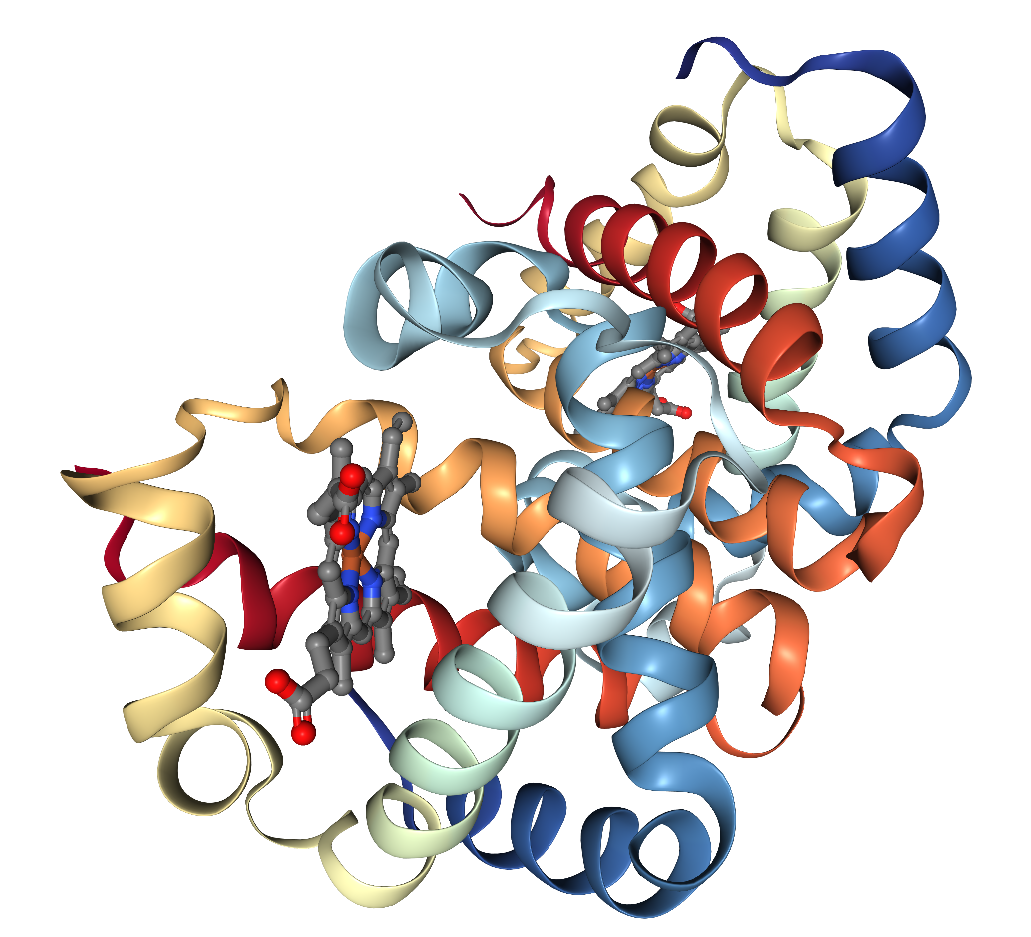
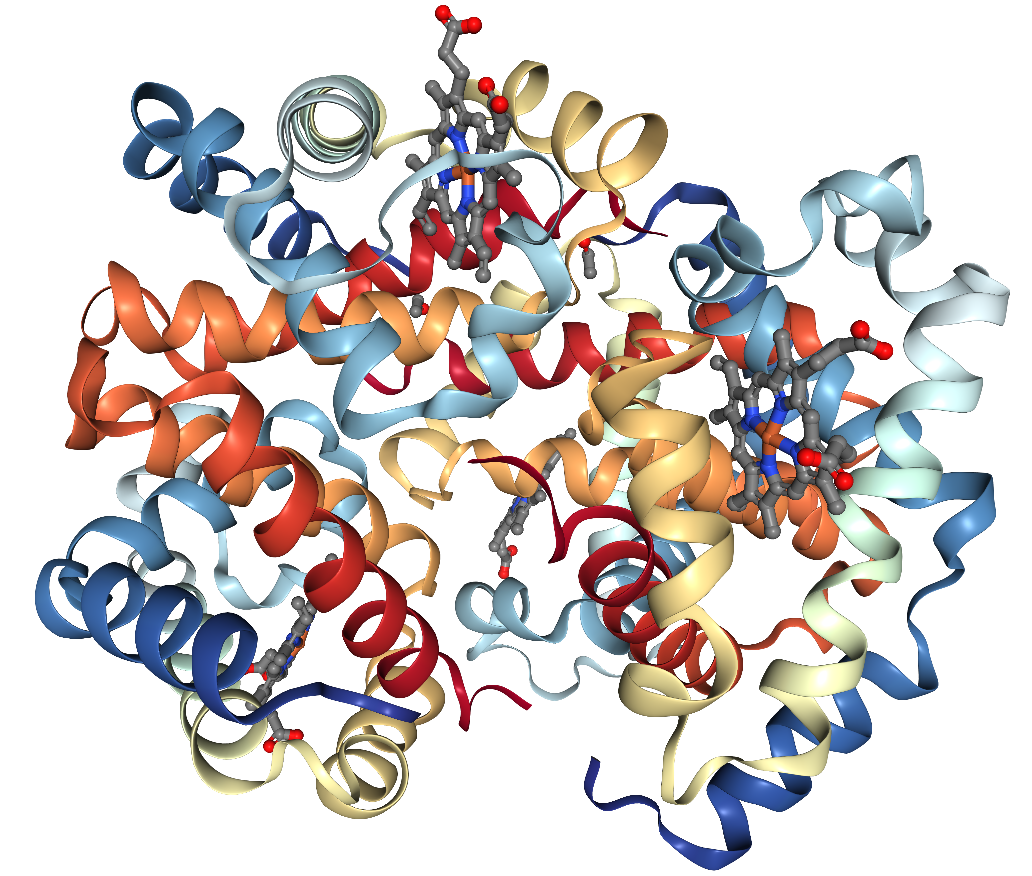
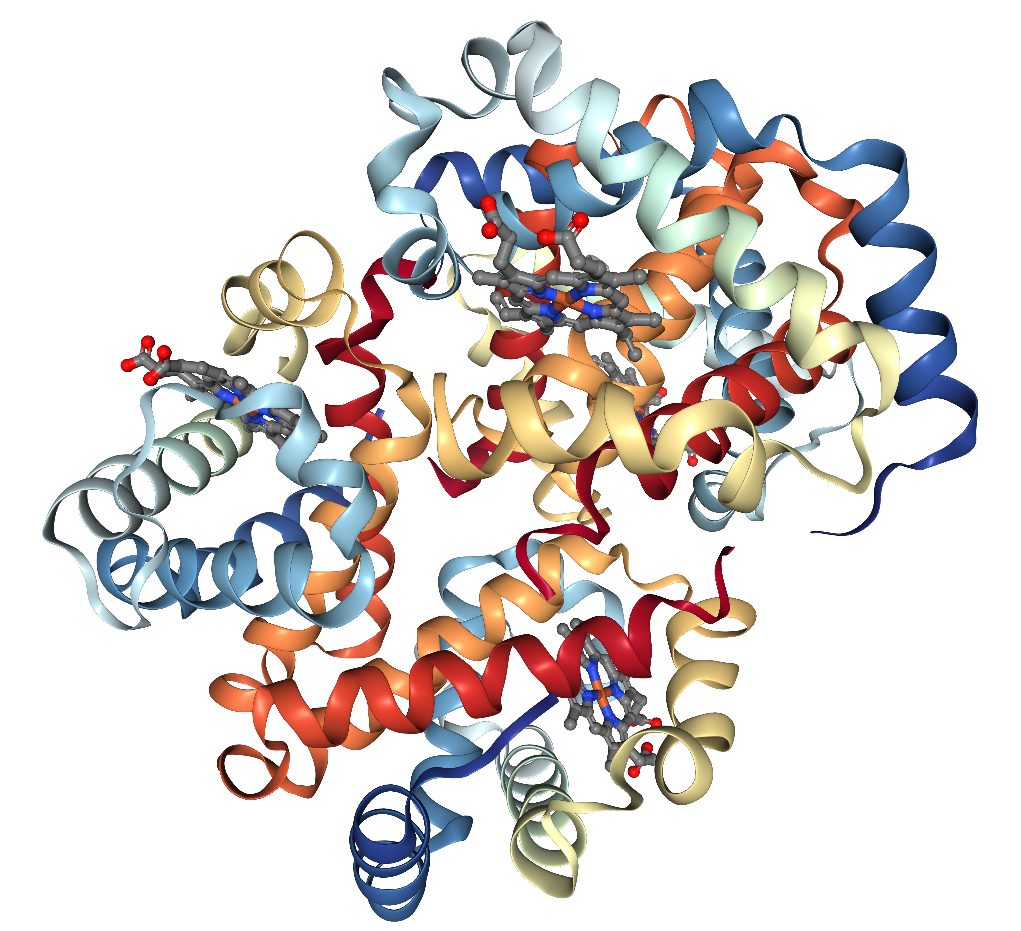
Так, в гемоглобине форели 1OUT асимметрическая ячейка содержит 2 цепи (рис. 9), в то время как биологическая единца включает 2 асимметрические, то есть, 4 цепи гемоглобина (рис. 10).
Иная ситуация в случае с гемоглобином горного гуся 1HV4. Асимметрическая ячейка здесь содержит 2 молекулы (похожие по структуре, но не полностью идентичные), что составляет суммарно 8 цепей, однако биологическая единица - половина асимметрической ячейки (4 цепи), что можно видеть на рис. 11 и 12 соответственно.
Рисунок 9.

Рисунок 10.

Так, в гемоглобине форели 1OUT асимметрическая ячейка содержит 2 цепи (рис. 9), в то время как биологическая единца включает 2 асимметрические, то есть, 4 цепи гемоглобина (рис. 10).
Иная ситуация в случае с гемоглобином горного гуся 1HV4. Асимметрическая ячейка здесь содержит 2 молекулы (похожие по структуре, но не полностью идентичные), что составляет суммарно 8 цепей, однако биологическая единица - половина асимметрической ячейки (4 цепи), что можно видеть на рис. 11 и 12 соответственно.
Рисунок 11.
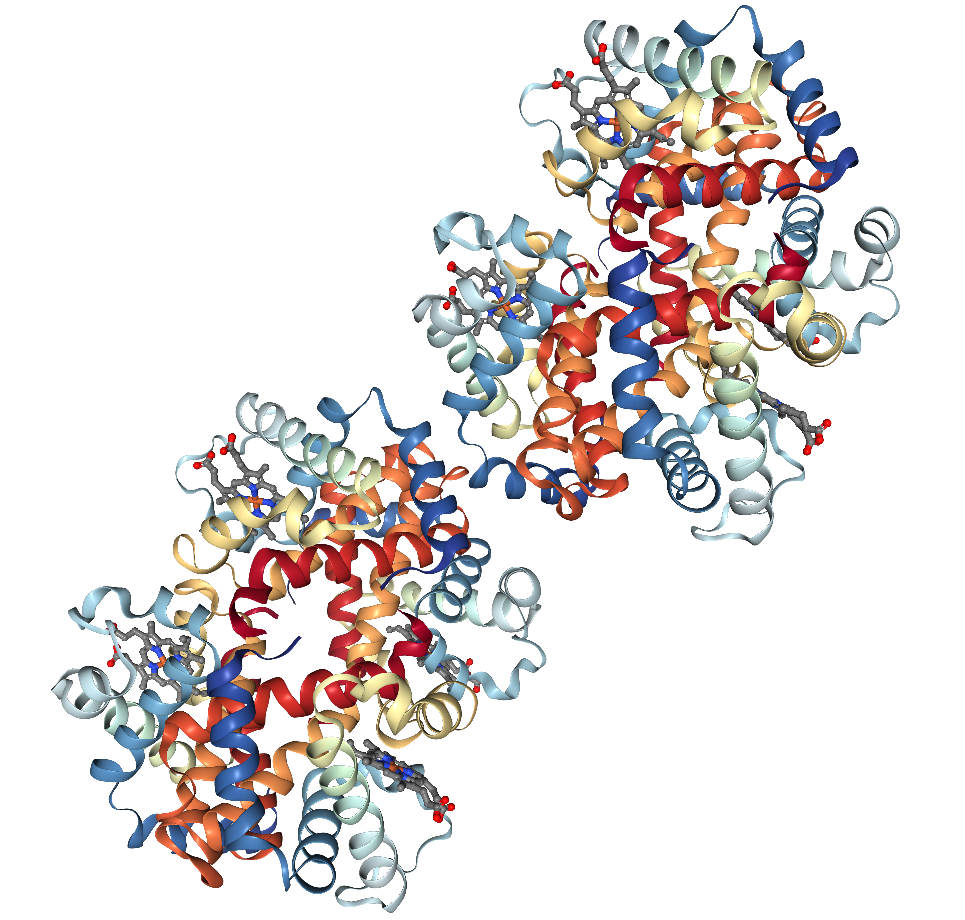
Рисунок 12.