Сравнение 3 водородных связей в структурах белка, расшифрованных с помощью ЯМР и РСА
Для выполнения задания из
таблицы был выбран
белок 1B6F (получен методом ЯМР, содержит
23 структуры) -
растительный аллерген березы повислой. Соотвествующая ему РСА-модель -
1BV1 с разрешением 2 Å.
Далее приведены соотвествующие рисунки анализируемых стурктур. Для 3 специфических позиций (между остовом и между боковыми цепями в ядре белка, а также в петле) были проанализированы водородные связи в обеих моделях, сводная таблица доступна для скачивания.
Использованная для подсчета водородных связей команда:
Далее приведены соотвествующие рисунки анализируемых стурктур. Для 3 специфических позиций (между остовом и между боковыми цепями в ядре белка, а также в петле) были проанализированы водородные связи в обеих моделях, сводная таблица доступна для скачивания.
Использованная для подсчета водородных связей команда:
istance hbond, [structure of interest], name N*, name O*, 3.5, mode=2
Рисунок 1. Белок 1B6F (ЯМР).
Рисунок 2. Структурное выравнивание 1B6F (ЯМР) и 1BV1 (РСА).
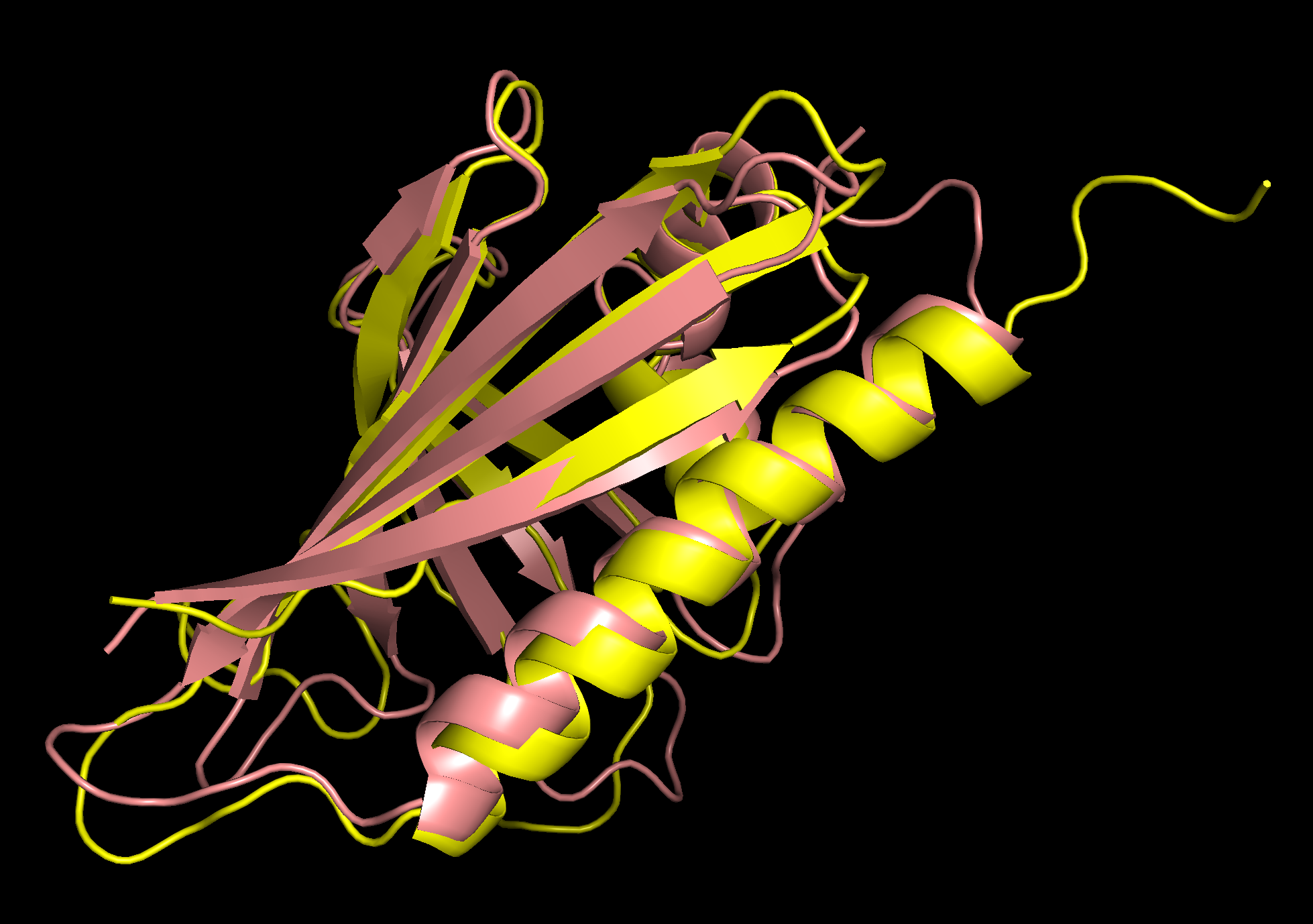
Рисунок 3. Структурное выравнивание 1B6F (ЯМР) и 1BV1 (РСА), показаны все ЯМР-модели.
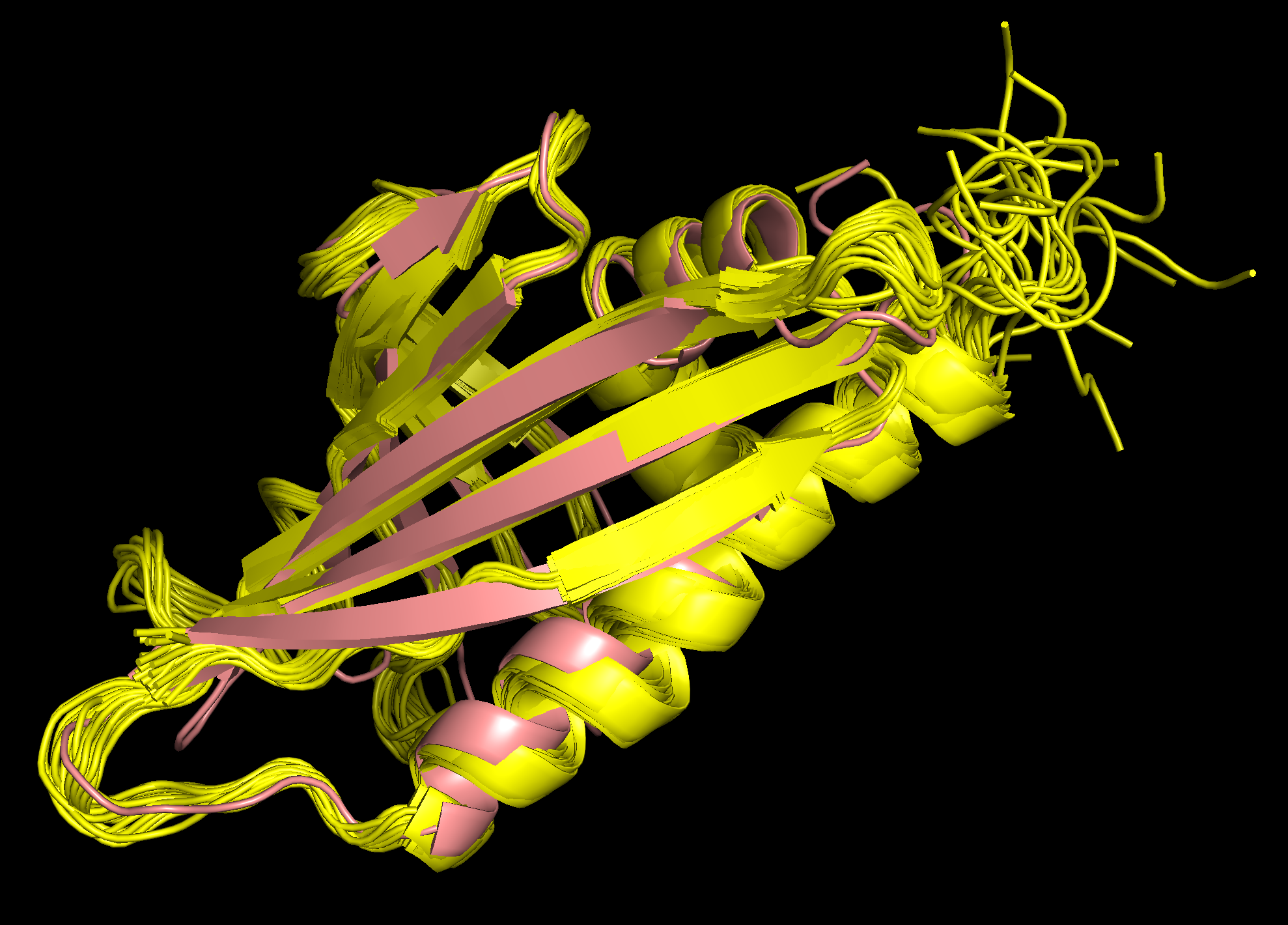
Рисунок 4. H-связь между Ala135 (белый) и Met139 (розовый).
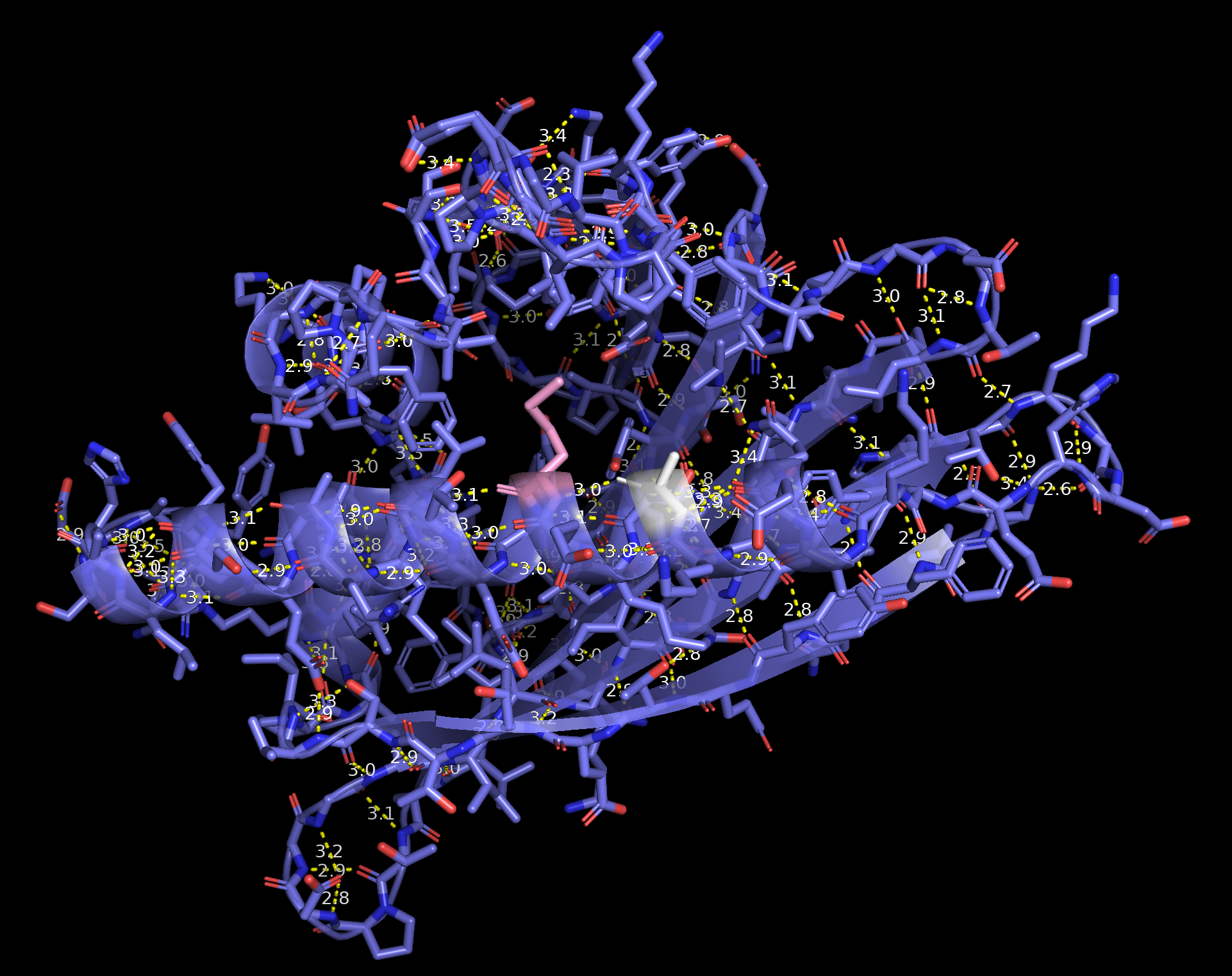
Рисунок 5. H-связь между Ala135 (белый) и Met139 (розовый) при увеличении масштаба.
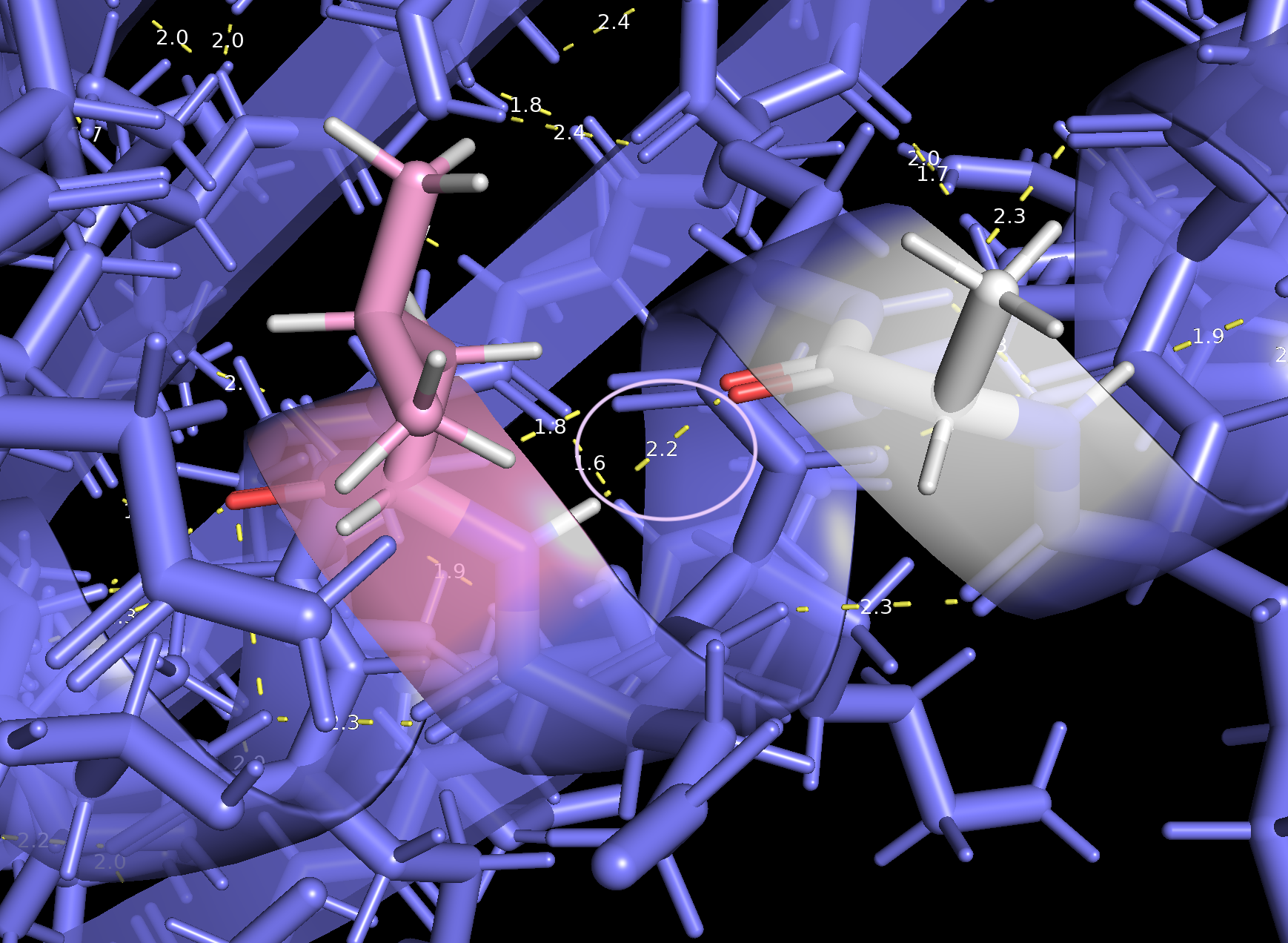
Рисунок 6. H-связь между Lys32 (оранжевый) и Asn28 (зеленый).
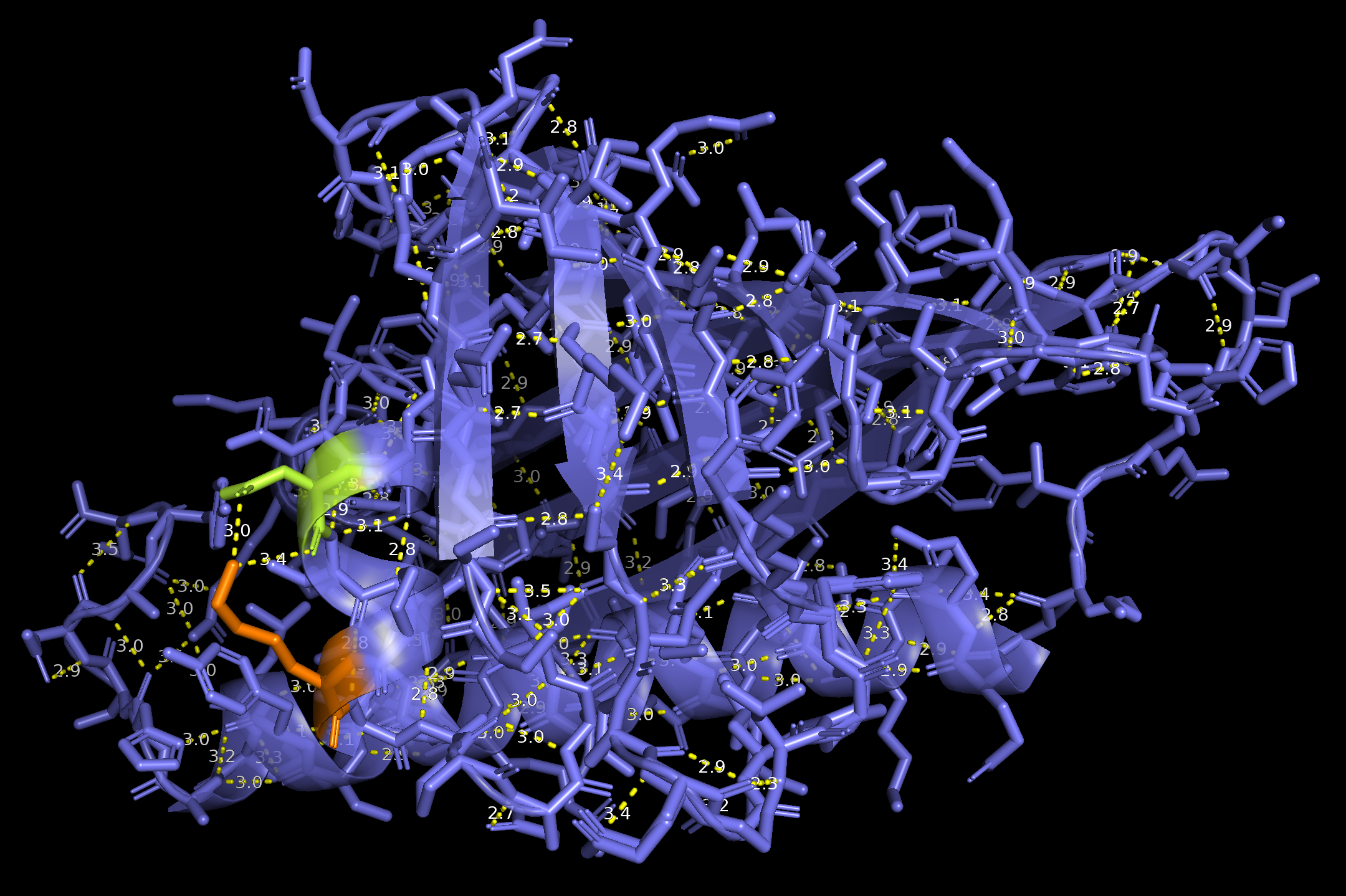
Рисунок 7. H-связь между Lys32 (оранжевый) и Asn28 (зеленый) при увеличении масштаба.
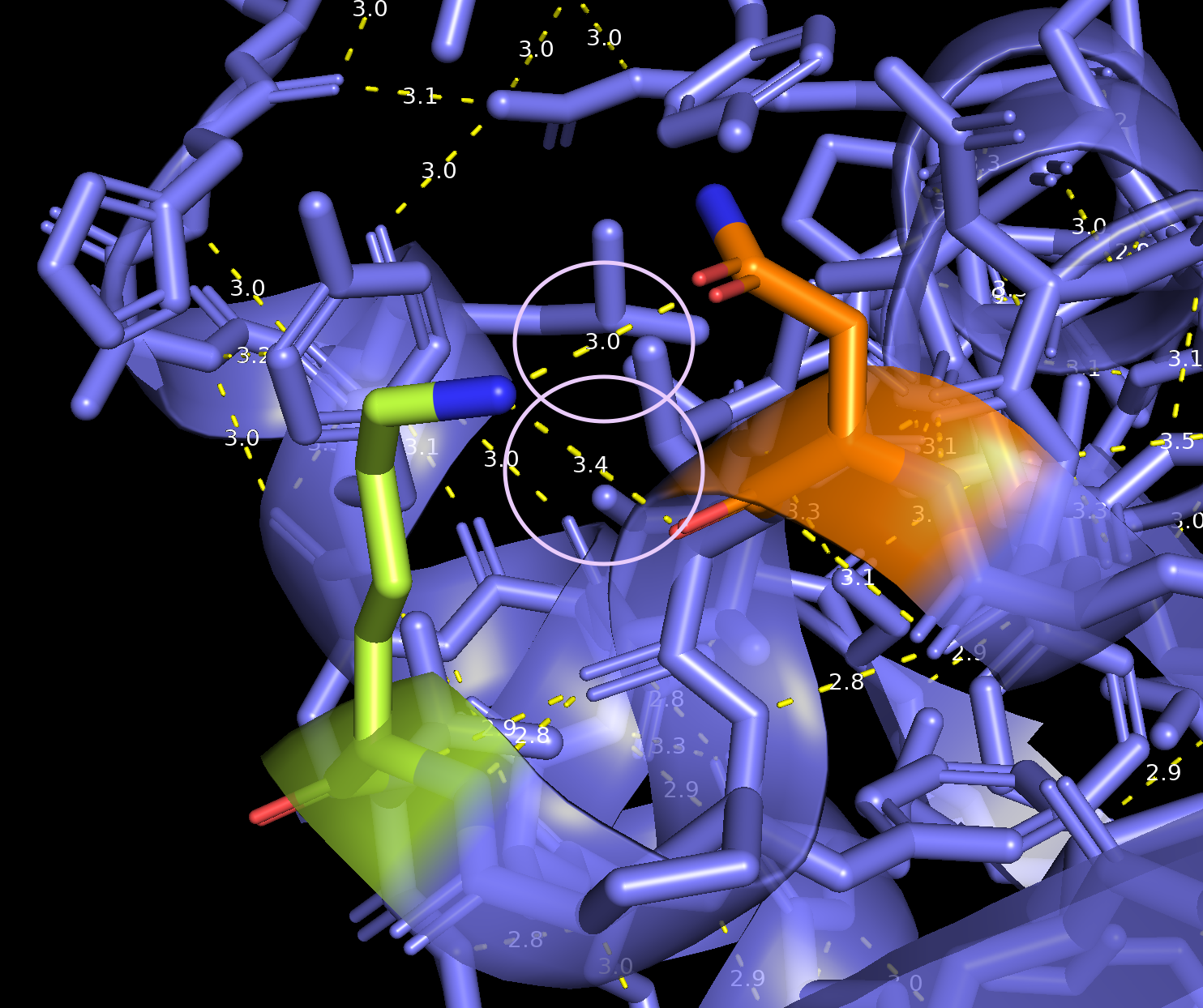
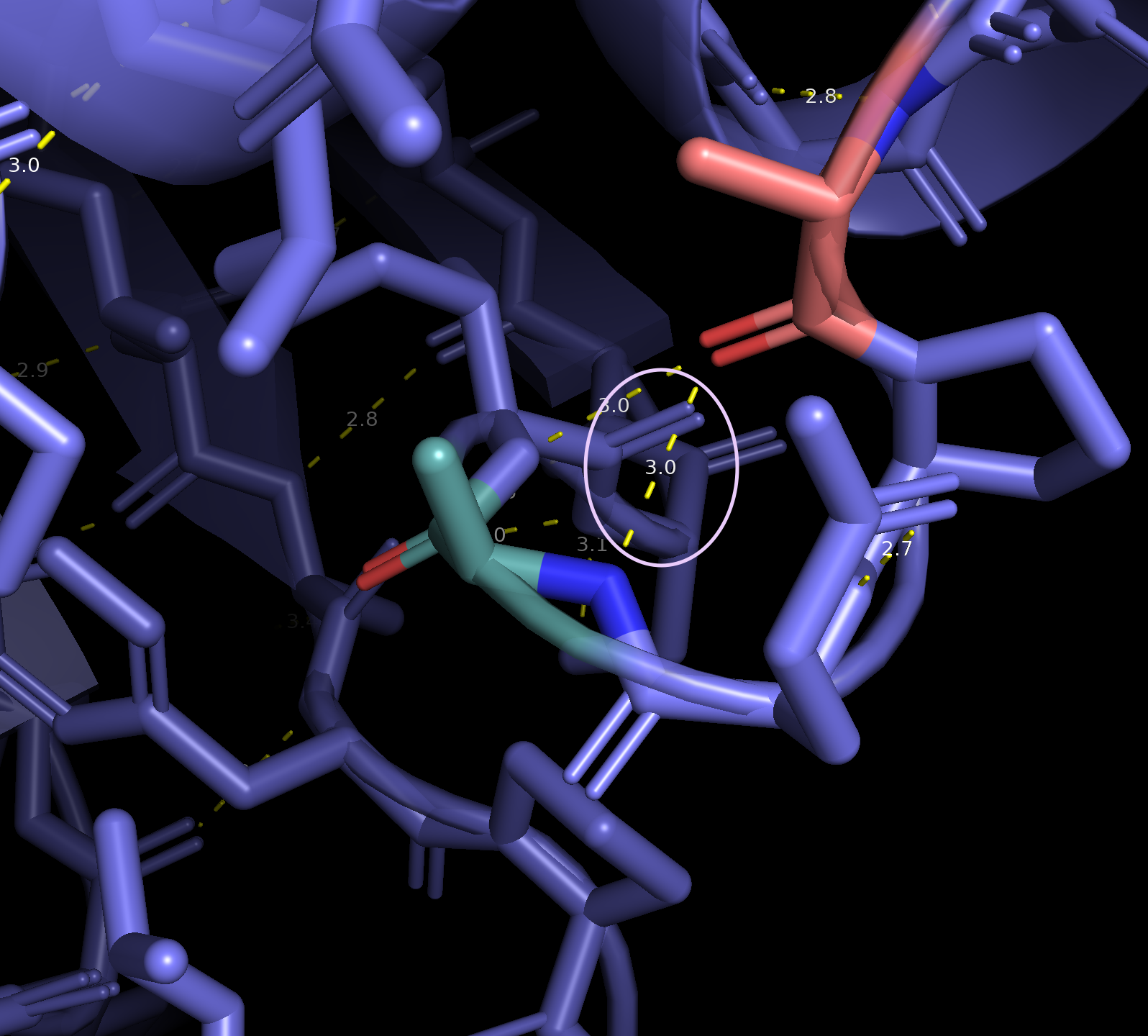
Рисунок 8. H-связь между Ala34 (красный) и Ala37 (темно-зеленый).
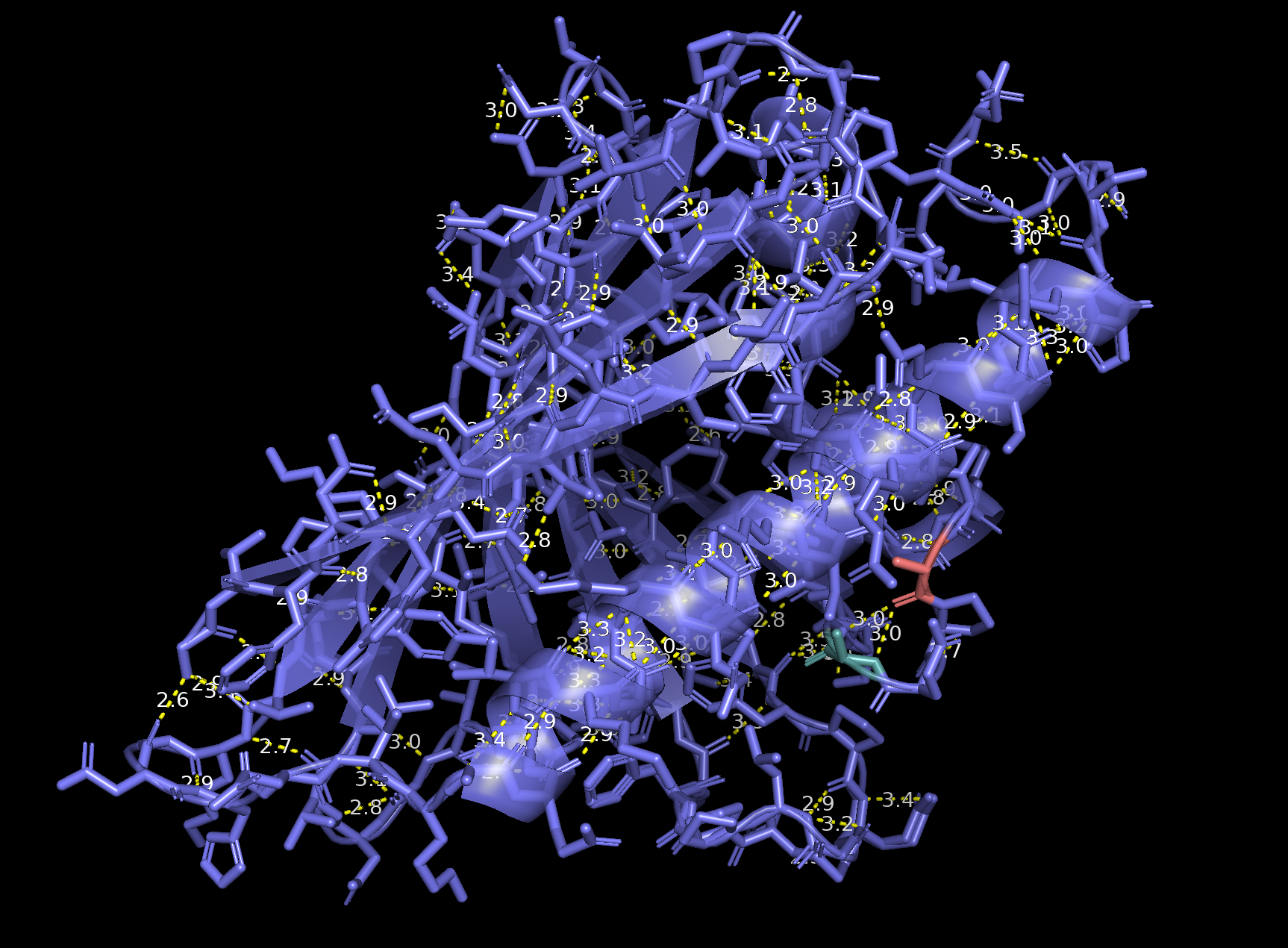
Рисунок 9. H-связь между Ala34 (красный) и Ala37 (темно-зеленый) при увеличении масштаба.
На основании таблицы можно сделать вывод, что:
1) Водородная связь между остатками остова (Ala135, Met139) присутствует во всех моделях ЯМР и имеет достаточно фиксированную длину, поскольку способствует стабилизации α-спирали и важна для поддержания структуры.
2) Наименее стабильными оказались водорои водородные связи боковых остатков из ядра белка (Lys32, Asn28), что может говорить об относительной мобильности в пространстве указанных остатков.
3) Интересен тот факт, что водородные связи остатков из петли также встречались в 100% ЯМР-моделей. Возможно, подвижность петли ограничена соседствующими элементами вторичной структуры, вследствие чего водородные связи в этом участке приобретают некую стабильность.
1) Водородная связь между остатками остова (Ala135, Met139) присутствует во всех моделях ЯМР и имеет достаточно фиксированную длину, поскольку способствует стабилизации α-спирали и важна для поддержания структуры.
2) Наименее стабильными оказались водорои водородные связи боковых остатков из ядра белка (Lys32, Asn28), что может говорить об относительной мобильности в пространстве указанных остатков.
3) Интересен тот факт, что водородные связи остатков из петли также встречались в 100% ЯМР-моделей. Возможно, подвижность петли ограничена соседствующими элементами вторичной структуры, вследствие чего водородные связи в этом участке приобретают некую стабильность.