Протонирование
PROPKA
Я работала со структурой 5GPL, кристаллизация которой проходла при рН=4.
После обработки этой структуры PDB2PQR я получила файлы с расширением log и pqr, в log было 32 ASP, 58 GLU и 2 HIS. Из них выбрала три аминокислотных остатка с самым выскоим pKa (и выше pH кристаллизации). Это ASP в 69 с pKa=5.99 (model-pKa=3.8), GLU в 60 с pKa=5.91 (model-pKa = 4.5), HIS c pKa=7.2 (model-pKa = 6.5).
ASP-69
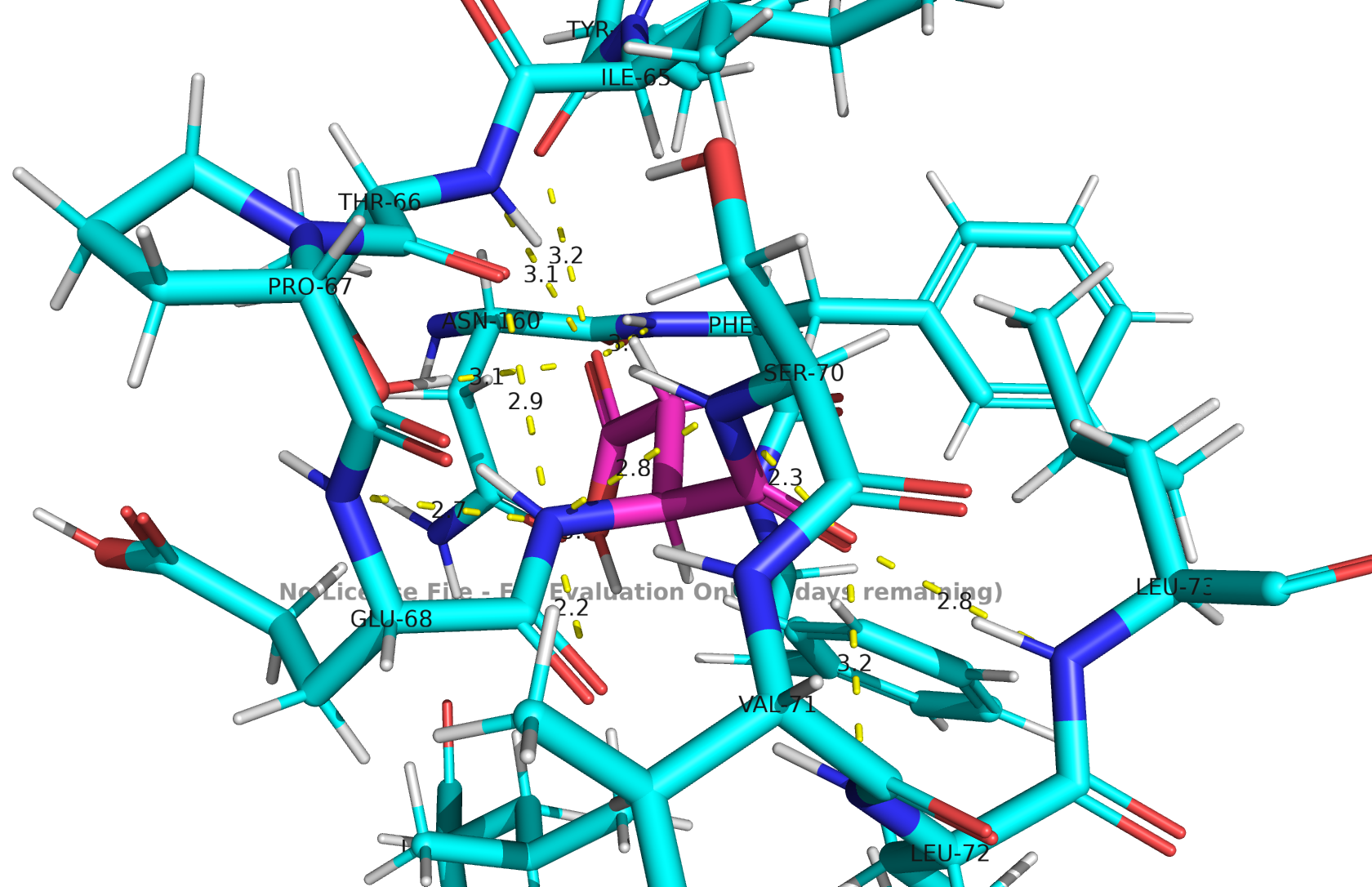
Рис 1. Водородные связи ASP-69
Аспарагиновая кислота находится в плотном окружении и образует шесть правдоподобных контактов (с длиной 2.7-3.0 ангстрем). Рядом находится глутаминовая кислота, у которой так же отрицательный заряд, поэтому можно говорить о вероятном протонировании аспарагиновой кислоты для компенсации двух соседних отрицательных зарядов. Рядом так же много гидрофобных остатков (изолейцин, валин, лейин и фенилаланин), что говорит о плохой сольватации. Можно судить о том, что водородных связей недостаточно для компенсации заряда, поэтому протонирование вероятно.
GLU-60
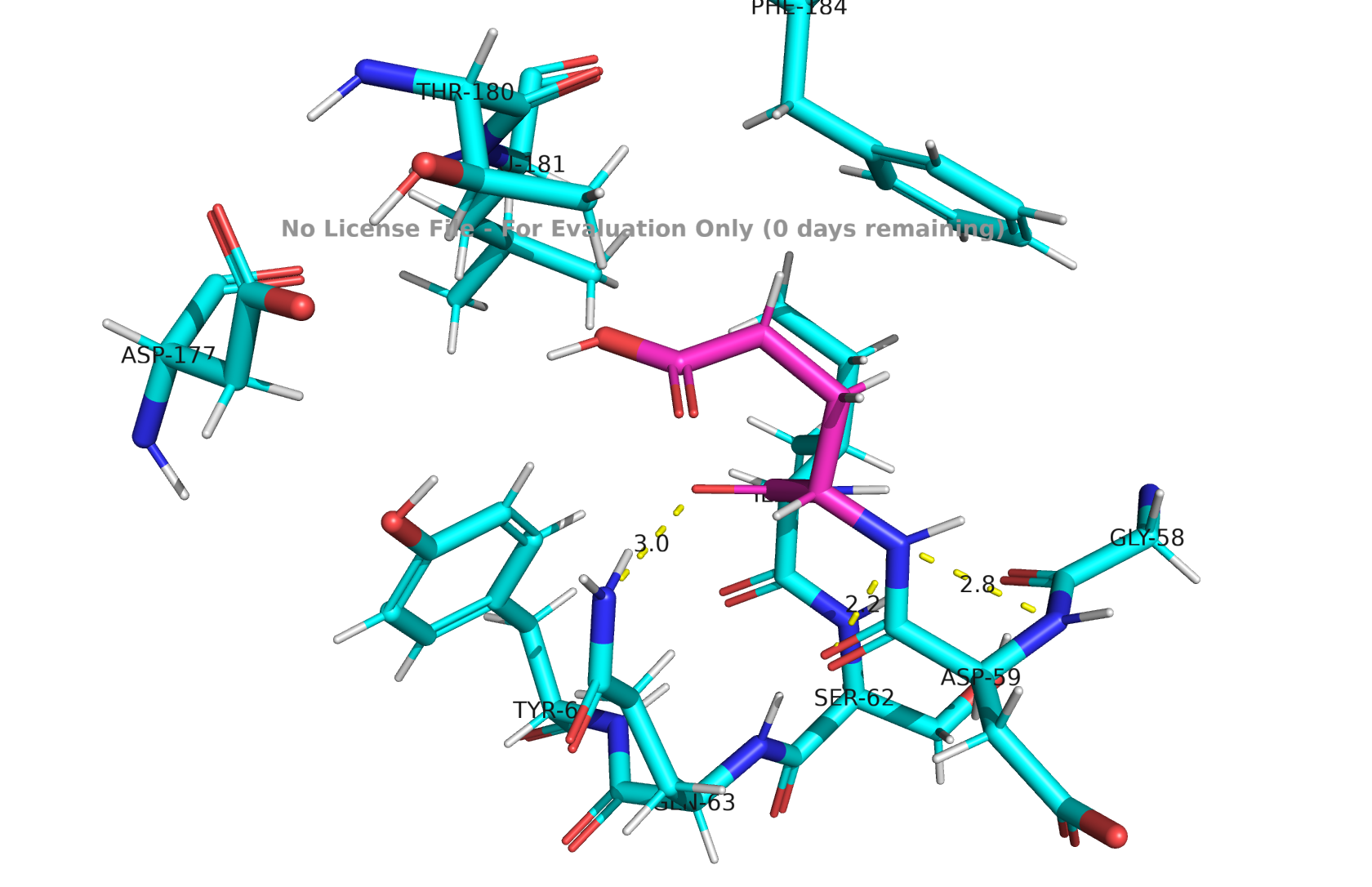
Рис 2. Водородные связи GLU-60
Глутаминовая кислота находится в полярном, хорошо организованном окружении. Есть контакты с типичными донорами- серином, глицином и тирозином. Можно судить о стабилизации водородными связями и о допустимости депротонированной формы в таком окружении.
HIS-143
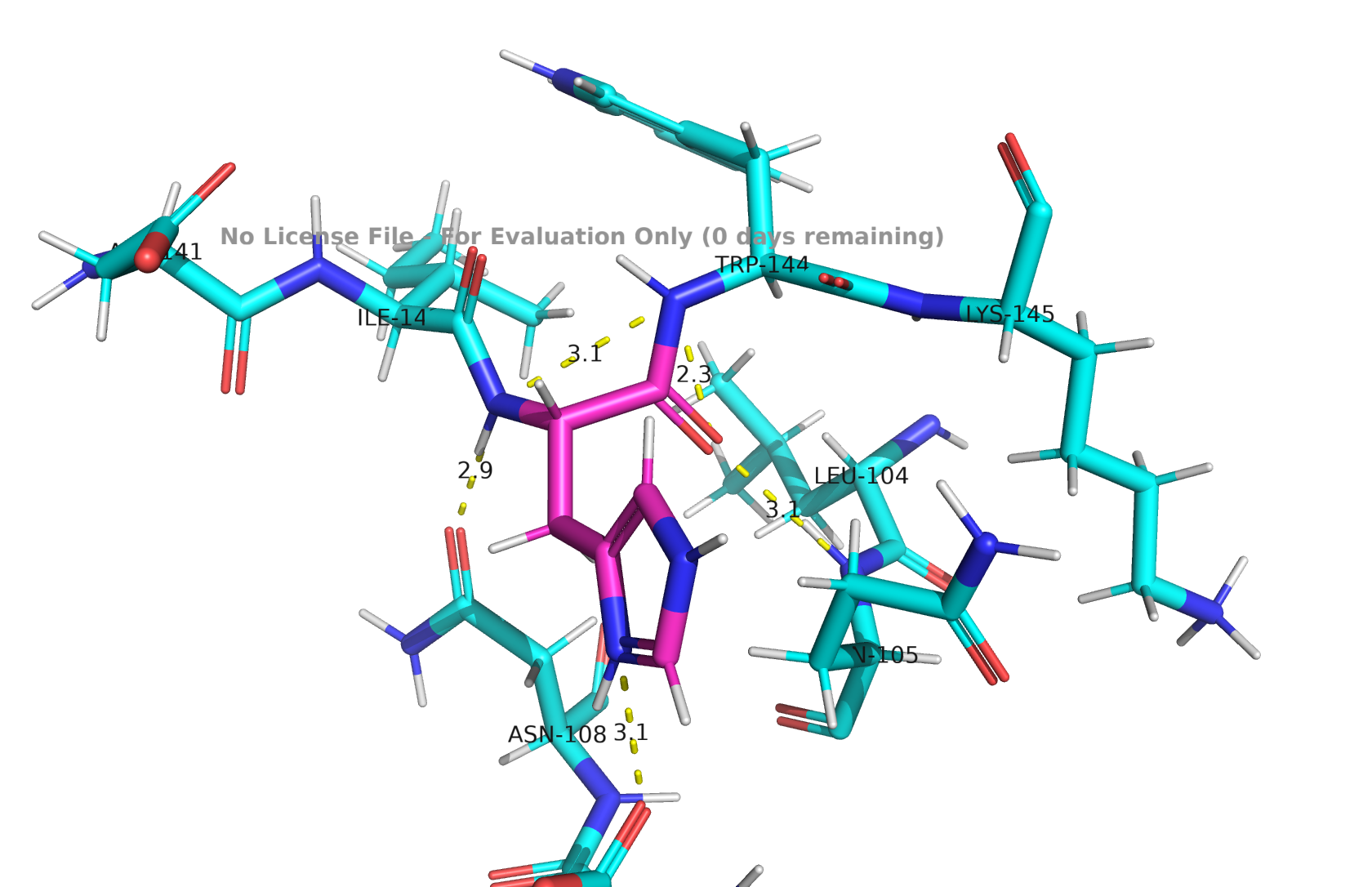
Рис 3. Водородные связи HIS-143
Есть короткая связь между имидозольным азотом гистидина и атомом кислорода триптофана, это похоже на сязь протонированного гистидина, в которой он выступает как донор. Рядом находится лизин с положительным зарядом, но он достаточно далеко, чтобы можно было с уверенностью говорить о том, что он не позволяет пронировать гистидин.
PROTOSS
ASP-69
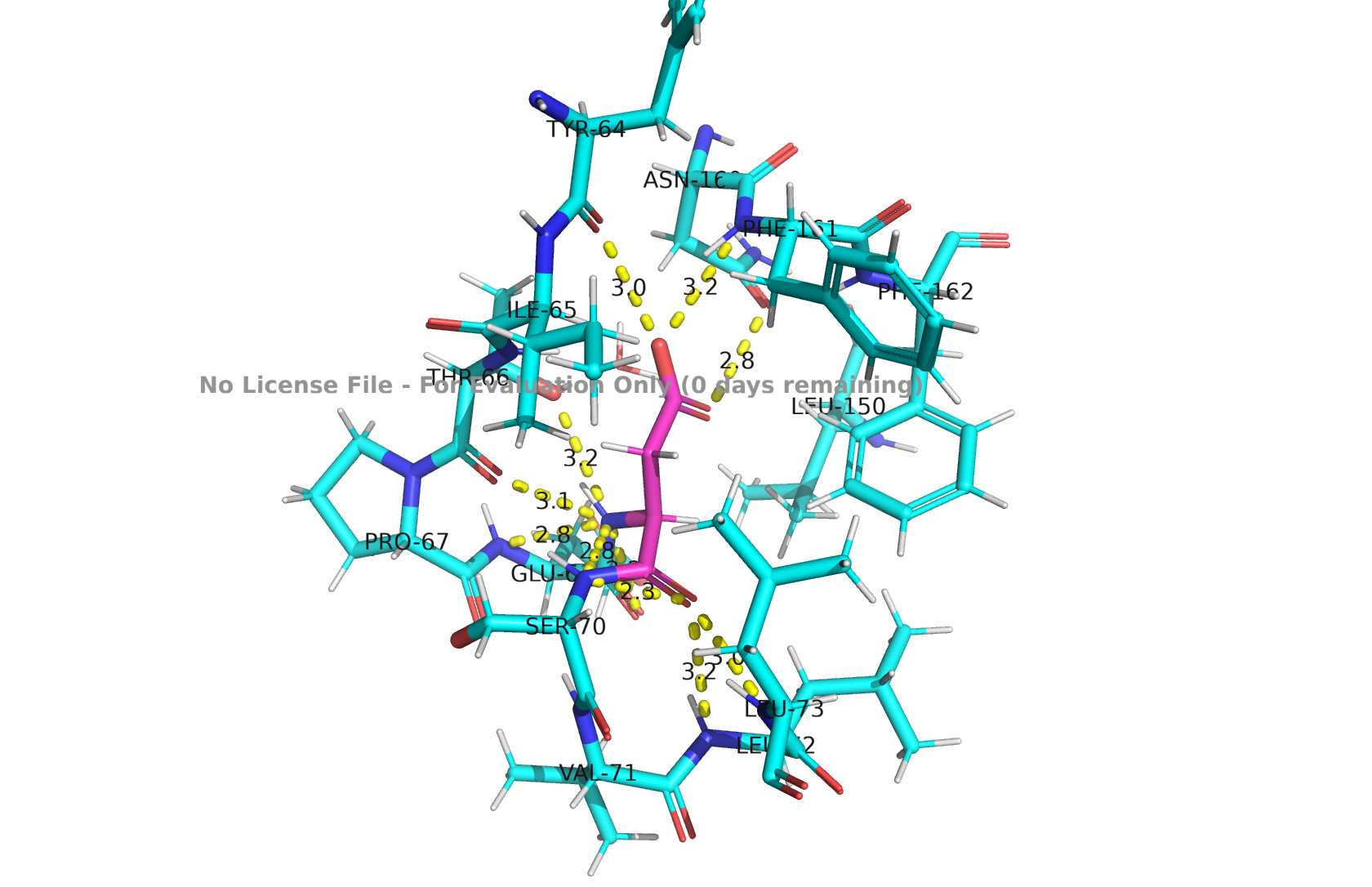
Рис 4. Водородные связи ASP-69, PROTOSS
Есть очень короткая связь (2.3 ангстрема) между аспарагиновой кислотой и серином, это, вероятнее всего, ошибка, так как такая длина не характерна для водородных связей. Судя по выдаче, есть только обычные H на backbone и Cα/Cβ (H, HA, HB2, HB3) и нет водорода на карбоксиле (не видно атомов типа HD1/HD2 или HOD1/HOD2), значит фспарагиновая кислота депротонирована.
GLN-60
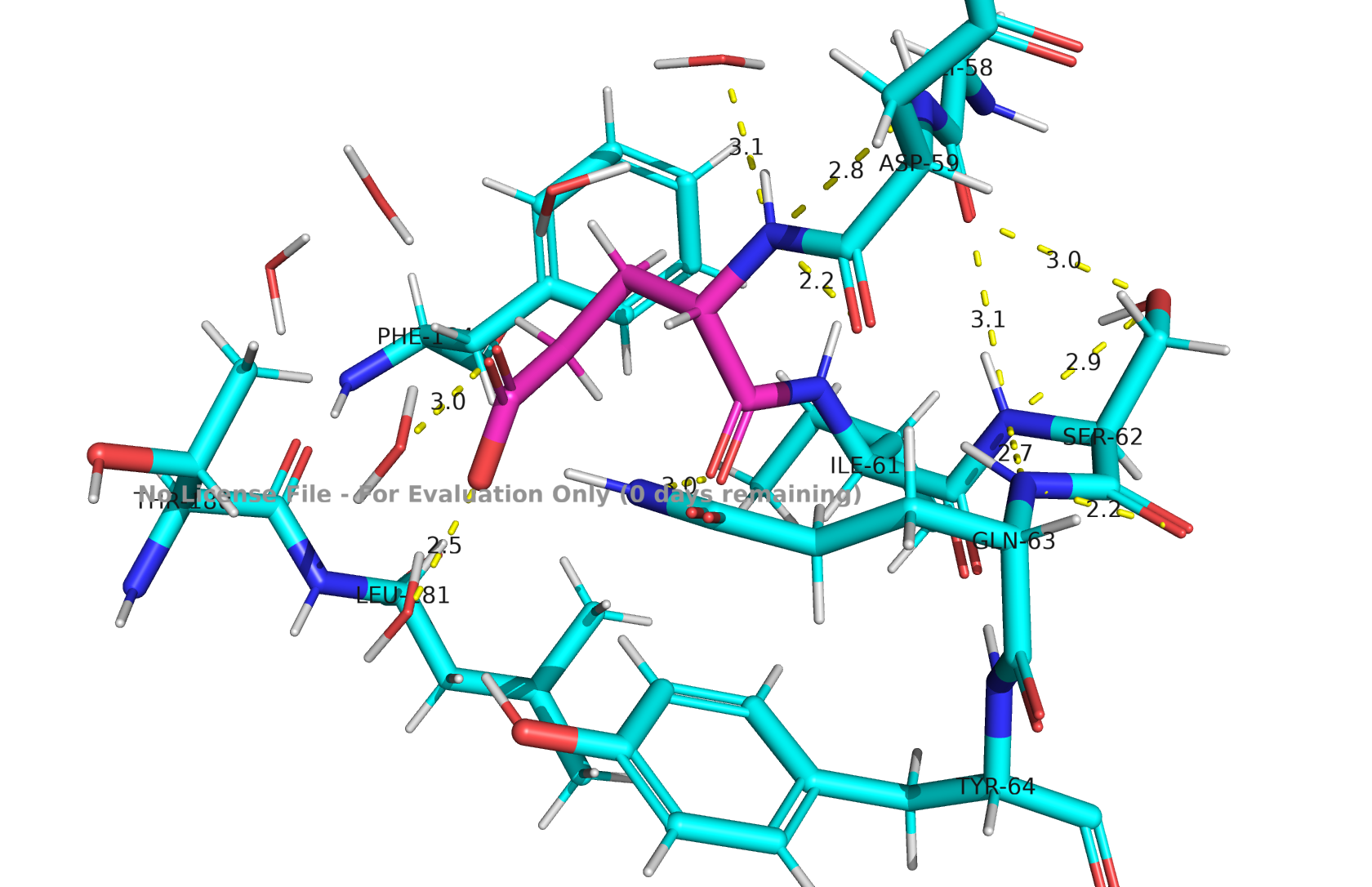
Рис 5. Водородные связи GLN-60, PROTOSS
Вокруг карбоксилата плотная сеть доноров, глутаминовая кислота, вероятно, депротонирована. Есть несколько коротких связей с разных направлений, что формирует устойчивую геометрию, окружение полярное, значит отрицательный заряд хорошо компенсирвоан.
HIS-143
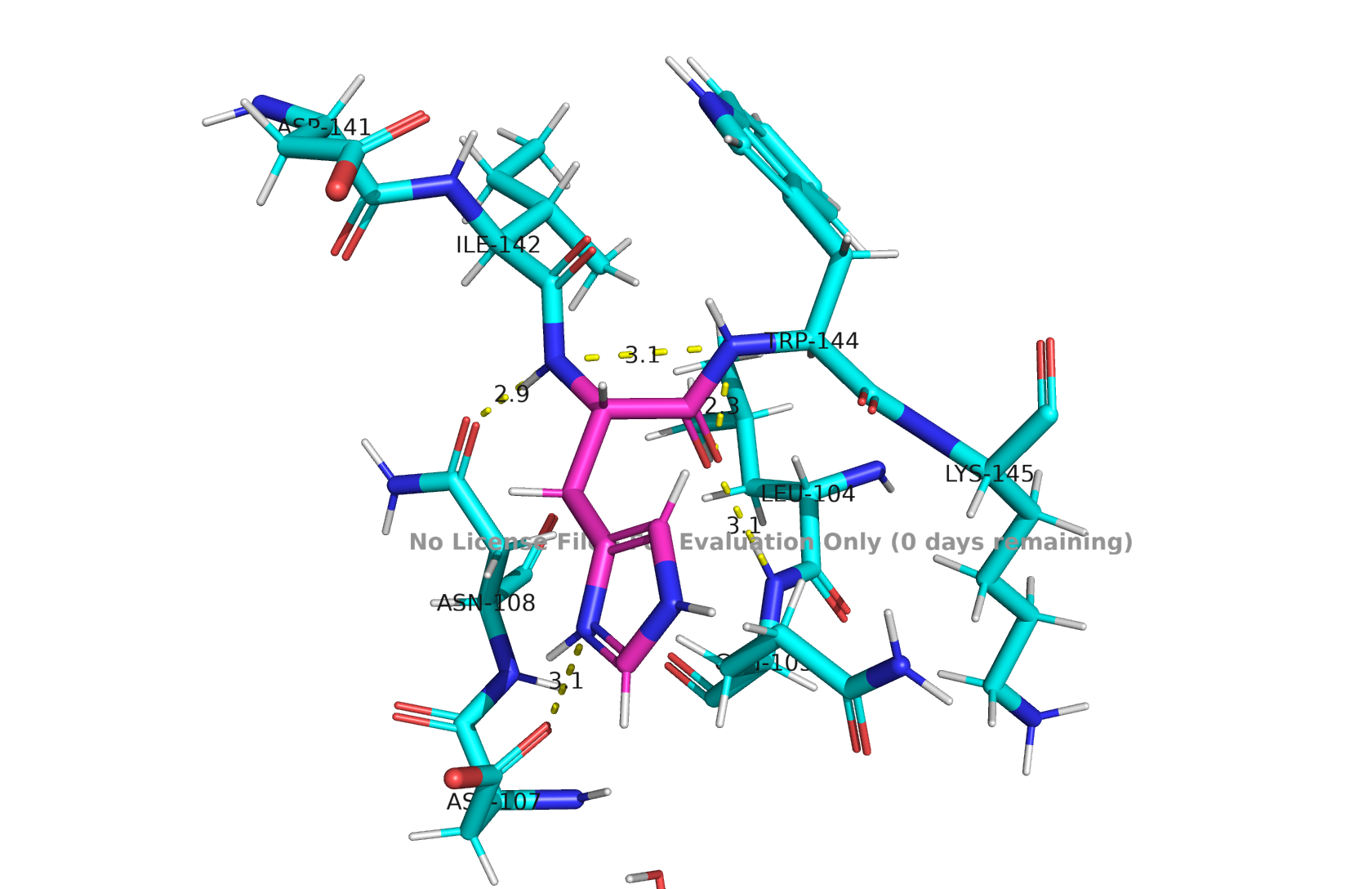
Рис 6. Водородные связи HIS-143, PROTOSS
PROTOSS оставил гистидин в конфигцрации, в которой имидозольное кольцо участвует в образовании водородных связей, есть несколько правдоподобных по длине контактов.
ВЫВОД
Там, где PROPKA даёт pKa > pH, ожидается значимая доля протонированной формы. Protoss часто это отражает либо явной протонировкой, либо геометрией окружения, которая делает протонирование правдоподобным (плохая сольватация, отсутствие компенсации заряда, соседние заряды). Для гистидина, где pKa часто чувствителен к водородной сети, Protoss обычно хорошо согласуется по направлению: если вокруг гистидина есть плотная сеть доноров/акцепторов, это поддерживает повышенный pKa по PROPKA. В целом модели согласуются.