AlphaFold и DOMAK
1B. Helices
Для работы взяла последовательности В11. Оригинальная последовательность: 1Y9B.
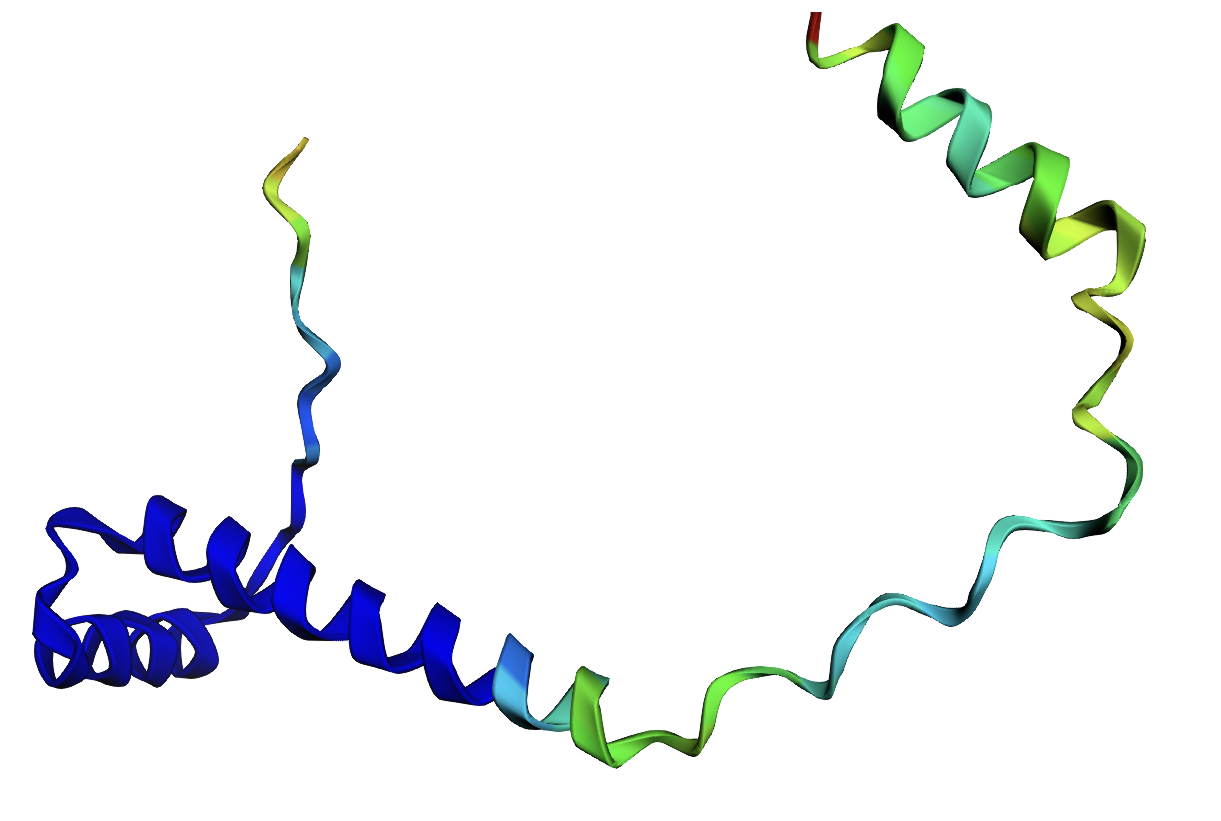
Структура представляет собой альфа-спирали из двух цепей, длина- 90 аминокислот. Белок взят из холерного вибриона.
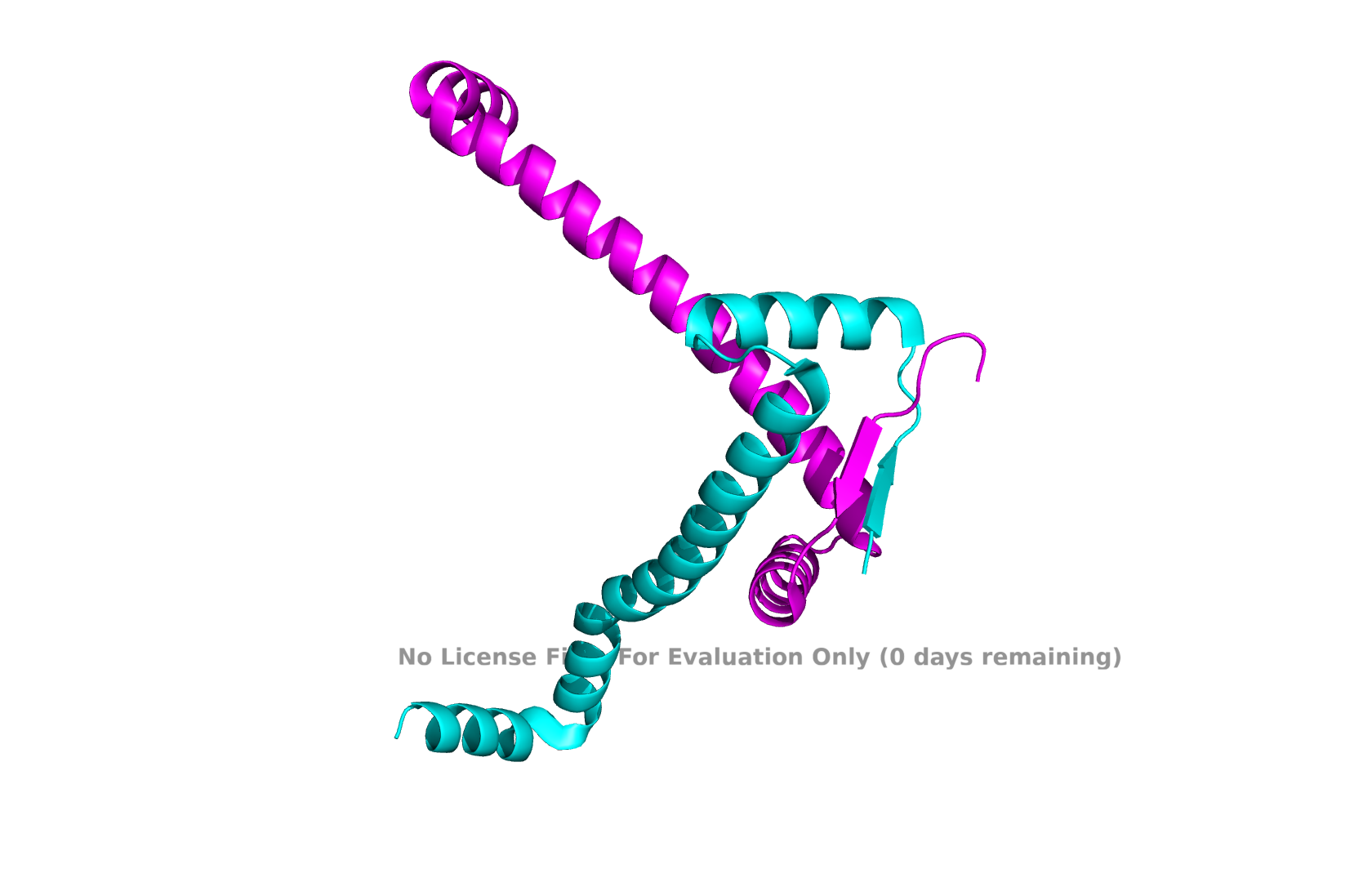
Рис 1. 1Y9B (PDB)

Рис 2. Выравнивание 1Y9B и seqA
Видно общий каркас– альфа-спираль по центру. На концах предсказанная структура отклоняется от pdb, что может говорить о наличии линкера.
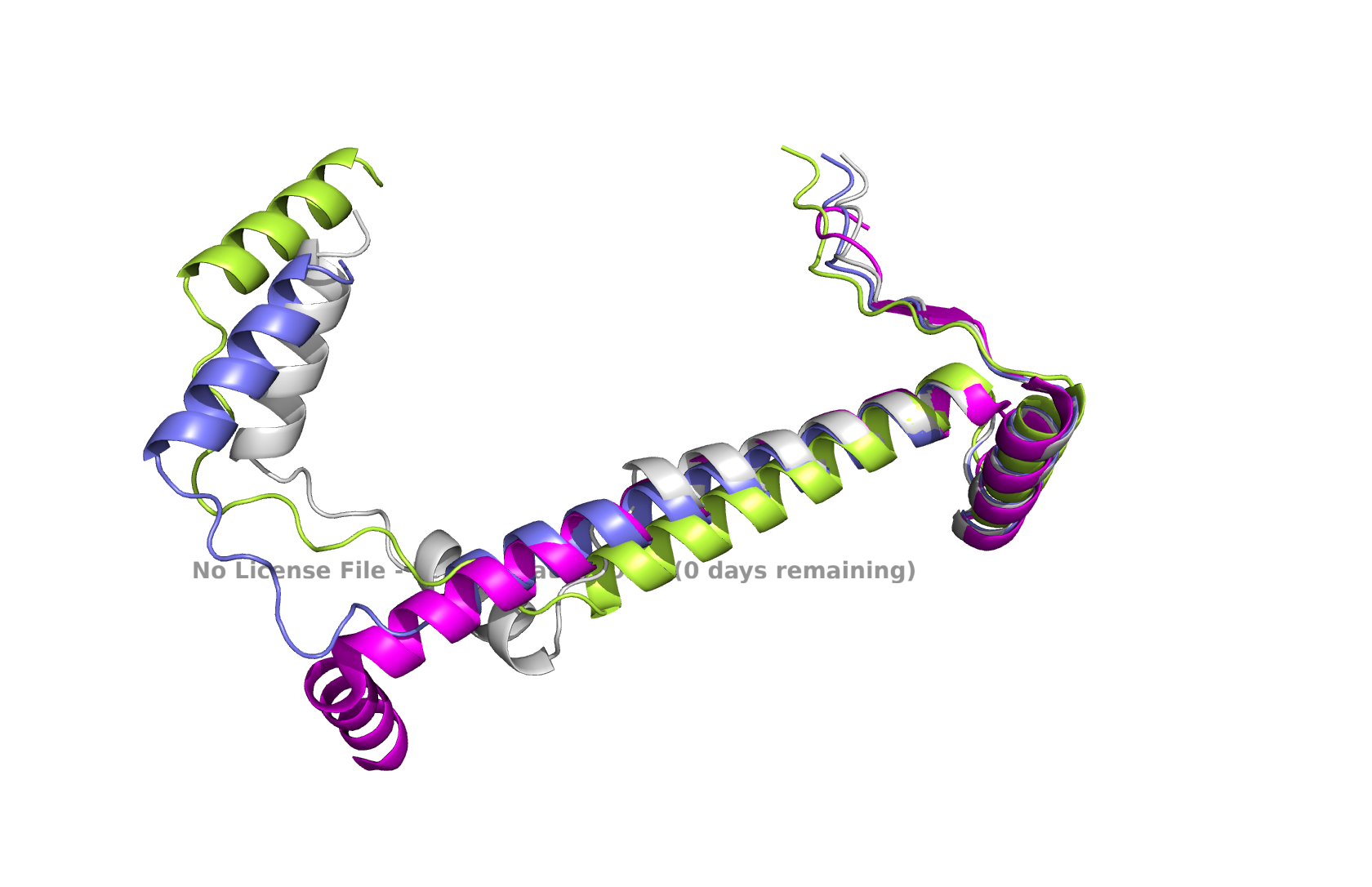
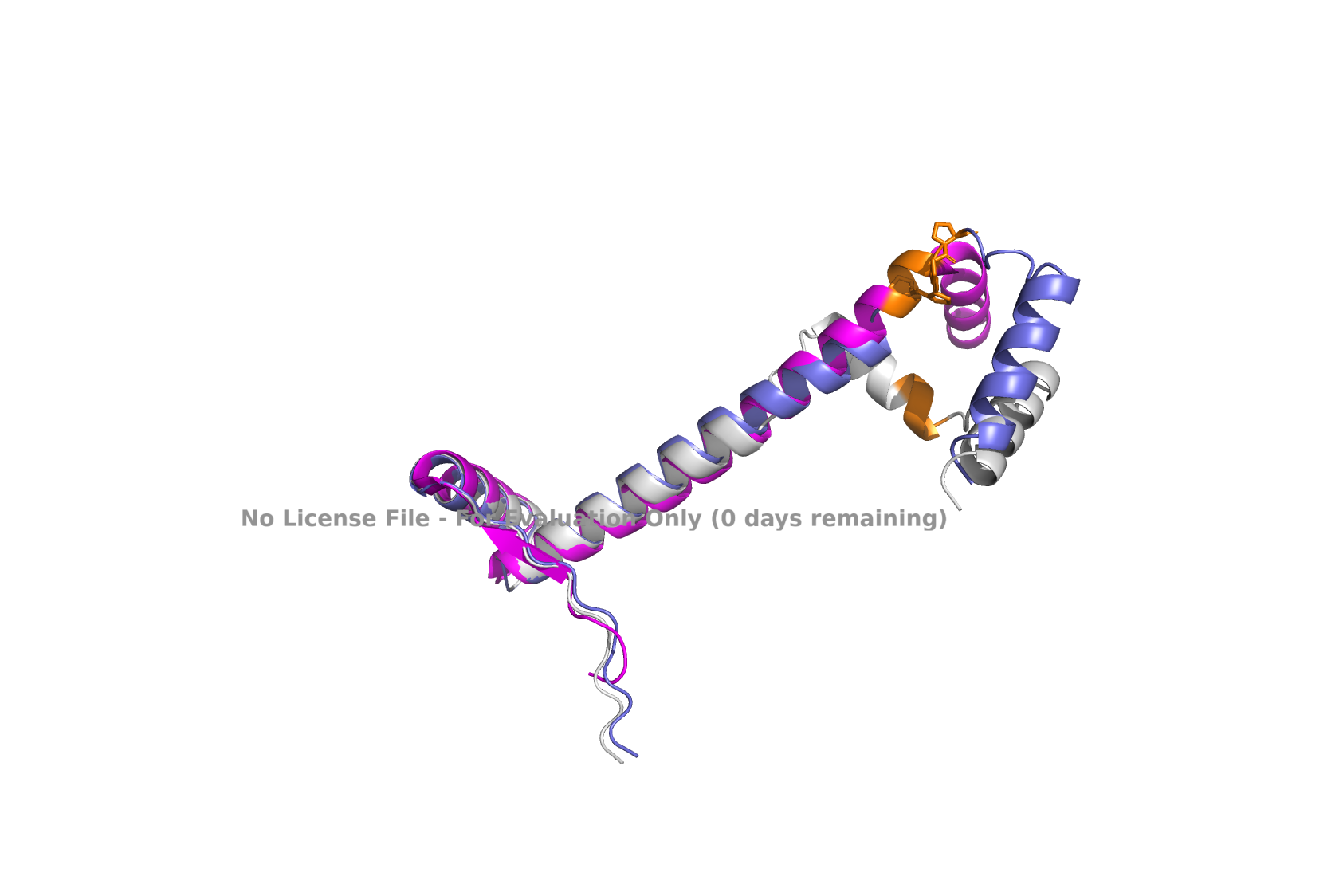
Рис 3. Выравнивание 1Y9B, seqA, seqB, seqC
В общем выравнивании видно, что предсказанные структуры согласуются больше друг с другом, чем со структурой из pdb. Для seqB (сиреневая) AlphaFold предсказывает более длинную спираль посередине, чем для seqA.
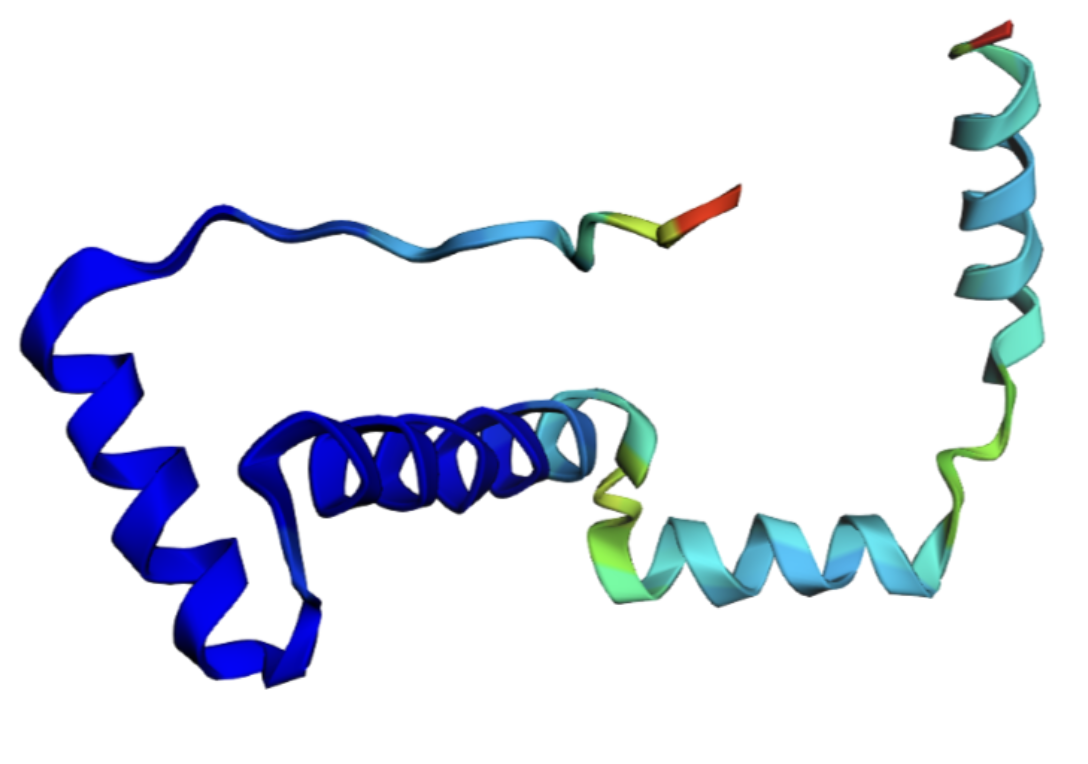
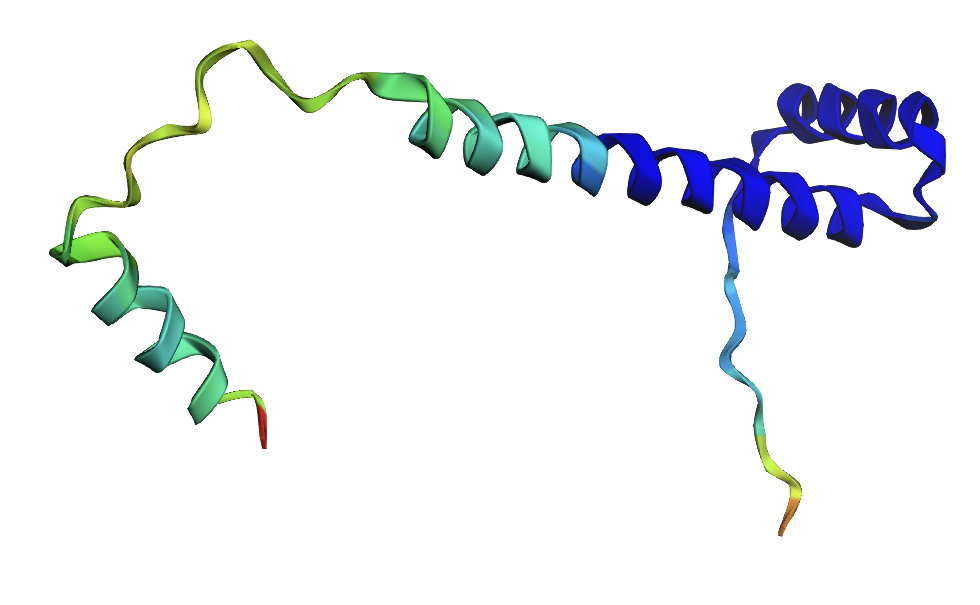

N-концевая спираль выровнена хорошо и эта область окрашена как hogh-confidence.
В seqB и seqC есть полипролиновая вставка. На рисунках 7-10 она показана оранжевым цветом.
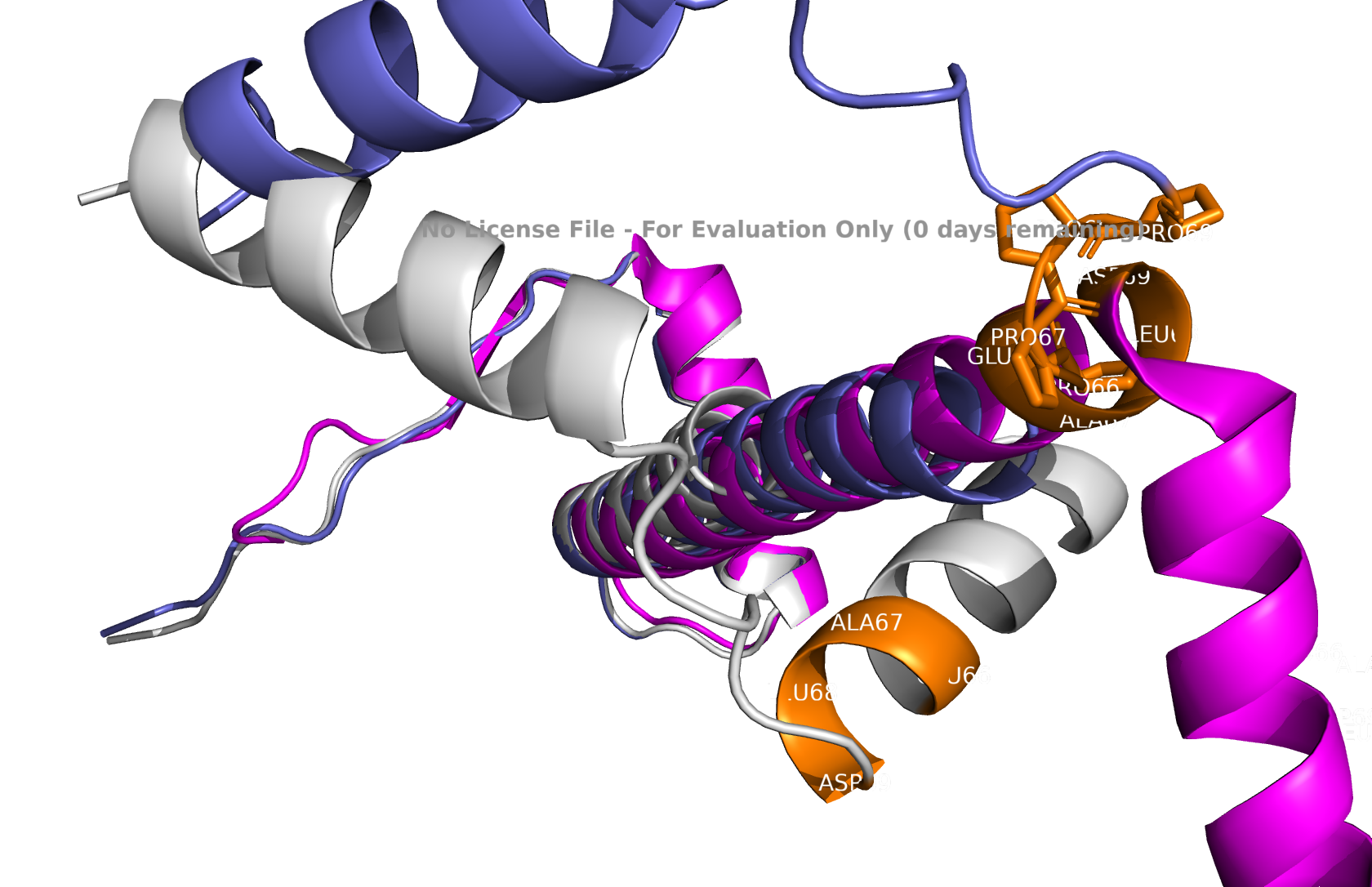
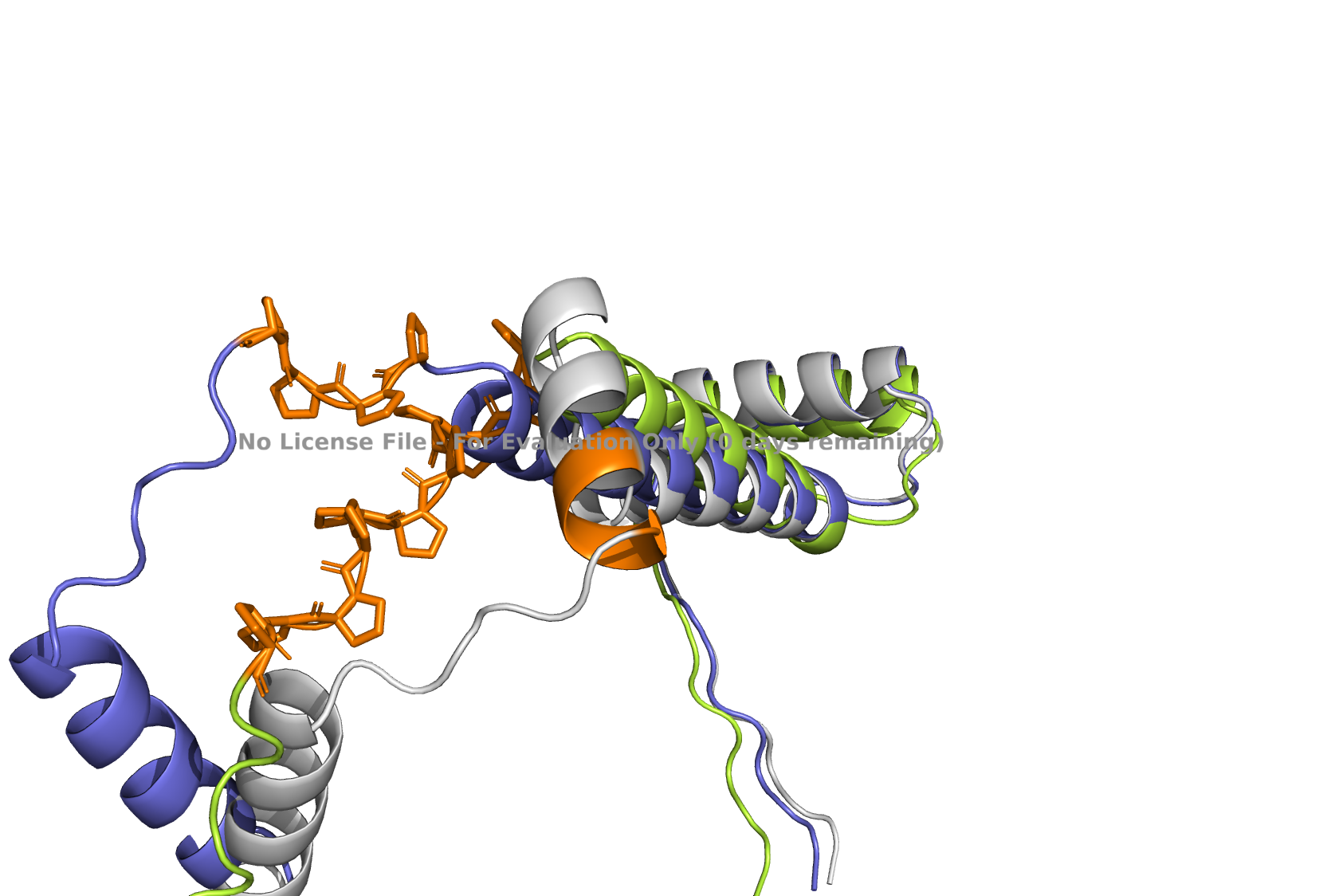
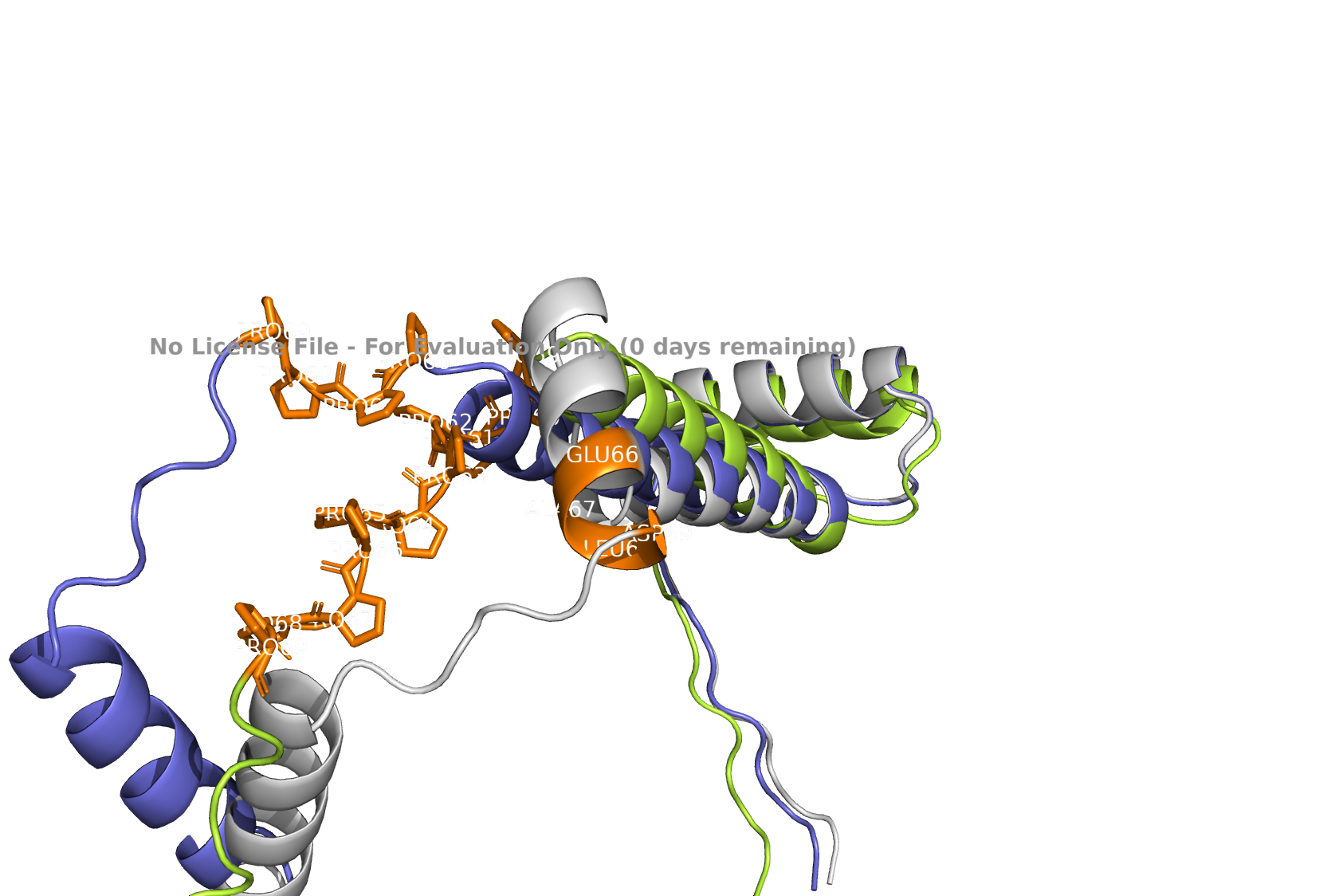
На рисунках виден эффект радикальной замены C-концевого участка альфа-спирали на пролины. В pdb и в seqA область 66–69 формирует завершение альфа-спирали. В seqB, содержащем мотив пролинов в этих позициях, спиральная организация полностью утрачена и участок переходит в неструктурированное состояние. Наблюдаемая дестабилизация вторичной структуры, что согласуется с известной ролью пролина как разрушителя альфа-спиралей. У seqC пролиновая вставка на уровне 59–69 остатков. В pdb и в предсказании для seqA данный участок формирует фрагмент альфа-спирали. В seqB неупорядоченное состояние наблюдается на позициях 65–69, что соответствует пролиновой замене 66–69, тогда как оставшаяся часть сохраняет спиральную конформацию. В seqC весь интервал 59–69 утрачивает регулярную вторичную структуру и представлен disordered-участком, что соответствует ожидаемому эффекту пролинов.
Вывод
В целом AlphaFold реагирует на вставку пролинов в альфа-спираль предсказуемым образом: поскольку пролин не способен формировать водородные связи, стабилизирующие остов спирали, в точке такой замены модель последовательно предсказывает неупорядоченный участок. Основные вопросы возникают не к этому эффекту, а к предсказанию структуры самой последовательности. В частности, внутри протяжённой альфа-спирали появляется необъяснимая вставка disordered-region, модель не сворачивает его в альфа-спираль по неясной причине.
DOMAK
У меня был белок 1HW2, chain C. Это транскрипционный контроль метаболизма жирных кислот у E. coli Колаб.
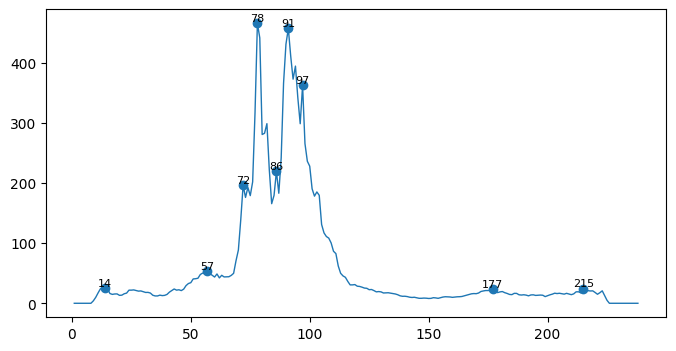
Рис 11. График зависимости split_value от номера остатка (номера остатков на пиках отмечены).
Видны пики при resi 72, 78, 86, 91 и 97. Судя по группе пиков, разделение доменов наиболее вероятно на 78 остатке.
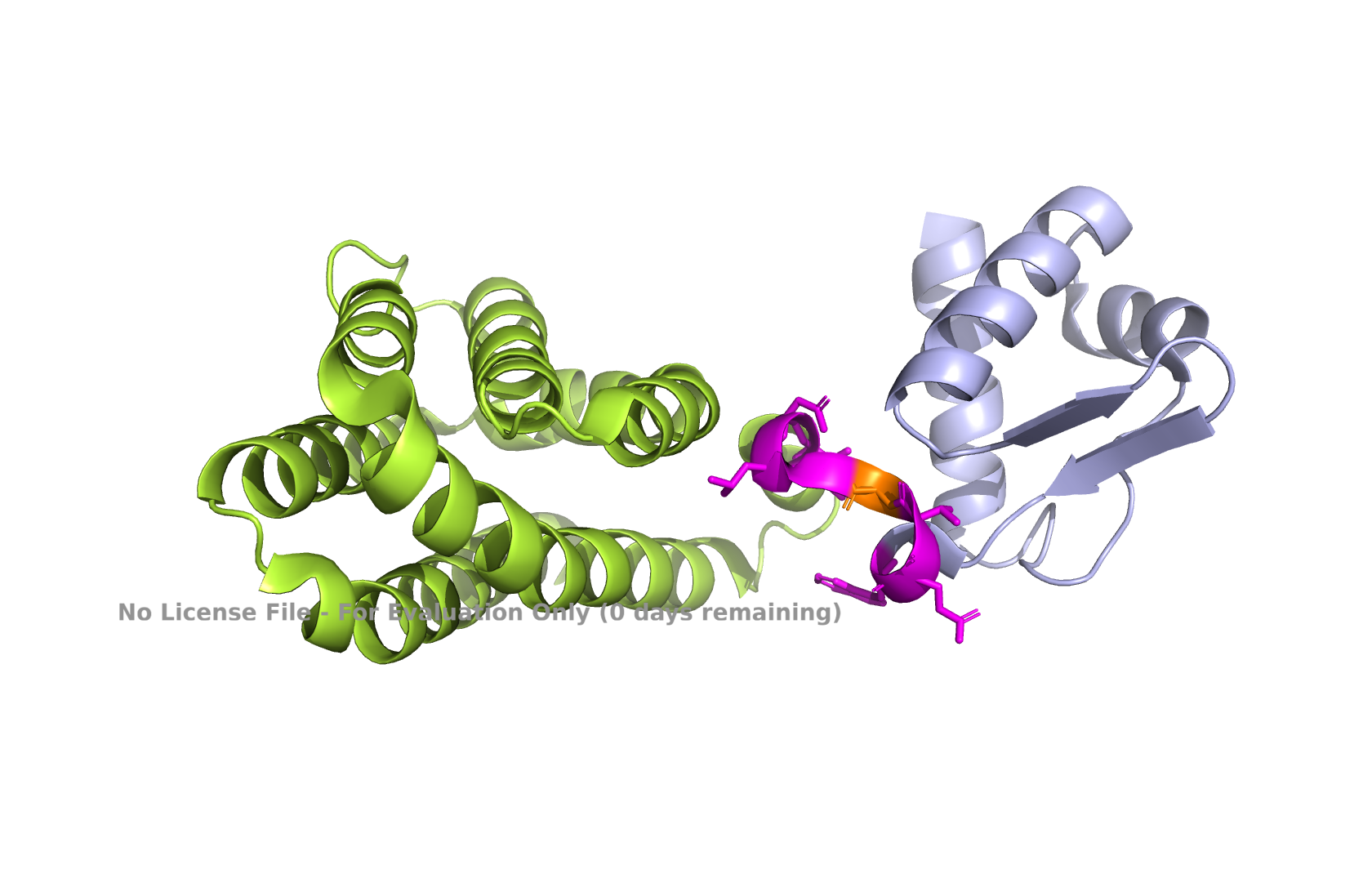
Рис 12. Положение 78 остатка, наиболее вероятное раздление домена.
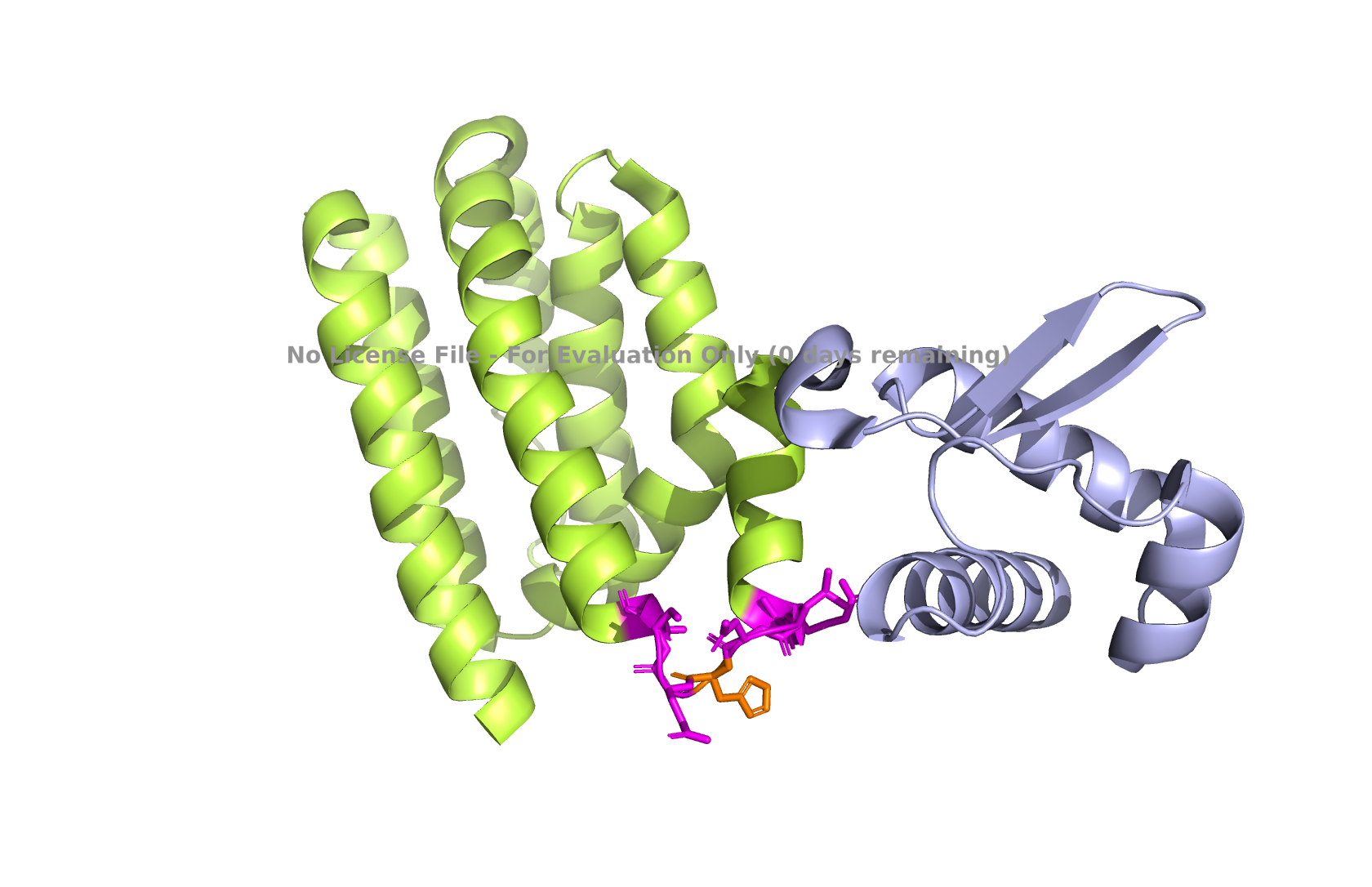
Рис 13. Положение 91 остатка, локальный максимум.
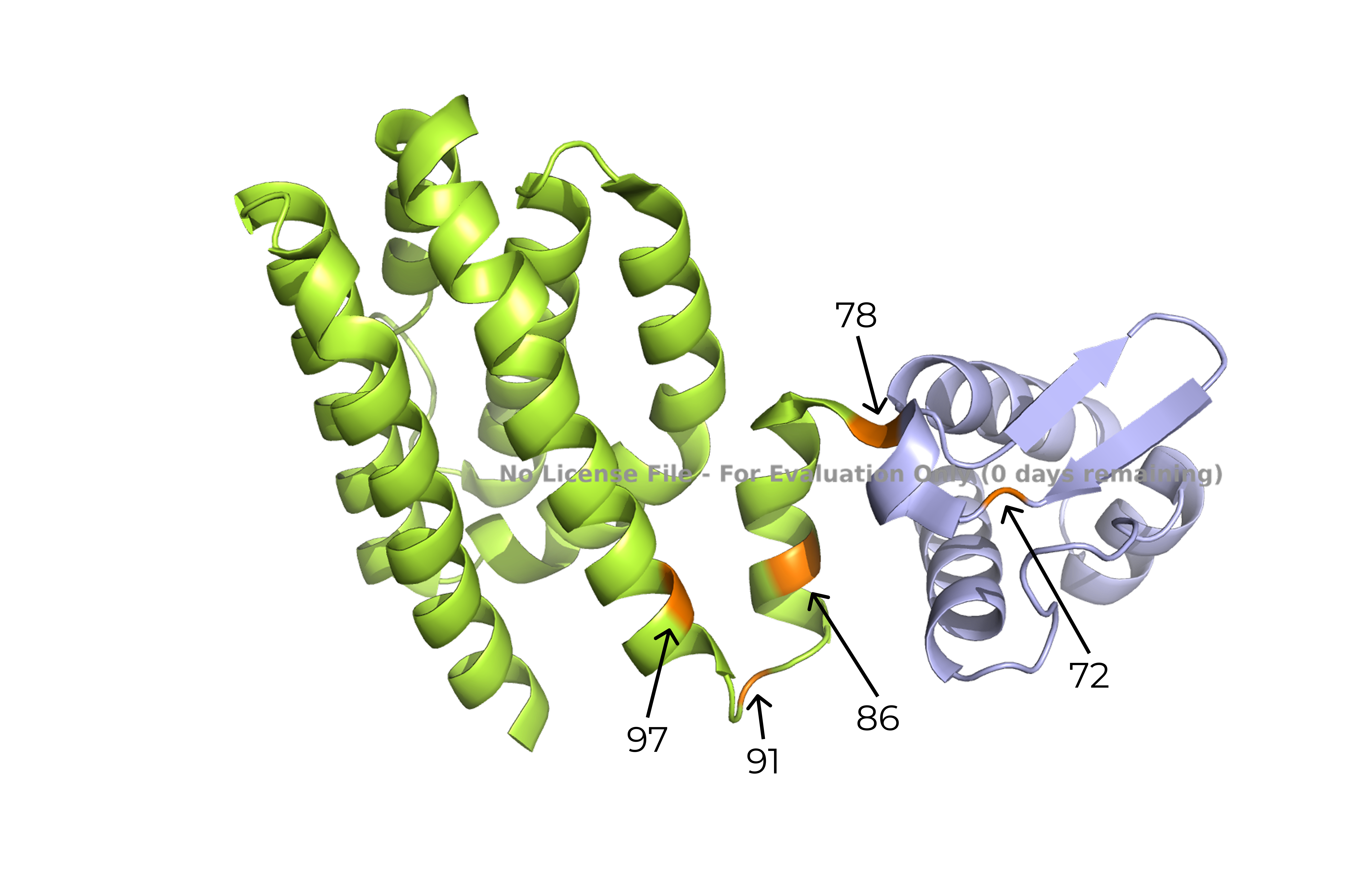
Рис 14. Все пики DOMAK
Чисто визуально, положение аминокислоты в 78 положении выглядит как логичное разделение домена. Поиск в SCOPE выдал такой же резульат:
