На главную
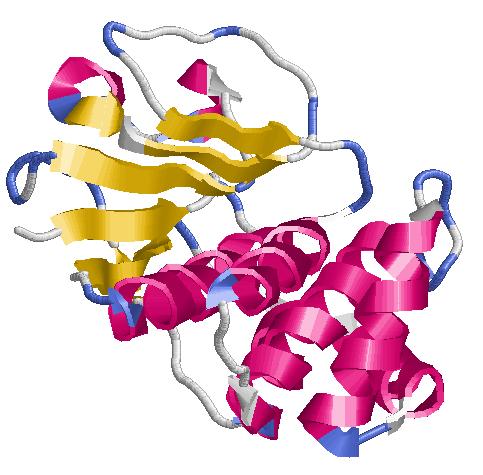
Вторичная структура белка PPAC_BACSU.
1)Структурный состав цепи А:
8 α-спиралей
7 β-тяжей
19 β-поворотов
Вывод: белок относится к α+β-белкам, так как в нем нет регулярного чередования спиралей и тяжей.
Выбраны структуры:
α-спираль 14-29 а.о.
Все пары β-тяжей в моем белке (цепь А) оказались параллельными, а их длина меньше либо равна требуемых
5-ти остатков, причем наиболее длинные тяжи не соседствуют друг с другом... Поэтому я взяла нужные структуры из предложенного белка (файл 1bs2.ent).
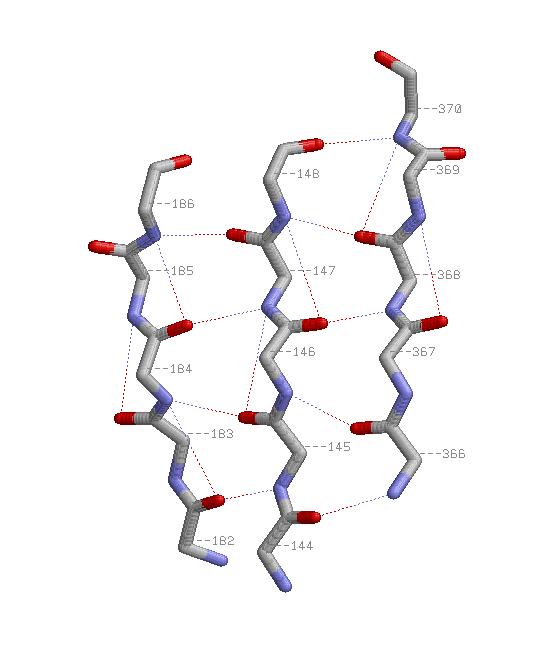
Пара соседних параллельных β-тяжей: 144-148 и 182-186 а.о.
Пара соседних антипараллельных β-тяжей: 100-106 и 109-114 а.о.
β-поворот: 64-67 а.о.
 2.Свойства α-спирали.
2.Свойства α-спирали.
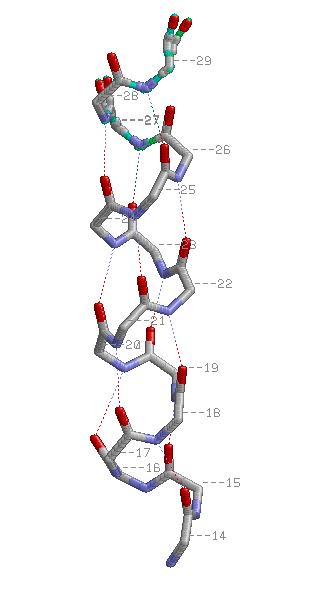
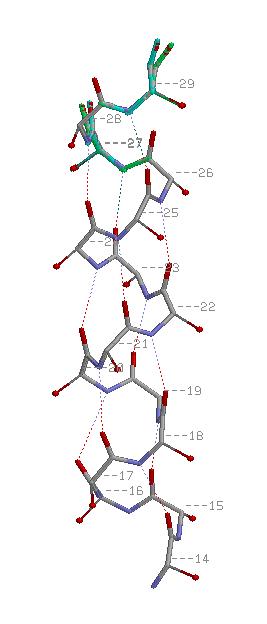 На обоих картинках спираль представлена в проволочной модели со стандартной раскраской по химическим элементам,
водородные связи показаны пунктиром. На правой картинке красными шариками изображены атомы C&beta.
Из картинки видно, что водородные связи в спирали возникают между атомом кислорода остовной части n-ого остатка
и азотом n+4-го. Паттерн: H(n,n+4), 14<=n<=25. Атомы C&beta расположены снаружи от спирали на продолжениях
её радиусов.
см. скриптhelix.spt
3.Свойства β-тяжа
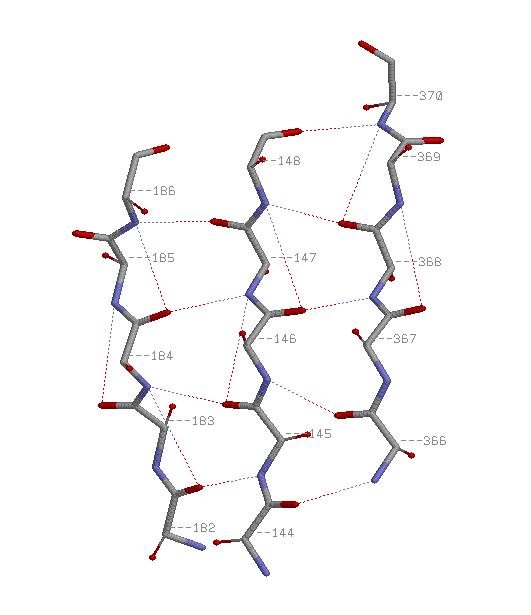
-Параллельные β-тяжи:
На обоих картинках спираль представлена в проволочной модели со стандартной раскраской по химическим элементам,
водородные связи показаны пунктиром. На правой картинке красными шариками изображены атомы C&beta.
Из картинки видно, что водородные связи в спирали возникают между атомом кислорода остовной части n-ого остатка
и азотом n+4-го. Паттерн: H(n,n+4), 14<=n<=25. Атомы C&beta расположены снаружи от спирали на продолжениях
её радиусов.
см. скриптhelix.spt
3.Свойства β-тяжа
-Параллельные β-тяжи:
 -Антипараллельные β-тяжи:
-Антипараллельные β-тяжи:
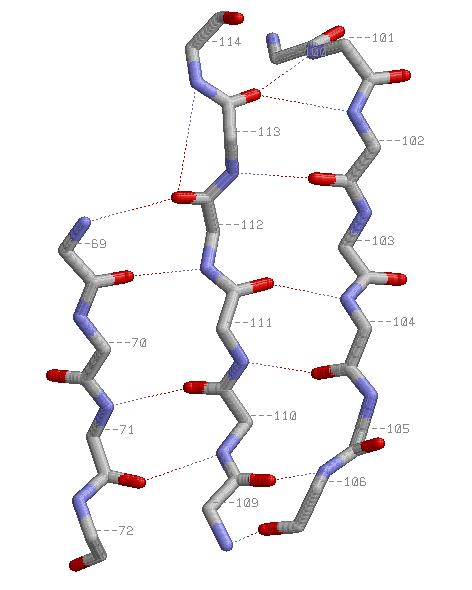
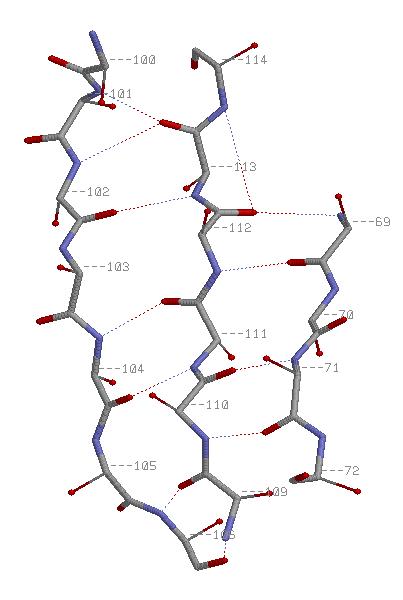 Хотя это и неочевидно из представленных картинок, атомы C&beta распологаются вне плоскости листа, чередуя полуплоскости через один а.о.
(Что можно заметить, поворачивая изображения в RasMol.)
4.Cвойства β-поворота
Хотя это и неочевидно из представленных картинок, атомы C&beta распологаются вне плоскости листа, чередуя полуплоскости через один а.о.
(Что можно заметить, поворачивая изображения в RasMol.)
4.Cвойства β-поворота
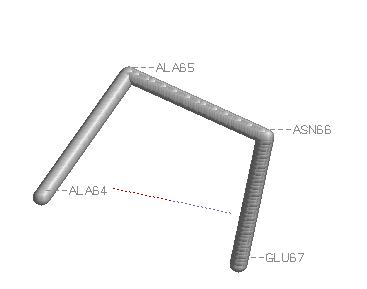
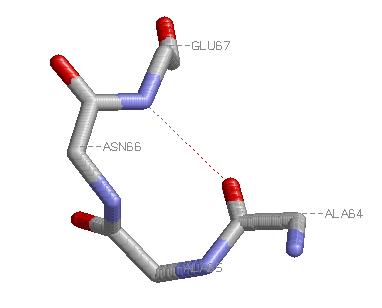 Поворот образуют Ala64, Ala65, Asn66, Glu67. Поворот скрепляет связь Н(64,67).
Поворот образуют Ala64, Ala65, Asn66, Glu67. Поворот скрепляет связь Н(64,67).
© Червонцева,2009
 2.Свойства α-спирали.
2.Свойства α-спирали.

 На обоих картинках спираль представлена в проволочной модели со стандартной раскраской по химическим элементам,
водородные связи показаны пунктиром. На правой картинке красными шариками изображены атомы C&beta.
Из картинки видно, что водородные связи в спирали возникают между атомом кислорода остовной части n-ого остатка
и азотом n+4-го. Паттерн: H(n,n+4), 14<=n<=25. Атомы C&beta расположены снаружи от спирали на продолжениях
её радиусов.
см. скриптhelix.spt
3.Свойства β-тяжа
-Параллельные β-тяжи:
На обоих картинках спираль представлена в проволочной модели со стандартной раскраской по химическим элементам,
водородные связи показаны пунктиром. На правой картинке красными шариками изображены атомы C&beta.
Из картинки видно, что водородные связи в спирали возникают между атомом кислорода остовной части n-ого остатка
и азотом n+4-го. Паттерн: H(n,n+4), 14<=n<=25. Атомы C&beta расположены снаружи от спирали на продолжениях
её радиусов.
см. скриптhelix.spt
3.Свойства β-тяжа
-Параллельные β-тяжи:

 -Антипараллельные β-тяжи:
-Антипараллельные β-тяжи:

 Хотя это и неочевидно из представленных картинок, атомы C&beta распологаются вне плоскости листа, чередуя полуплоскости через один а.о.
(Что можно заметить, поворачивая изображения в RasMol.)
4.Cвойства β-поворота
Хотя это и неочевидно из представленных картинок, атомы C&beta распологаются вне плоскости листа, чередуя полуплоскости через один а.о.
(Что можно заметить, поворачивая изображения в RasMol.)
4.Cвойства β-поворота

 Поворот образуют Ala64, Ala65, Asn66, Glu67. Поворот скрепляет связь Н(64,67).
Поворот образуют Ala64, Ala65, Asn66, Glu67. Поворот скрепляет связь Н(64,67).