Трансмембранные белки
1.
|
Альфа-спиральные трансмембранные белки
|
Трансмембранные бета-баррели
|
|
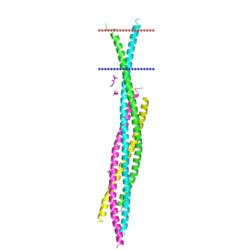
SNARE complex (syntaxin 1A, SNAP-25 and synaptobrevin 2) 3hd7
из Rattus norvegicus
|
|
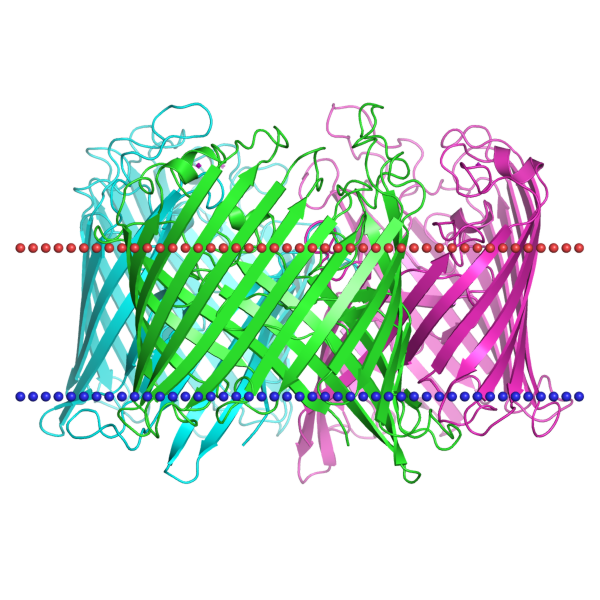
Sucrose-specific porin 1a0s
из Salmonella typhimurium
|

|
Aerobic respiration control sensor protein acrB 2ksd
из Escherichia coli
|
|
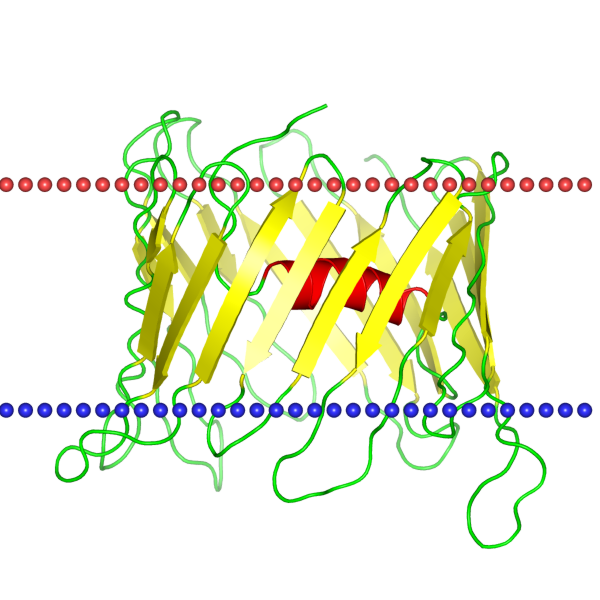
VDAC-1 channel 2jk4 - митохондриальный порин из Homo sapiens, находится на внешней мембране
|

|
Connexin 26 gap junction channel (beta-2 protein) 2zw3 из Spodoptera frugiperda. Образует электрический синапс.
|
|
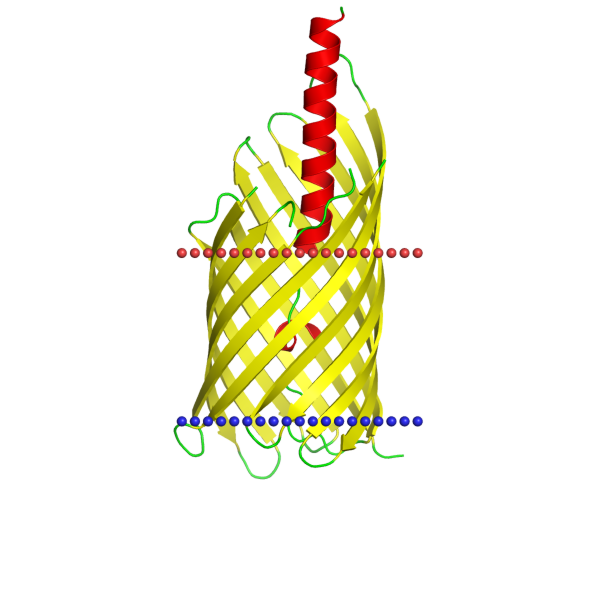
Hemoglobin-binding protease Hbp autotransporter 3aeh из Escherichia coli, находится на внешней мембране.
|

|
ClC chloride transporter 1ots из Escherichia coli, находится на внутренней мембране.
|
|
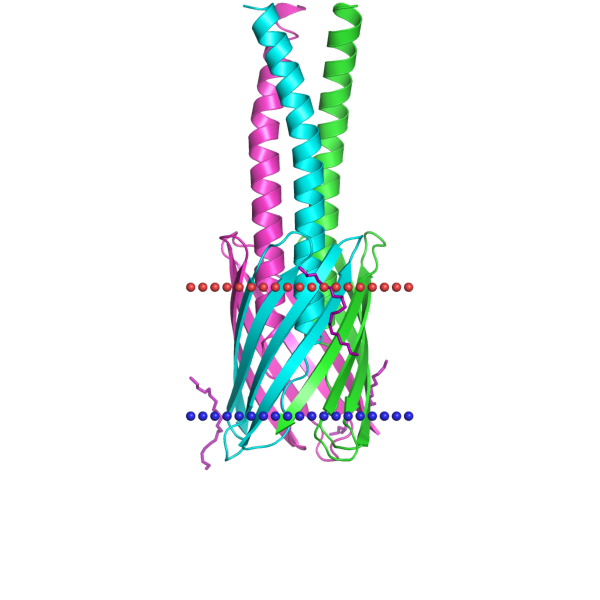
Autotransporter Hia 2gr7 из Haemophilus influenzae, находится на внешней мембране.
|
|
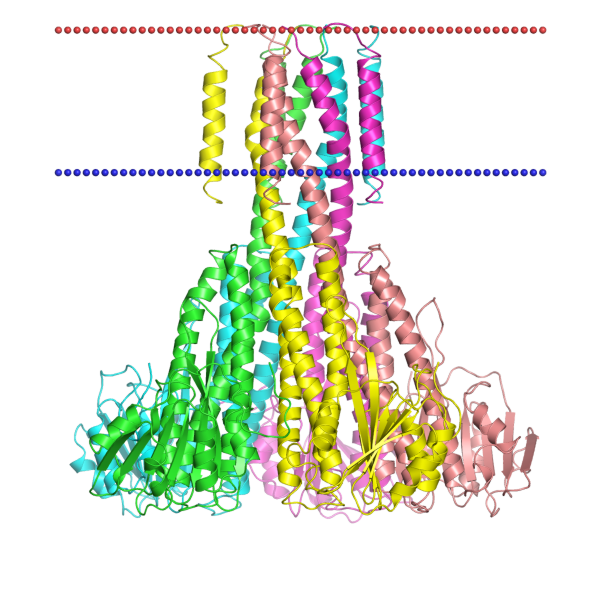
CorA magnesium transporter 2bbj из Thermotoga maritima, находится на внутренней мембране.
|
|
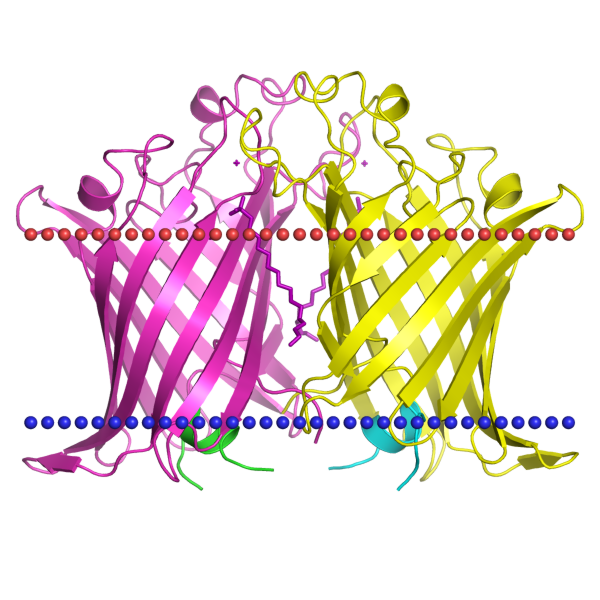
Outer membrane phospholipase A 1qd6 из Escherichia coli, гидролизует фосфолипиды
|
|
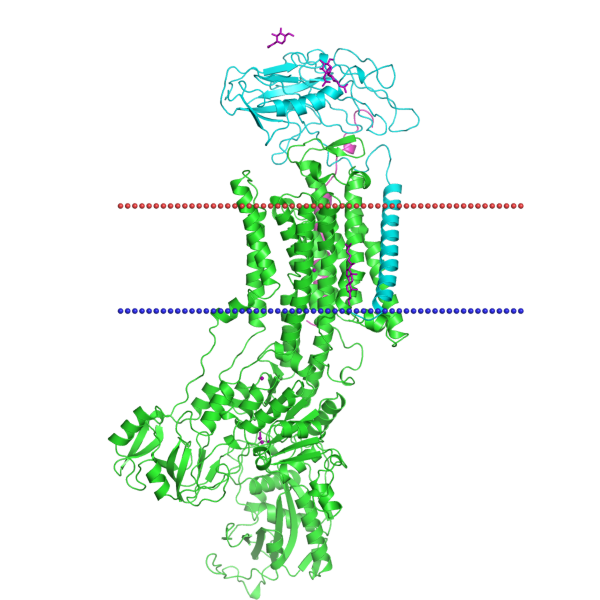
Sodium-potassium pump, E2-Pi state 2zxe из Squalus acanthias - калий-натриевый обменник. Формирует потенциал покоя.
|
|
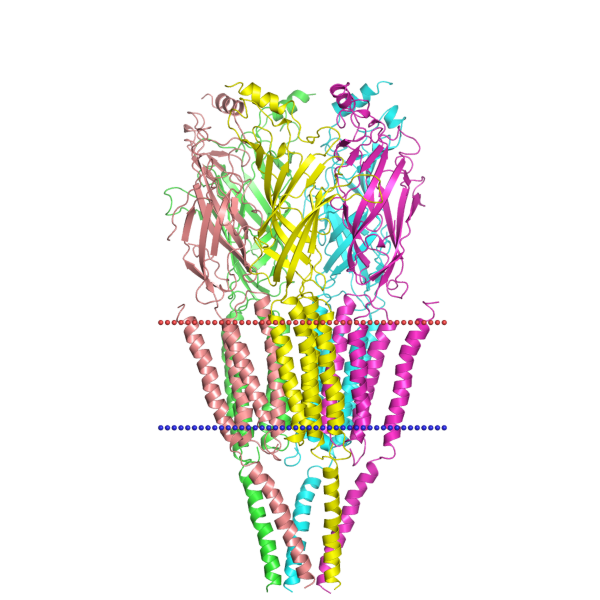
Nicotinic acetylcholine receptor, closed state 2bg9 из Torpedo marmorata. Согласно модели, приведенной в
"From Neuron to Brain" by John G. Nicholls et al. 2001, трансмембранными являются бета-листовые участки, поэтому я и поместила
его в этот столбец. Видимо, здесь имеет место изменение общепринятой точки зрения (?).
|
Трансмембранные белки очень разнообразны по функциям: комплекс SNARE осуществляет слияние транспортных визикул с мембраной,
2ksd - сенсорный белок, многие из них являются каналлами и осуществляют активный или пассивный транспорт, есть ферменты.
Морфологически трансмембранные белки различаются по типу трансмембранных участков, количеству субъединиц, местоположению (у митохондрий и
грам-отрицательных бактерий две мембраны), углу наклона в мембране, положению N- и С-конца белка (вне или внутри клетки).
| PDB код
|
Число цепей
|
Тип
(спираль, баррель)
|
Число трансмембранных участков в цепи
|
Число остатков в одном трансмембранном участке
(типичное, минимальное, максимальное)
|
(*) Толщина мембраны в ангстремах
(расстояние между атомами на границах
трансмембранных участков перпендикулярно мембране
|
| 2gr7
|
3
|
баррель
|
в каждой цепи по пять
|
для первого сегмента - семь, для остальных - по восемь
|
22.7 ± 2.0 А
|
| 2bg9
|
5
|
спираль
|
в каждой цепи по четыре
|
минимальное и типичное - 21, максимальное - 25
|
30.1 ± 1.1 А
|
То, что названо "топологией" на сайте opm, у них совпадает.
2.
Согласно Uniprot:
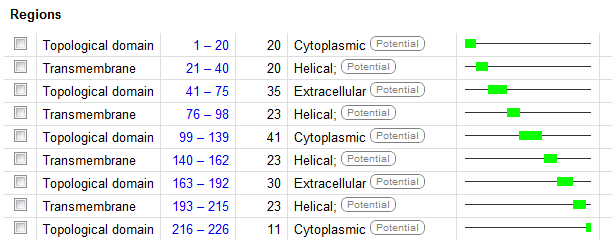 Согласно TMHMM - в точности то же самое:
sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 1 20
sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 21 40
sp_Q00977_CXB2_MOUSE TMHMM2.0 outside 41 75
sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 76 98
sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 99 139
sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 140 162
sp_Q00977_CXB2_MOUSE TMHMM2.0 outside 163 192
sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 193 215
sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 216 226
Согласно TMHMM - в точности то же самое:
sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 1 20
sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 21 40
sp_Q00977_CXB2_MOUSE TMHMM2.0 outside 41 75
sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 76 98
sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 99 139
sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 140 162
sp_Q00977_CXB2_MOUSE TMHMM2.0 outside 163 192
sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 193 215
sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 216 226
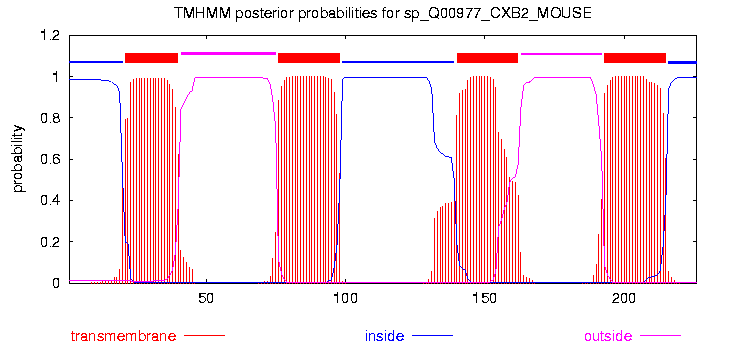 В этой картинке слегка странно, что шкала "probability" - вероятность, размечена до значения 1.2 :)
3.
Предложенный гомолог - B-субъединица белка щелевого контакта человека. При этом структура дана для всего щелевого
контакта, который состоит из 6-ти совершенно одинаковых субъединиц, которые, однако, при этом экспрессируются с
разных генов GJB1-6. (Совершенно непонятно, зачем... Может быть, это как-то способствует правильной сборке комплекса).
Исследуемый белок мыши, видимо, тоже обладает этой особенностью.
Структура гомолога
В этой картинке слегка странно, что шкала "probability" - вероятность, размечена до значения 1.2 :)
3.
Предложенный гомолог - B-субъединица белка щелевого контакта человека. При этом структура дана для всего щелевого
контакта, который состоит из 6-ти совершенно одинаковых субъединиц, которые, однако, при этом экспрессируются с
разных генов GJB1-6. (Совершенно непонятно, зачем... Может быть, это как-то способствует правильной сборке комплекса).
Исследуемый белок мыши, видимо, тоже обладает этой особенностью.
Структура гомолога
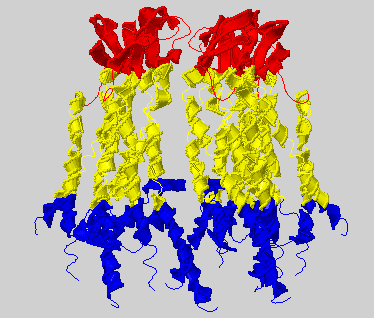 В цепи B предложенного гомолога PDBTM выделяет трансмембранные участки следующим образом:
1-1 неизвестно
2-24 сторона 2
25-50 ТМ
51-65 сторона 1
66-89 ТМ
90-109 сторона 2
110-124 неизвестно
125-139 сторона 2
140-159 ТМ
160-182 сторона 1
183-208 ТМ
209-217 сторона 2
218-226 неизвестно
Я не смогла понять, какую из сторон PDBTM считает цитоплазматической, а какую - внеклеточной.
Надо сказать, что данный белок и гомолог очень похожи - всего 6 точечных замен. TMHMM для гомолога
выдает практически то же самое, что весьма слабо соответствует структуре гомолога.
sp_P29033_CXB2_HUMAN TMHMM2.0 inside 1 20
sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 21 40
sp_P29033_CXB2_HUMAN TMHMM2.0 outside 41 75
sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 76 98
sp_P29033_CXB2_HUMAN TMHMM2.0 inside 99 131
sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 132 154
sp_P29033_CXB2_HUMAN TMHMM2.0 outside 155 192
sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 193 215
sp_P29033_CXB2_HUMAN TMHMM2.0 inside 216 226
Очень похожая работа для моего белка (предсказание вторичной структуры по тому же самому гомологу) представлена здесь.
А вот мое выравнивание с гомологом
4.
В цепи B предложенного гомолога PDBTM выделяет трансмембранные участки следующим образом:
1-1 неизвестно
2-24 сторона 2
25-50 ТМ
51-65 сторона 1
66-89 ТМ
90-109 сторона 2
110-124 неизвестно
125-139 сторона 2
140-159 ТМ
160-182 сторона 1
183-208 ТМ
209-217 сторона 2
218-226 неизвестно
Я не смогла понять, какую из сторон PDBTM считает цитоплазматической, а какую - внеклеточной.
Надо сказать, что данный белок и гомолог очень похожи - всего 6 точечных замен. TMHMM для гомолога
выдает практически то же самое, что весьма слабо соответствует структуре гомолога.
sp_P29033_CXB2_HUMAN TMHMM2.0 inside 1 20
sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 21 40
sp_P29033_CXB2_HUMAN TMHMM2.0 outside 41 75
sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 76 98
sp_P29033_CXB2_HUMAN TMHMM2.0 inside 99 131
sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 132 154
sp_P29033_CXB2_HUMAN TMHMM2.0 outside 155 192
sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 193 215
sp_P29033_CXB2_HUMAN TMHMM2.0 inside 216 226
Очень похожая работа для моего белка (предсказание вторичной структуры по тому же самому гомологу) представлена здесь.
А вот мое выравнивание с гомологом
4.
| |
Число а.к. остатков |
| Всего а.к. остатков в последовательности |
226 |
| Остатки, предсказанные TMHMM как локализованные в мембране (всего) |
89 |
| Правильно предсказали - совпадают с 3D предсказанием (true positives, TP) |
66 |
| Предсказали не то, что нужно (а.о. предсказаны как мембранные, а по данным 3D таковыми не являются, false positives, FP) |
23 |
| Правильно не предсказали ( не предсказаны, и по данным 3D не находятся в мембране, true negatives, TN) |
108 |
| Не предсказали то, что нужно (остатки по данным 3D находятся в мембране, false negatives, FN) |
29 |
| Чувствительность (sensivity) = TP / (TP+FN) |
0,69 |
| Специфичность (specificity) = TN / (TN+FP) |
0,82 |
| Точность(precision) = TP /(TP+FP) |
0,74 |
| Сверхпредсказание = FP/ (FP+TP) |
0,26 |
| Недопредсказание = FN / (TN+FN) | 0,21 |
Можно видеть, что эти два метода достаточно плохо согласуются.
Зато благодаря сравнению удалось понять, что сторона 2 в TMHMM - это цитоплазматическая сторона (так получается больше совпадений
в выравнивании).
Выводы. В белке мышиного щелевого контакта Q00977 следующие аминокислоты, скорее всего, находятся в соответствующих положениях:
1-24 внутри
25-50 ТМ
51-65 снаружи
66-89 ТМ
90-139 внутри
140-159 ТМ
160-182 снаружи
183-208 ТМ
209-226 внутри
Заключения были сделаны согласно структуре гомолога, позиции, соответствующие неизвестным структурам, были приписаны к соседним,
исходя из здравого смысла.
© Червонцева,2011






















Согласно TMHMM - в точности то же самое: sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 1 20 sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 21 40 sp_Q00977_CXB2_MOUSE TMHMM2.0 outside 41 75 sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 76 98 sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 99 139 sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 140 162 sp_Q00977_CXB2_MOUSE TMHMM2.0 outside 163 192 sp_Q00977_CXB2_MOUSE TMHMM2.0 TMhelix 193 215 sp_Q00977_CXB2_MOUSE TMHMM2.0 inside 216 226
В этой картинке слегка странно, что шкала "probability" - вероятность, размечена до значения 1.2 :) 3. Предложенный гомолог - B-субъединица белка щелевого контакта человека. При этом структура дана для всего щелевого контакта, который состоит из 6-ти совершенно одинаковых субъединиц, которые, однако, при этом экспрессируются с разных генов GJB1-6. (Совершенно непонятно, зачем... Может быть, это как-то способствует правильной сборке комплекса). Исследуемый белок мыши, видимо, тоже обладает этой особенностью. Структура гомолога
В цепи B предложенного гомолога PDBTM выделяет трансмембранные участки следующим образом: 1-1 неизвестно 2-24 сторона 2 25-50 ТМ 51-65 сторона 1 66-89 ТМ 90-109 сторона 2 110-124 неизвестно 125-139 сторона 2 140-159 ТМ 160-182 сторона 1 183-208 ТМ 209-217 сторона 2 218-226 неизвестно Я не смогла понять, какую из сторон PDBTM считает цитоплазматической, а какую - внеклеточной. Надо сказать, что данный белок и гомолог очень похожи - всего 6 точечных замен. TMHMM для гомолога выдает практически то же самое, что весьма слабо соответствует структуре гомолога. sp_P29033_CXB2_HUMAN TMHMM2.0 inside 1 20 sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 21 40 sp_P29033_CXB2_HUMAN TMHMM2.0 outside 41 75 sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 76 98 sp_P29033_CXB2_HUMAN TMHMM2.0 inside 99 131 sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 132 154 sp_P29033_CXB2_HUMAN TMHMM2.0 outside 155 192 sp_P29033_CXB2_HUMAN TMHMM2.0 TMhelix 193 215 sp_P29033_CXB2_HUMAN TMHMM2.0 inside 216 226 Очень похожая работа для моего белка (предсказание вторичной структуры по тому же самому гомологу) представлена здесь. А вот мое выравнивание с гомологом 4.